개인노출평가 기반 PM2.5 흡입량에 따른 노출환경별 노출양상과 호기산화질소와의 연관성
Abstract
Exposure to fine particle (PM2.5, particles with an aerodynamic diameter≤2.5 μm) has been demonstrated to be associated with adverse health effects, including local and systemic inflammation in the body, lung function decline and increases in mortality and morbidity of cardiopulmonary diseases. Fractional exhaled nitrogen oxide (FeNO) is a non-invasive surrogate marker of airway inflammation and chronic airway inflammation is a key characteristic in the pathogenesis of asthma. Existing fine particle exposure evaluation methods were mainly evaluated with air pollution concentration data measured by outdoor air pollution monitoring stations and used measurements from monitoring stations close to the subject’s residence. However, there can be a difference in the geographical location of the measuring station and the geographical location of each individual’s living behavior radius. In this study, exposure assessment was conducted considering individual activity patterns to minimize uncertainties caused by using air pollution measurement data. In this study, the concentration and physical activity of fine particle by micro-environment were measured, the contribution and exposure intensity by micro-environment were calculated based on the average daily fine particle exposure, and the fractional exhaled nitrogen oxide index was repeatedly measured to confirm changes due to fine particle exposure. Exposure contribution by micro-environment was the highest at home (70%). On the other hand, exposure intensity was the highest at job/school (20%). This means that even if the exposure time is short in a real environment, the intensity may appear higher in other environments depending on the inhalation exposure dose. The results of the fractional exhaled nitrogen oxide index due to fine particle exposure showed a significant increase in 1.9% (95% CI: 0.9, 2.9) on 0 lags of time difference when fine particle increased by 10 μg/m3.
Keywords:
Exposure assessment, PM2.5, Fractional exhaled nitrogen oxide (FeNO), Inhaled dose, Physical activity1. 서 론
실내·외 대기오염은 심혈관 질환, 뇌졸중, 호흡기질환, 암 등 여러 건강 상태와 관련된 환경 위험 요소로, 2016년 전 세계적으로 약 700만 명이 사망하였다 (WHO, 2021). 대표적인 대기오염물질 중 하나인 입자상 물질 (Particulate matter, PM)은 구성요소가 서로 다른 물리적, 화학적 특성을 갖는 작은 직경을 가진 입자의 복잡한 혼합물이다 (Rodulfo-Cárdenas et al., 2023). 입자상 물질은 공기역학적 직경에 따라 분류되며, PM10은 직경 10 µm 미만의 입자를 의미하고 PM2.5는 직경이 2.5 µm 미만인 미세입자를 의미한다 (Rodulfo-Cárdenas et al., 2023). 다양한 공기역학적 직경을 가진 미세먼지는 서로 다른 위치의 기도에 침착되기 쉬워, 폐 손상에 영향을 줄 수 있다 (Huang et al., 2023; Amatullah et al., 2012). 특히, PM2.5 노출은 국소 및 전신 염증, 폐 기능 저하, 심폐 질환의 사망률 및 이환율 증가를 포함한 건강상의 악영향과 관련이 있는 것으로 입증되었다 (Xu et al., 2018; Brook et al., 2010). 여러 연구에 따르면 초미세먼지에 단기 및 장기적으로 노출되는 것은 호기산화질소 (Fractional exhaled nitric oxide, FeNO)를 포함한 염증 지수와 관련 있는 것으로 나타났으며 기도 염증은 천식 발병 기전의 중요한 특징 중 하나이다 (Chen et al., 2015; Zhao et al., 2013; Brook et al., 2010). FeNO는 높은 재현성과 비침습적 특성으로 인해 기도 염증의 지표로써 다양한 임상 및 역학 연구에서 사용하고 있다 (Xu et al., 2018; Rao and Phipatanakul, 2016; Dweik et al., 2011).
기존 미세먼지 노출평가 방법에 대한 연구는 주로 실외 모니터링 자료인 대기오염 측정소에서 측정된 대기오염 농도 자료로 평가되었으며, 단순하게는 개인 거주지에서 가장 가까운 측정소의 측정치 또는 근접한 여러 개의 측정소 측정치의 가중 평균, 거주지가 속한 행정 구역 내 관측소 측정치의 평균을 이용하였다 (Tseng et al., 2015; Ueda et al., 2012; Zhang et al., 2011; Ostro et al., 2010; Laden et al., 2006; Pope Iii et al., 2002). 하지만 측정소의 지리적 위치와 개인별 생활행동 반경의 지리적 위치에 차이가 발생할 수 있다. 또한, 실제 환경의 다양한 노출원 (교통, 요리, 흡연 등)에 영향을 받는 PM2.5 노출량은 대기측정망 측정 결과와 다르게 나타날 수 있다. 즉, 노출원에 영향을 주는 개인의 생활행동양상에 따라 개인 평균 노출수준의 오차가 나타날 수 있다 (Steinle et al., 2013; Setton et al., 2011). 대기오염물질에 대한 개별 노출은 다양한 출처에서 비롯될 수 있는 노출환경에서 발생하며, 수용체가 시간을 보내는 여러 장소를 고려하여 직접 측정하는 것이 대표적인 방법이다 (Cunha-Lopes et al., 2019). 흡입량은 신체활동을 하는 동안 대기오염의 잠재적 건강 위험을 추정하는 중요한 지표이며, 흡입률을 평가하는 방법으로는 활동 유형을 신체활동 수준으로 나타내 흡입 비율로 변환하는 것이 포함된다 (Ainsworth et al., 2011). 개인노출 선행 연구에 따르면 흡입량 산출에 고려되는 호흡률 (Inhalation rate)을 신체활동 (physical activity, PA)에 대한 측정 없이 생활행동일지나 노출계수 핸드북만을 활용한 경우가 많다 (Wang et al., 2014; Buonanno et al., 2011; Soggiu et al., 2010). 이러한 방법은 대상자의 실제 신체활동이 고려되지 않아 개인의 특성이 반영되지 않는 불확실성을 가지고 있어, 실시간의 활동도를 측정하여 흡입량을 도출하는 것이 중요하다.
본 연구에서는 대기오염 측정 자료만을 활용한 기존 노출평가의 불확실성을 최소화하기 위해 개인별 생활행동양상이 고려된 노출평가를 진행하였다. 세부적으로는 1) 각 노출환경별 PM2.5 농도와 해당 시간대별 신체활동도를 측정하고, 2) 흡입률을 기반으로 한 일일 평균 PM2.5 노출량을 통해 노출환경별 노출기여도 및 노출강도를 산출했으며, 3) FeNO 지표를 반복 측정하여 PM2.5 노출에 따른 변화를 확인하였다.
2. 실험 방법
2. 1 연구대상 및 설문조사
본 연구는 2021년 12월부터 2023년 11월까지 병원에 방문하는 환자를 대상으로 경상남도 남해군, 인천광역시, 서울 등의 지역에 거주하는 어린이 20명, 성인 97명에게 개인노출평가 연구 참여 동의를 얻었다. 세브란스병원 생명윤리위원회 (Institutional Review Board, IRB)에 승인 (IRB 과제 번호: 4-2023-1314)을 받아 연구를 수행하였다. 본 연구는 병원에 방문하는 사람을 대상으로 하기 때문에 되도록 PM2.5에 취약한 기저질환자를 모집하여 FeNO에 대한 영향을 확실하게 확인하고자 하였다. 따라서 성인 대상자는 호흡기계, 순환기계, 뇌졸중, 노인 인구의 특성을 가지는 사람으로 모집되었다. 하지만 보호자의 동의를 얻어야 하는 어린이의 경우 기저질환이 있을 시 연구 참여에 어려움이 있어, 건강검진으로 방문한 사람을 대상으로 동의를 얻었다.
성인 대상자의 경우 2021년 12월~2023년 8월까지 97명에 대한 개인노출평가를 실시하였으며, 대상자의 거주지에 직접 방문하여 5일 동안 측정하였다. 5일간 실내·외 환경에서 PM2.5 장비를 소지하도록 하고, 노출환경에서의 호흡률을 도출하고자 신체활동 측정 장비를 착용하도록 하였다. PM2.5 노출에 의한 염증기도 영향을 보고자 FeNO 검사는 5일간 매일 방문하여 반복적으로 측정하였다. 어린이 대상자 20명에 대한 개인노출평가는 2023년 10~11월에 실시되었으며, 초등학교 노출환경을 포함한 실내·외 환경에서 PM2.5 장비를 연구자가 직접 착용한 뒤 동행하고, 신체활동 측정과 FeNO 검사는 성인 대상자와 동일한 방식으로 진행되었다.
설문은 병원 방문 시 시행되었고, 설문 문항은 일반 가정 및 생활 조사 문항 (5문항), 과거력 (고혈압, 천식, 암 등) 및 건강 관련 문항 (10문항)으로 구성되었으며, 자가 진단 답변과 실제 진단받은 진료 기록을 토대로 정보를 수집하였다. 설문 문항을 통해 주변 환경관련 조사뿐만 아니라 기저질환과 신체활동 등의 설문을 진행하여 FeNO 측정 결과에 영향을 주는 다양한 변수를 파악하고자 하였다.
2. 2 환경 측정
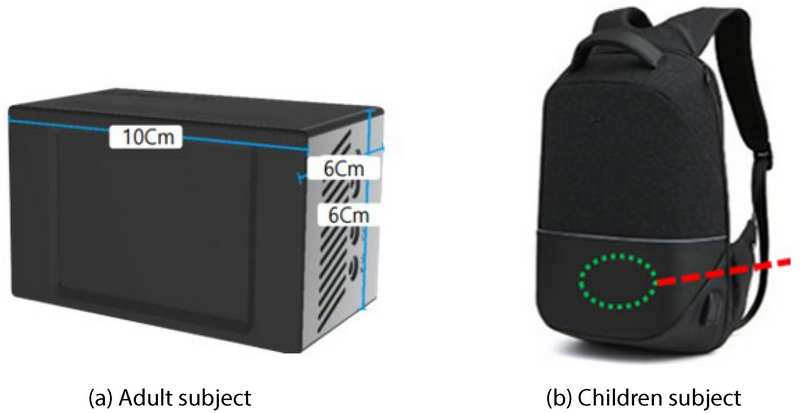
개인의 PM2.5 노출수준을 확인하고자 개인노출평가를 실시하였다. 환경유해인자 측정은 실시간 측정이 가능한 광산란 방식의 휴대형 장비인 MDMU-9110 (OMNISENSE, Republic of Korea)의 PM2.5 센서를 이용하였다. 성인 대상자의 경우 장비를 직접 소지하도록 하였고 이를 고려하여 경량화된 소형 장비를 지급하였다. 어린이 대상자의 경우 학교 생활 중 소지에 어려움이 있고 무게에 대한 부담이 있어 백팩 형태로 바꿔 연구진이 직접 착용한 후 동행하였다.
측정 데이터는 LTE 방식으로 웹 플랫폼에 실시간 송출이 가능하여 연구진이 확인 후 이상이 있을 시 연락이나 방문을 통해 발생 문제를 처리하였다. 대상자가 머물고 있는 노출환경 정보와 해당 환경에서의 노출시간을 파악하고자 생활활동일지를 지급하고 이동할 때마다 수기로 작성하여 시간에 따른 노출환경을 파악하였다. 노출환경은 명확하게 구분될 수 있는 공간인 가정, 실외, 직장/학교, 식당/급식실, 이동수단 (자동차, 택시, 버스, 지하철)과 그 외에 다중이용시설 (대규모 점포, 지하도 상가 등)로 분류될 수 있는 환경을 기타실내로 통틀어 명명하였다. 측정된 개별 PM2.5 농도는 주변 상대습도에 영향을 받는 광산란 방식으로 데이터에 이상치 (Outlier)가 나타날 수 있다. 따라서 이상치가 결과에 미치는 영향을 최소화하고자 이상치 검출의 대표적 방법인 IQR 알고리즘을 사용하였고, IQR 알고리즘에서 정의하는 이상치는 Q1-1.5×IQR 이하의 값 그리고 Q3+1.5×IQR 이상의 값으로 정의된다 (Wan et al., 2014). 해당 방법을 통해 이상치 제거 작업을 실시하였으며, 이상치 제거에 따른 결측값은 최근 관측치 평균 수준에 가중을 두는 단순이동평균법 (Simple Moving Average Method)을 사용해 평활화하였다.
2. 3 호기산화질소 (FeNO) 검사
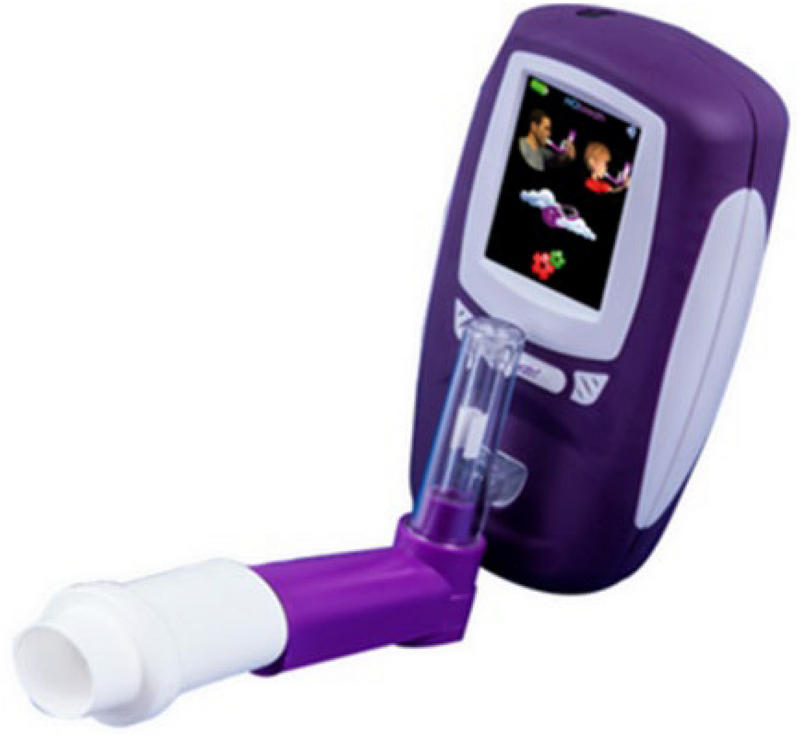
기도 내 염증 정도를 나타내는 유용한 지표인 호기산화질소 (FeNO)를 확인하기 위해 노출평가 시 5일간 반복적으로 검사를 실시하였다. 노출평가 시 측정은 전기화학식 측정기 NObreath (Bedfont Scientific Ltd., UK)를 사용하였다 (그림 2). 측정은 미국흉부학회와 유럽호흡기학회의 지침을 따라 앉은 자세에서 연속 3회 측정되었다 (ATS/ERS, 2005). 검사를 시작하면 대상자의 연령에 따라 해당하는 아이콘 (성인 또는 어린이)을 선택한 후 마우스피스를 통해 숨을 내쉬도록 하였다. 성인의 경우 약 12초, 어린이의 경우 약 10초간 호기가 이뤄졌다.
2. 4 신체활동도 모니터링
개인이 처한 환경에서의 활동도는 다르게 나타나므로, 실시간으로 개별 활동도를 측정하기 위해 Accelerometer 장비 ActiGraph wGT3X-BT (ActiGraph, USA)를 사용하였다.
해당 장비는 30~100 Hz 샘플링 속도로 가속도를 측정하여 활동 카운트를 출력하며 출력되는 카운트가 높을수록 더 높은 활동 수준을 나타낸다 (Memari et al., 2013). 측정 단위는 대사당량인 METs (Metabolic equivalents) 단위로 측정되며, METs는 소비에너지를 안정 시의 대사량과 비교하여 표시한 것으로 1 Met는 안정 시 1분 동안 소비하는 산소량을 의미한다 (Ainsworth et al., 2000). 해당 장비를 착용하고 활동했을 때, 안정상태 및 열량 소비를 나타내는 수치로 활동도를 확인할 수 있으며, 1 MET=3.5 mL/kg/min이다. 연구대상자의 활동도는 샤워나 물에 들어가는 경우를 제외하고 신축성 벨트를 5일 연속 허리에 착용하여 실 시간으로 활동량을 측정하였다. 개별 활동도를 구별 할 수 있는 측정 데이터는 성인의 경우 “안정 시<1952 (counts/min) (3 METs)”, “1952 (counts/min) (3 METs) ≤걷기<5725 (counts/min) (6 METs)”, “5725 (counts/min) (6 METs)≤빠르게 걷기”로 활동도를 구분하였다 (Freedson et al., 1998). 측정된 ActiGraph wGT3X-BT 활동도 자료는 연속적으로 측정이 이루어졌으며, 해당 자료를 개별 호흡률로 변환하기 위해 ‘한국인의 노출계수 핸드북 (NIER, 2019)’에서 우리나라 성인·어린이의 성별 및 연령에 따른 행동 단계별 호흡률 기준 (표 1)과 연계하여 시공간별 활동도가 고려된 호흡률로 산출하였다.
2. 5 PM2.5 흡입량 추정
각 대상자의 PM2.5 일일 노출량은 PM2.5 농도와 개별 활동패턴에 따른 호흡률의 곱으로 산출되었다 (Cunha-Lopes et al., 2019).
여기서 Cj는 노출환경 (j)의 분당 PM2.5 농도 (µg/m3/min)이고, IRji는 노출환경 (j)에서의 호흡 단계 (i)별 분당 호흡률 (m3/min), J는 노출평가 시 노출환경의 총 수이다.
일일 노출 및 흡입량에 대한 각 노출환경의 중요성을 나타내기 위해 선행 연구에서 정의된 노출기여도 수식을 사용해 계산되었다 (Lizana et al., 2020). 노출기여도는 대상자의 전체 PM2.5 흡입량과 노출환경별 분당 노출량 비를 통해 확인하였다. 따라서 노출기여도는 노출환경에서의 PM2.5 농도, 신체활동 강도에 따른 호흡률, 실제 체류시간에 영향을 받아 산출되며, 해당 환경에서의 농도, 체류시간, 호흡률에 따라 기여도 값에 영향을 줄 수 있다.
여기서 Cj는 노출환경 (j)의 분당 PM2.5 농도 ((µg/m3/min)이고, tj는 노출환경 (j) 체류시간 (min), IRji는 노출환경 (j)에서의 호흡 단계 (i)별 분당 호흡률 (m3/min)이다.
노출환경에서의 기여도를 보다 정확히 파악하기 위해 일일 흡입량 기준 노출 강도를 산출된 노출기여도와 노출환경별 일일 체류시간의 비에 의해 계산하였다 (Cunha-Lopes et al., 2019). 노출강도는 노출환경에서 실제 체류 시간을 일일 (24hr) 노출시간으로 보정해주어 노출환경별로 24시간 동안 노출되었을 때 해당 환경에서의 농도와 호흡률에 따라 노출되는 강도를 산출한 값이다.
2. 6 통계분석
누적 PM2.5 평균 농도와 FeNO 사이의 연관성을 추정하기 위해 선형 혼합 효과 (Linear Mixed-Effects, LME) 모델을 사용하였다. 선형 혼합 효과 모델을 통해 변량 효과 절편 및 복합 대칭성 공분산 구조를 갖도록 가정하여 개인별 반복 측정 간의 상관관계를 설명하였다. PM2.5 농도가 10 µg/m3 증가할 때마다 추정된 FeNO의 변화는 거주 지역을 통제한 후 95% 신뢰구간 (Confidence Intervals, CI)과 함께 결정되었다. 모든 통계분석은 R software (version 4.2.2)를 사용하여 수행되었으며, “lmer” 패키지를 사용하고 P-value< 0.05에서 통계적으로 유의한 것으로 간주되었다.
3. 결 과
표 2는 대인 면접 설문조사를 통해 얻은 개인노출평가 대상자 117명의 연령대별 집단과 신체적 특성 및 환경 측정 데이터를 보여준다. 연령에 따른 일일 생활행동양상 및 신체활동에 차이가 나타나는 것을 고려하여 전체 대상자를 연령대별로 그룹화하였다. 10~13세를 어린이로 분류하고, 성인의 경우 23~59세 집단과 60세 이상 집단으로 나눠 분석하였다. 모든 집단에서의 남녀 성비는 대략적으로 남성 60%, 여성 40%로 나타났다. 거주 지역은 인구 500만을 기준으로 도시, 시골 지역으로 나눴으며, 10~13세의 경우 모든 대상자가 도시에 거주하였다. 23~59세는 도시 30%, 시골 70%이고, 60세 이상에서는 도시 49%, 시골 51%로 시골 지역에서 조금 더 많이 거주하였다. 기저질환에서 어린이의 경우 천식이 나타났지만, 성인 대상자는 연령이 증가할수록 고혈압, 암이 높은 비율을 차지하였다. 흡연과 음주 여부에 대한 설문은 어린이의 경우 전부 “아니오”로 응답하였다. 성인 대상자는 10%로 비교적 소수가 흡연하고, 음주 항목은 45~50%로 높은 비율을 나타냈다. 시계열적 성질에 의해 모든 집단의 PM2.5 중량 농도는 다르게 나타났으며, 일평균 PM2.5 농도 수준은 8.2~12.3 µg/m3였다. 연구 참여자 대부분 거주 지역이 대도시 기반이고 대기측정망 지점에서 측정되는 PM2.5 농도의 수준이 조금씩은 다를 수 있지만, 가변성 (Variability)에 반해 개인의 생활행동양상에 의한 노출 차이가 훨씬 더 크게 나타났다. 개인에 따라 최소 5 µg/m3부터 최대 97 µg/m3 값으로 차이가 나타났다.
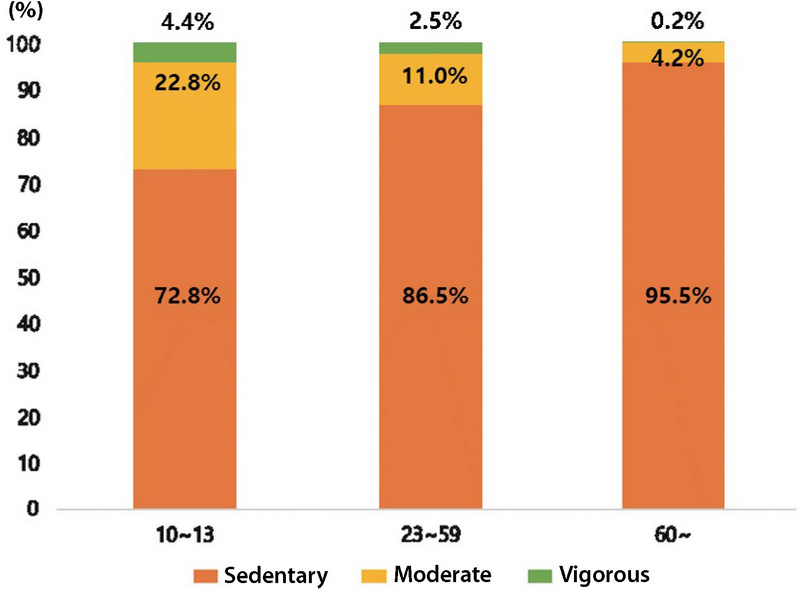
연령에 따라 신체활동 정도가 다르게 나타나, 그룹화하지 않았을 때 노출기여도 및 노출강도에 대한 결과가 왜곡될 수 있다. 집단별로 나타나는 신체활동도는 그림 4와 같으며, 모든 연령에서 안정 시 활동이 70% 이상으로 가장 높은 비율을 차지하였다. 10~13세 집단의 경우 걷기 22.8%, 빠르게 걷기 4.4%로 나타났고, 23~59세 집단은 걷기 11.0%, 빠르게 걷기 2.5%로 나타났다. 60세 이상 집단의 경우 걷기가 4.2%로 집단 중 가장 낮게 나타났고 빠르게 걷기 (0.2%) 활동은 미미한 수준으로 나타났다.
집단에 따라 대상자가 머무는 노출환경에서 나타나는 신체활동을 보고자 안정 시, 걷기, 빠르게 걷기로 구분하여 표 3에 나타냈다. 세 개의 집단 모두 가정에서 머무는 시간이 60% 이상으로 매우 높지만, 평균 PM2.5의 농도는 다른 환경에서 더 높게 나타나는 것을 확인할 수 있었다. 또한, 가정 노출환경에서는 걷기와 빠르게 걷기의 신체활동이 활발히 일어나지 않고, 10~13세 집단과 23~59세 집단의 경우 이동수단과 실외에서 가장 높은 신체활동도를 보였다.
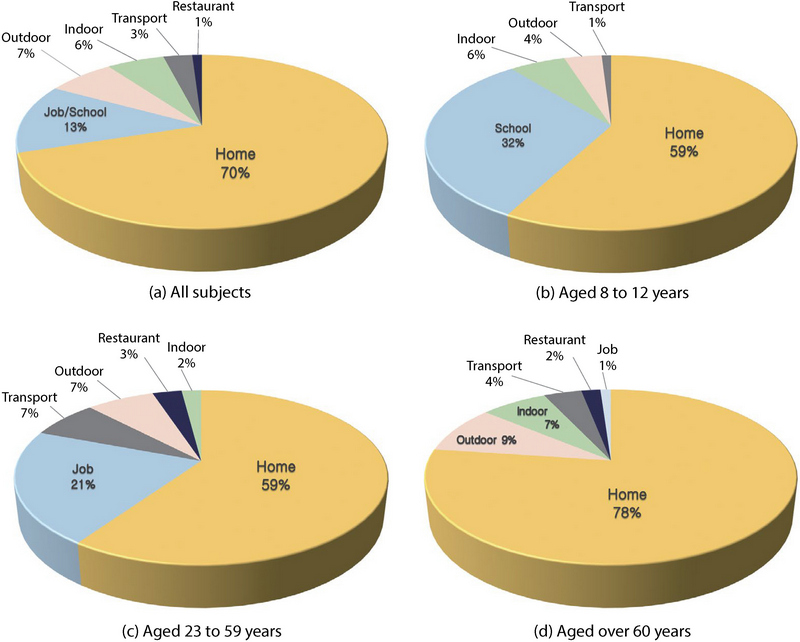
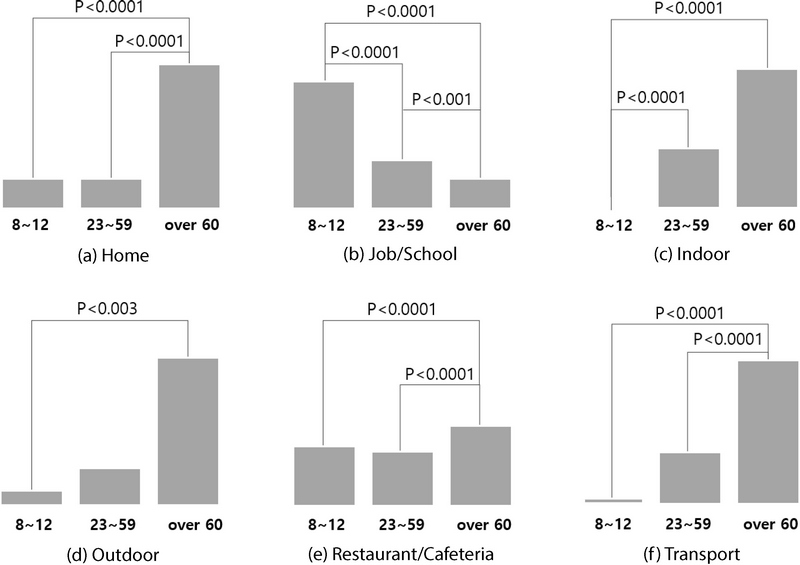
그림 5는 생활활동일지를 통해 일일 시간 활동패턴을 파악하여 도출된 노출환경별 노출기여도 결과를 보여준다. 전체 대상자의 경우 PM2.5 노출기여도가 가정 (70%), 직장/학교 (13%), 실외 (7%), 기타실내 (6%), 이동수단 (3%), 식당 (1%)의 순으로 나타났고, 특히 가정 내에서의 노출기여도가 70%로 높게 나타났다. 10~13세 집단은 가정 (59%), 학교 (32%), 기타실내 (6%), 실외 (4%), 이동수단 (1%) 순으로 나타났다. 23~59세 집단은 가정 (59%), 직장 (21%), 이동수단 (7%), 실외 (7%), 식당 (3%), 기타실내 (6%)로 나타났고, 60세 이상 집단에서는 가정 (78%), 실외 (9%), 기타실내 (7%), 이동수단 (4%), 식당 (2%), 직장 (1%)으로 나타났다. 모든 집단에서의 결과는 가정이 1순위가 맞으나, 학교 또는 직장 활동이 많은 10~13세, 23~59세 대상자의 경우 직장/학교 노출환경의 비율이 각각 32%, 21%로 높게 나타났다. 반면, 주로 사회활동을 하지 않는 60세 이상 집단은 가정에서 머무르는 시간이 하루의 상당 부분을 차지하고 있어, 노출기여도 결과가 가정에 편향되게 나타났다. 또한, 노출기여도에 따른 노출환경에서의 집단 간 상관성을 확인한 결과 모든 노출환경에서 유의성을 확인하였으며, 사후분석을 통해 대응별 상관성이 있는 집단의 통계적 유의성이 확인되었다 (그림 6).
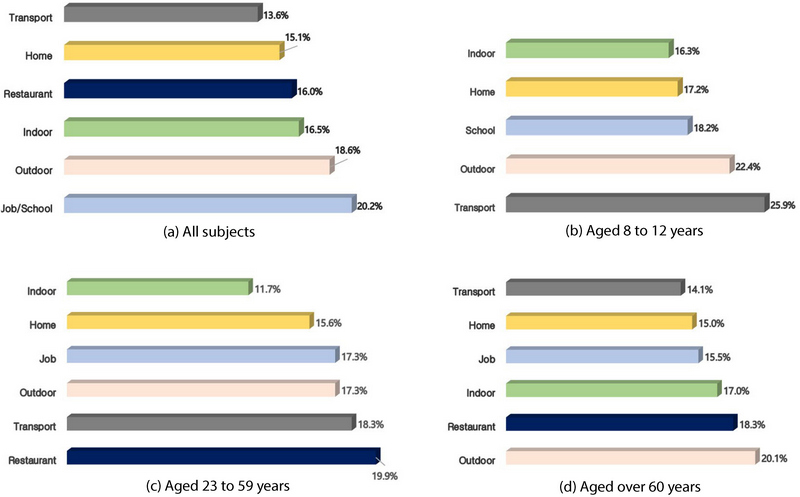
그림 7은 PM2.5 노출기여도에 대해 단위 노출시간이 보정된 노출환경별 노출강도를 보여준다. 전체 대상자의 경우 PM2.5 노출강도가 직장/학교 (20.2%), 실외 (18.6%), 기타실내 (16.5%), 식당 (16.0%), 가정 (15.1%), 이동수단 (13.6%)의 순으로 나타났고, 직장/학교에서 20.2%, 식당/급식실에서 18.6%로 높은 노출강도가 나타났다. 10~13세 집단은 이동수단 (25.9%), 실외 (22.4%), 학교 (18.2%), 가정 (17.2%), 기타실내 (16.3%)로 나타났다. 23~59세 집단은 실외 (20.1%), 식당 (18.3%), 기타실내 (17.0%), 직장 (15.5%), 가정 (15.0%), 이동수단 (14.1%)으로 나타났고, 60세 이상 집단에서는 식당 (19.9%), 이동수단 (18.3%), 실외 (17.3%), 직장 (17.3%), 가정 (15.6%), 기타실내 (11.7%)로 나타났다. 이처럼 세부적인 노출강도 패턴은 연령별 행동양상에 따라 다르게 나타난다. PM2.5 노출기여도에서는 모든 결과가 가정 노출환경에서 가장 높은 결과를 보였지만, 단위 노출시간이 보정된 노출강도의 경우 다른 결과를 나타냈다. 전체 대상자의 노출강도에서 가정은 15%에 그쳤고, 각 집단 결과에서도 이동수단 (25.9%), 식당 (19.9%), 실외 (20.1%)에서의 노출강도가 각각 1순위로 나타났다.
표 4는 PM2.5 노출에 따른 FeNO 지표에 미치는 연관성에 대한 결과이다. 본 연구에서는 FeNO의 측정 시점부터 24시간 (0~24hr) 동안의 흡입량 기반의 PM2.5 노출에 의한 급성영향을 분석하고자 하였으며, 5일간 반복 측정한 값을 단일 시차로 나눠 지연 효과를 분석하였다. 분석 결과 세 집단 중 60세 이상의 집단에서 유의미한 결과를 보였고, 24시간 흡입량 기반의 평균 PM2.5가 10 µg/m3씩 증가할 경우 시차 0일에 2.1% (95% CI: 0.8, 3.3) FeNO 증가가 나타났다. 모든 대상자에서도 PM2.5가 10 µg/m3씩 증가할 때 시차 0일 에 1.9% (95% CI: 0.9, 2.9) FeNO 증가와 관련이 있음을 확인하였다.
4. 고 찰
본 연구에서는 개인의 생활행동양상을 기준으로 개인별 노출수준을 확인하고자 광산란 방식의 실시간 측정이 가능한 휴대용 장비를 대상자에게 직접 지급하고 원격 모니터링을 통해 연구의 바이어스를 줄이고자 하였다. 고정식 대기측정망을 활용하여 실내·외 모든 노출환경에 대한 개인 노출수준을 확인하는 데에는 노출수준의 불확실성이 높을 수 있다. 이미 여러 선행 연구에서 집단에 대해서만 적용할 수 있는 수준인 고정식 대기측정망 결과를 개인 노출수준 평가에 적용하는 것으로 인한 불확실성을 언급하고 있다 (Pekkanen and Kulmala, 2004; Monn, 2001). 측정된 대기 중 PM2.5 노출수준은 실내도 동일하다는 가정도 있지만, 연구 대상자가 동일한 대기측정망이 설치된 행정 구역에서 PM2.5에 노출되더라도 개인의 생활행동양상이 효과 변경 인자 (Effect modifier)로 작용하여 상이한 PM2.5 노출수준이 나타날 수 있다. 역학 연구에서는 실외 대기가 실내로 어느 정도 유입되는지를 모델링을 통해 추정하여 적용하는 등의 방법을 사용하는 경우도 있지만, 모델링을 통한 노출수준 추정은 PM2.5 농도 예측에 활용되는 변수에 의해 달라질 수 있어 불확실성이 여전히 존재할 수 있다 (Hystad et al., 2009; Pekkanen and Kulmala, 2004). 본 연구에서는 그러한 개인 변인 중 하나인 사람의 신체활동도에 따른 PM2.5 노출량의 차이를 확인하기 위하여 가속도계를 적용하였다. 다른 유사 연구들에서는 이처럼 직관적으로 활동도를 얻을 수 있는 지표를 확인하기 어려웠다. Karottki et al. (2015)은 비침습성 휴대용 EndoPAT 2000 (Itamar Medical Ltd, Israel)을 통해 맥박의 파형 신호를 감지할 수 있지만, 이는 운동량 측정을 위한 지표가 아닌 미세혈관 기능을 파악하기 위한 장비이므로 활동도를 확인하기 어려웠다. Tang et al. (2019)은 비침습성 휴대용 심전도 (Electrocardio-gram, ECG) 기록기 및 분석기 Model E3-8010 (MSI, Taiwan)을 부착하여 실시간 심전도 데이터를 확인하고 활동 일지를 작성함으로써 활동량을 유추하는 것은 가능했지만, 해당 지표들만으로는 정확한 활동도를 파악하는 것은 어려웠다. 앞선 두 연구와 유사한 Williams et al. (2003) 연구 또한 각 패널에 대해 설문조사와 활동 일지를 작성하게 하여 위치, 활동 및 PM 노출 가능성과 관련된 정보를 수집하였고, Nellcor N-20® (Mallinckrodt Inc., USA)를 사용하여 5분 동안의 맥박 산소 포화도와 심박수를 실시간으로 측정했지만, 측정일에 한해 5분간 측정한 심박수만으로는 전체적인 활동도를 확인하기는 어려울 것으로 보인다. 본 연구에서 적용된 가속도계는 METs 측정 방식을 통해 비교적 정확한 활동도 자료를 수집할 수 있었다. 개인별로 가속도계를 지급함으로써 실시간 활동도를 모니터링하였으며, 이를 호흡률로 환산하여 실제 노출될 수 있는 흡입량을 확인할 수 있었다. 본 연구와 유사한 단기 연구에서는 가속도계를 몸에 착용하고 24시간 동안 실시간 활동 수준을 측정하여 흡입량을 도출하였고, 이를 통해 개인노출과 흡입량 간의 상관관계를 확인하는 것이 가능하였다 (van Nunen et al., 2021).
본 연구는 PM2.5에 대한 실내·외 노출을 정량화하여 각 노출환경에서 흡입량이 고려된 일일 노출량을 분석하였다. 또한, 노출환경별 흡입량 기반 PM2.5 노출기여도 및 노출강도를 산출하였고 24시간 흡입량 노출에 의한 FeNO 간의 관련성을 확인하였다. 본 연구 결과에 따르면 개인별로 측정 시기는 다르지만, 전체 대상자의 일평균 PM2.5 노출량은 최소 10 µg/day에서 최대 400 µg/day로 40배까지도 차이를 보였으며 연령별로 층화된 세 집단에서도 모두 다른 결과를 나타냈다. 흡입량을 기반으로 한 노출환경별 PM2.5 노출 연구에 따르면 어린이, 건강한 성인을 포함한 다양한 인구에서 개인의 노출환경과 시간 활동패턴에 의해 노출량 차이가 발생하는 것을 확인하였다 (Faria et al., 2020; Almeida et al., 2016; Lei et al., 2016). Faria et al. (2020)은 포르투갈에 거주하는 어린이를 대상으로 PM2.5 노출평가를 진행하였다. 노출기여도 산출 결과 교실 (35.7%), 실외 (17.3%), 가정 (수면) (16.4%), 신체활동 (9.7%), 가정 (비수면) (8.2%)으로 나타났고, 가정과 학교에서의 노출기여도가 높은 본 연구의 어린이 대상자 결과와 유사한 경향이 나타났다. 가정에서 더 많은 시간을 보냄에도 불구하고 학교에서의 노출기여도가 높은 이유는 교실에 PM2.5 농도를 높이는 데 기여하는 먼지 현탁액과 같은 입자에 의한 것으로 설명할 수 있다 (Faria et al., 2020). 반면에, 중국 대학생을 대상으로 한 신체활동 기반의 PM2.5 노출평가 연구에서 노출기여도는 실내 활동 (49%), 실외 (22%), 기숙사 (14%)로 나타났으며, 가정에서의 노출기여도가 가장 높은 본 연구 결과와 다르게 나타났다. 이는 대상자의 거주지 형태가 기숙사이고, 일반 가정 내에서 노출될 수 있는 고농도 조건 (조리 흄 등) 없이 기숙사 노출환경에서의 낮은 농도와 흡입률로 인해 나타난 것으로 설명될 수 있다 (Lei et al., 2016). 어린이와 청년을 대상으로 한 연구는 다양하지만, 노인 대상 연구는 비교적 적어 직접적인 비교가 어렵다. 본 연구 결과에서 노인 대상자의 PM2.5 노출기여도는 가정에서 가장 높게 나타났지만, 단위 노출시간이 보정된 노출강도의 경우 다른 결과를 나타냈다. 가정에서의 노출강도는 5순위에 그쳤지만, 실외에서 20%, 이동수단에서 18%로 가장 높은 결과가 나타났다. Lei et al. (2016)은 중국에서 PM2.5에 대한 개인노출 및 일일 흡입량을 확인했으며, 연구 결과 실외 활동에서 노출강도가 가장 높았다. 이는 대상자가 실외 환경에서 다양한 오염원에 노출되었기 때문이며, 오염원으로 혼잡한 도로 및 교통 상황, 길거리 노점에서의 조리, 농작물 연소 등으로 설명되었다. 또한, 자동차, 지하철과 같은 이동수단은 교통량이 많고 공기의 교환량도 높아지는 출퇴근 시간에 주로 이용되어 대기오염에 노출되는 정도가 매우 높아지는 것으로 설명할 수 있다. 또한, 자전거와 같이 신체적 활동이 포함된 이동수단 방식의 경우에는 신체활동도가 높아짐에 따라 미세 입자를 흡입하는 양이 증가할 수 있다 (Cepeda et al., 2017). 따라서 이동수단을 이용하는 시간은 다른 환경에서 보다 비교적 짧더라도 신체활동에 따라 호흡률이 높아져 더 많은 양의 PM2.5에 노출될 수 있다.
본 연구에서 24시간 흡입량 노출에 의한 FeNO와의 관련성을 확인하고자 FeNO 지표를 반복 측정하였다. Xu et al. (2018)의 경우 중국 청년을 대상으로 흡입량과 FeNO 지표 사이의 연관성을 조사했으며, 연구 결과 시차 0일에 9.1% (95% CI: 2.2, 16.0)의 FeNO 증가와 관련이 있었다. 마찬가지로, Guo et al. (2019)의 경우 중국 Shanghai Lung Hospital 입원 환자 데이터를 통해 PM2.5 일일 평균 농도에서 IQR 증가에 따른 FeNO의 증가를 확인하였으며, 시차 0일에 가장 강한 유의한 연관성이 나타나 FeNO의 2.72% (95% CI: -0.09, 5.61) 증가를 확인하였다. 본 연구에서도 유사한 경향으로 나타났으며, 60세 이상 집단과 모든 대상자에서는 FeNO 증가와 유의한 결과가 나타났다. 역학 연구에 따르면 천식이 있는 노인 (Jansen et al., 2005), 어린이 (Fischer et al., 2002) 및 건강한 성인 (Shi et al., 2016)을 포함한 다양한 모집단에서 주변 PM에 대한 단기 노출과 FeNO 증가와의 연관성이 나타났다 (Xu et al., 2018). 이러한 연구 결과는 급성 PM2.5 노출과 관련하여 FeNO의 유의한 증가를 보여주며 염증이 PM2.5의 호흡기 영향에서 중요한 역할을 할 수 있음을 시사하였다.
본 연구의 한계점으로는 1) PM2.5 물질에 대한 화학적 조성을 측정하지 않았으며, 이는 PM2.5에 노출된 개인의 염증 반응과 폐 기능 저하 등을 설명할 수 있는 중요한 요인이 될 수 있어 조사할 필요가 있다. 2) 집단 간 표본 크기에 차이가 있어, 상대적으로 작은 표본을 가진 집단은 측정 결과의 불확실성을 증가시킬 수 있다. 3) 계절성 풍향 영향을 받는 PM2.5에 대해 계절적 고려를 하지 않아, 이에 따라 결과에 혼란이 나타날 수 있다. 그러나 설문을 통해 조사된 개인의 키, 몸무게, 나이, 가정환경, 지역 정보 등을 공변량으로 활용하여 결과가 편향되지 않도록 하였다.
본 연구에서는 대기오염 노출수준을 확인하기 위해 대상자에게 직접 장비를 지급하여 측정함으로써 고정식 대기측정망, 예측 모델이 가지는 불확실성을 해소하였다. 또한, 선행 연구에서는 대부분 현재 머무르고 있는 수용체가 동일한 PM2.5 중량 농도에 노출된다고 가정하지만 개인의 특성에 따라 노출되는 수준은 달라질 수 있다. 본 연구에서는 그러한 개인 변인 중 하나인 사람의 활동도에 따른 PM2.5 노출량의 차이를 확인하기 위해 가속도계를 적용하였으며, 실시간으로 장시간 가속도계를 착용해 신체활동도를 측정하였다. 측정한 데이터는 개인의 활동도 지표로써 PM2.5 노출량을 확인하는 데 있어 매우 유의할 것으로 판단되며, 이는 활동도를 고려하지 않은 다른 연구들과 비교하여 확실한 차별점이자 장점이라고 볼 수 있다.
5. 결 론
개인노출평가를 통해 노출환경에서 실제 노출시간은 짧더라도 노출환경별 흡입량에 따라 노출강도는 다른 환경에서 더 높게 나타날 수 있음을 확인하였다. 또한, PM2.5 노출에 따른 FeNO 지표 증가는 유의한 연관성이 있었다. 세 집단 중 60세 이상의 집단에서 유의미한 결과가 나타났고, 다른 집단에서도 증가하는 경향을 보였다. 이러한 연구 결과는 입자상 대기오염물질이 염증을 유발하고 구강 및 호흡기 건강을 손상시킬 수 있다는 기존의 역학 증거를 뒷받침하였다.
Acknowledgments
본 결과물은 환경부의 재원으로 한국환경산업기술원의 환경보건디지털사업의 지원을 받아 연구되었습니다 (RS-2021-KE001448).
또한 본 결과물은 과학기술정보통신부 및 교육부의 재원으로 한국연구재단의 지원을 받아 연구되었습니다 (2019M3E7A111308322).
References
- Ainsworth, B.E., Haskell, W.L., Herrmann, S.D., Meckes, N., Bassett Jr, D.R., Tudor-Locke, C., Greer, J.L., Vezina, J., Whitt- Glover, M.C., Leon, A.S. (2011) 2011 Compendium of Physical Activities: a second update of codes and MET values, Medicine and Science in Sports and Exercise, 43(8), 1575-1581.
- Ainsworth, B.E., Haskell, W.L., Whitt, M.C., Irwin, M.L., Swartz, A.M., Strath, S.J., O’Brien, W.L., Bassett, D.R., Schmitz, K.H., Emplaincourt, P.O. (2000) Compendium of physical activities: an update of activity codes and MET intensities, Medicine and Science in Sports and Exercise, 32(9; Supp/1), S498-S504.
- Almeida, S.M., Ramos, C.A., Almeida-Silva, M. (2016) Exposure and inhaled dose of susceptible population to chemical elements in atmospheric particles, Journal of Radioanalytical and Nuclear Chemistry, 309, 309-315.
- Amatullah, H., North, M.L., Akhtar, U.S., Rastogi, N., Urch, B., Silverman, F.S., Chow, C.-W., Evans, G.J., Scott, J.A. (2012) Comparative cardiopulmonary effects of sizefractionated airborne particulate matter, Inhalation Toxicology, 24(3), 161-171.
- American Thoracic Society/European Respiratory Society (ATS/ ERS) (2005) ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005, American Journal of Respiratory and Critical Care Medicine, 171(8), 912-930.
- Brook, R.D., Rajagopalan, S., Pope III, C.A., Brook, J.R., Bhatnagar, A., Diez-Roux, A.V., Holguin, F., Hong, Y., Luepker, R.V., Mittleman, M.A. (2010) Particulate matter air pollution and cardiovascular disease: an update to the scientific statement from the American Heart Association, Circulation, 121(21), 2331-2378.
-
Buonanno, G., Giovinco, G., Morawska, L., Stabile, L. (2011) Tracheobronchial and alveolar dose of submicrometer particles for different population age groups in Italy, Atmospheric Environment, 45(34), 6216-6224.
[https://doi.org/10.1016/j.atmosenv.2011.07.066]

- Cepeda, M., Schoufour, J., Freak-Poli, R., Koolhaas, C.M., Dhana, K., Bramer, W.M., Franco, O.H. (2017) Levels of ambient air pollution according to mode of transport: a systematic review, The Lancet Public Health, 2(1), e23-e34.
- Chen, R., Zhao, Z., Sun, Q., Lin, Z., Zhao, A., Wang, C., Xia, Y., Xu, X., Kan, H. (2015) Size-fractionated particulate air pollution and circulating biomarkers of inflammation, coagulation, and vasoconstriction in a panel of young adults, Epidemiology, 26(3), 328-336.
- Cunha-Lopes, I., Martins, V., Faria, T., Correia, C., Almeida, S. (2019) Children’s exposure to sized-fractioned particulate matter and black carbon in an urban environment, Building and Environment, 155, 187-194.
- Dweik, R.A., Boggs, P.B., Erzurum, S.C., Irvin, C.G., Leigh, M.W., Lundberg, J.O., Olin, A.-C., Plummer, A.L., Taylor, D.R. (2011) An official ATS clinical practice guideline: interpretation of exhaled nitric oxide levels (FENO) for clinical applications, American Journal of Respiratory and Critical Care Medicine, 184(5), 602-615.
-
Faria, T., Martins, V., Correia, C., Canha, N., Diapouli, E., Manousakas, M., Eleftheriadis, K., Almeida, S.M. (2020) Children’s exposure and dose assessment to particulate matter in Lisbon, Building and Environment, 171, 106666.
[https://doi.org/10.1016/j.buildenv.2020.106666]

- Fischer, P., Steerenberg, P., Snelder, J., Van Loveren, H., Van Amsterdam, J. (2002) Association between exhaled nitric oxide, ambient air pollution and respiratory health in school children, International Archives of Occupational and Environmental Health, 75, 348- 353.
- Freedson, P.S., Melanson, E., Sirard, J. (1998) Calibration of the computer science and applications, inc. accelerometer, Medicine and Science in Sports and Exercise, 30(5), 777-781.
- Guo, H., Yang, W., Jiang, L., Lyu, Y., Cheng, T., Gao, B., Li, X. (2019) Association of short-term exposure to ambient air pollutants with exhaled nitric oxide in hospitalized patients with respiratory-system diseases, Ecotoxicology and Environmental Safety, 168, 394-400.
-
Huang, C., Lei, J., Wang, J., Niu, Y., Zhu, Y., Jiang, Y., Xue, X., Gao, Y., Kan, H., Chen, R. (2023) The acute effects of particulate air pollution on lung function in asthmatic children: A multicenter study with intensively repeated measurements, Atmospheric Environment, 306, 119826.
[https://doi.org/10.1016/j.atmosenv.2023.119826]

- Hystad, P.U., Setton, E.M., Allen, R.W., Keller, P.C., Brauer, M. (2009) Modeling residential fine particulate matter infiltration for exposure assessment, Journal of Exposure Science & Environmental Epidemiology, 19(6), 570- 579.
- Jansen, K.L., Larson, T.V., Koenig, J.Q., Mar, T.F., Fields, C., Stewart, J., Lippmann, M. (2005) Associations between health effects and particulate matter and black carbon in subjects with respiratory disease, Environmental Health Perspectives, 113(12), 1741-1746.
- Karottki, D.G., Spilak, M., Frederiksen, M., Andersen, Z.J., Madsen, A.M., Ketzel, M., Massling, A., Gunnarsen, L., Møller, P., Loft, S. (2015) Indoor and outdoor exposure to ultrafine, fine and microbiologically derived particulate matter related to cardiovascular and respiratory effects in a panel of elderly urban citizens, International Journal of Environmental Research and Public Health, 12(2), 1667-1686.
- Laden, F., Schwartz, J., Speizer, F.E., Dockery, D.W. (2006) Reduction in fine particulate air pollution and mortality: extended follow-up of the Harvard Six Cities study, American Journal of Respiratory and Critical Care Medicine, 173(6), 667-672.
- Lei, X., Xiu, G., Li, B., Zhang, K., Zhao, M. (2016) Individual exposure of graduate students to PM2.5 and black carbon in Shanghai, China, Environmental Science and Pollution Research, 23, 12120-12127.
- Lizana, J., Almeida, S.M., Serrano-Jimenez, A., Becerra, J.A., Gil- Baez, M., Barrios-Padura, A., Chacartegui, R. (2020) Contribution of indoor microenvironments to the daily inhaled dose of air pollutants in children. The importance of bedrooms, Building and Environment, 183, 107188.
-
Memari, A.H., Ghaheri, B., Ziaee, V., Kordi, R., Hafizi, S., Moshayedi, P. (2013) Physical activity in children and adolescents with autism assessed by triaxial accelerometry, Pediatric Obesity, 8(2), 150-158.
[https://doi.org/10.1111/j.2047-6310.2012.00101.x]

- Monn, C. (2001) Exposure assessment of air pollutants: a review on spatial heterogeneity and indoor/outdoor/personal exposure to suspended particulate matter, nitrogen dioxide and ozone, Atmospheric Environment, 35(1), 1-32.
- National Institute of Environmental Research (NIER) (2019) Korean exposure factor handbook.
- Ostro, B., Lipsett, M., Reynolds, P., Goldberg, D., Hertz, A., Garcia, C., Henderson, K.D., Bernstein, L. (2010) Long-term exposure to constituents of fine particulate air pollution and mortality: results from the California Teachers Study, Environmental Health Perspectives, 118(3), 363-369.
- Pekkanen, J., Kulmala, M. (2004) Exposure assessment of ultrafine particles in epidemiologic time-series studies, Scandinavian Journal of Work, Environment & Health, 30(Suppl 2), 9-18.
- Pope Iii, C.A., Burnett, R.T., Thun, M.J., Calle, E.E., Krewski, D., Ito, K., Thurston, G.D. (2002) Lung cancer, cardiopulmonary mortality, and long-term exposure to fine particulate air pollution, Jama, 287(9), 1132-1141.
- Rao, D.R. , Phipatanakul, W. (2016) An overview of fractional exhaled nitric oxide and children with asthma, Expert Review of Clinical Immunology, 12(5), 521-530.
-
Rodulfo-Cárdenas, R., Ruiz-Sobremazas, D., Biosca-Brull, J., Cabré, M., Blanco, J., Lòpez-Granero, C., Sánchez-Santed, F., Colomina, M.T. (2023) The influence of environmental particulate matter exposure during late gestation and early life on the risk of neurodevelopmental disorders: A systematic review of experimental evidences, Environmental Research, 236.
[https://doi.org/10.1016/j.envres.2023.116792]

- Setton, E., Marshall, J.D., Brauer, M., Lundquist, K.R., Hystad, P., Keller, P., Cloutier-Fisher, D. (2011) The impact of daily mobility on exposure to traffic-related air pollution and health effect estimates, Journal of Exposure Science & Environmental Epidemiology, 21(1), 42-48.
- Shi, J., Chen, R., Yang, C., Lin, Z., Cai, J., Xia, Y., Wang, C., Li, H., Johnson, N., Xu, X. (2016) Association between fine particulate matter chemical constituents and airway inflammation: A panel study among healthy adults in China, Environmental Research, 150, 264-268.
- Soggiu, M.E., Vollono, C., Bastone, A. (2010) Human exposure assessment to environmental contaminants: exposure scenarios, Rapporti ISTISAN - Istituto Superiore di Sanitá (No.10/19), 49pp.
-
Steinle, S., Reis, S., Sabel, C.E. (2013) Quantifying human exposure to air pollution - Moving from static monitoring to spatio-temporally resolved personal exposure assessment, Science of The Total Environment, 443, 184-193.
[https://doi.org/10.1016/j.scitotenv.2012.10.098]

- Tang, C.-S., Chuang, K.-J., Chang, T.-Y., Chuang, H.-C., Chen, L.-H., Lung, S.-C.C., Chang, L.-T. (2019) Effects of personal exposures to micro-and nano-particulate matter, black carbon, particle-bound polycyclic aromatic hydrocarbons, and carbon monoxide on heart rate variability in a panel of healthy older subjects, International Journal of Environmental Research and Public Health, 16(23), 4672.
- Tseng, E., Ho, W.-C., Lin, M.-H., Cheng, T.-J., Chen, P.-C., Lin, H.-H. (2015) Chronic exposure to particulate matter and risk of cardiovascular mortality: cohort study from Taiwan, BMC Public Health, 15(1), 1-9.
- Ueda, K., Nagasawa, S.-y., Nitta, H., Miura, K., Ueshima, H. (2012) Exposure to particulate matter and long-term risk of cardiovascular mortality in Japan: NIPPON DATA80, Journal of Atherosclerosis and Thrombosis, 19(3), 246-254.
- van Nunen, E., Hoek, G., Tsai, M.-Y., Probst-Hensch, N., Imboden, M., Jeong, A., Naccarati, A., Tarallo, S., Raffaele, D., Nieuwenhuijsen, M. (2021) Short-term personal and outdoor exposure to ultrafine and fine particulate air pollution in association with blood pressure and lung function in healthy adults, Environmental Research, 194, 110579.
- Wan, X., Wang, W., Liu, J., Tong, T. (2014) Estimating the sample mean and standard deviation from the sample size, median, range and/or interquartile range, BMC Medical Research Methodology, 14, 1-13.
- Wang, J., Lai, S., Ke, Z., Zhang, Y., Yin, S., Zheng, J. (2014) Exposure assessment, chemical characterization and source identification of PM2.5 for school children and industrial downwind residents in Guangzhou, China, Environmental Geochemistry and Health, 36, 385-397.
- Williams, R., Suggs, J., Rea, A., Leovic, K., Vette, A., Croghan, C., Sheldon, L., Rodes, C., Thornburg, J., Ejire, A. (2003) The Research Triangle Park particulate matter panel study: PM mass concentration relationships, Atmospheric Environment, 37(38), 5349-5363.
- World Health Organization (WHO) (2021) WHO global air quality guidelines: particulate matter (PM2.5 and PM10), ozone, nitrogen dioxide, sulfur dioxide and carbon monoxide. https://www.who.int/publications/i/item/9789240034228, (accessed on Sep. 22. 2021).
-
Xu, T., Hou, J., Cheng, J., Zhang, R., Yin, W., Huang, C., Zhu, X., Chen, W., Yuan, J. (2018) Estimated individual inhaled dose of fine particles and indicators of lung function: A pilot study among Chinese young adults, Environmental Pollution, 235, 505-513.
[https://doi.org/10.1016/j.envpol.2017.12.074]

- Zhang, P., Dong, G., Sun, B., Zhang, L., Chen, X., Ma, N., Yu, F., Guo, H., Huang, H., Lee, Y.L. (2011) Long-term exposure to ambient air pollution and mortality due to cardiovascular disease and cerebrovascular disease in Shenyang, China, PLoS One, 6(6), e20827.
-
Zhao, Z., Huang, C., Zhang, X., Xu, F., Kan, H., Song, W., Wieslander, G.N, Orback, D. (2013) Fractional exhaled nitric oxide in Chinese children with asthma and allergies - A two-city study, Respiratory Medicine, 107(2), 161-171.
[https://doi.org/10.1016/j.rmed.2012.11.001]

박민지 (연세대학교 보건대학원 환경보건학과 석사과정, 연세대학교 의과대학 환경공해연구소 학생연구원) (png0524@yuhs.ac)
정경준 (연세대학교 의과대학 환경공해연구소 전문연구원) (KGIP01@yuhs.ac)
이동준 (연세대학교 보건대학원 환경보건학과 석사과정, 연세대학교 의과대학 환경공해연구소 학생연구원) (gaon9797@yuhs.ac)
유태영 (연세대학교 보건대학원 환경보건학과 석사과정, 연세대학교 의과대학 환경공해연구소 학생연구원) (jasonyty1014@yuhs.ac)
김창수 (연세대학교 의과대학 환경공해연구소 소장, 연세대학교 의과대학 예방의학교실 교수) (preman@yuhs.ac)
이용진 (연세대학교 의과대학 환경공해연구소 부교수) (yjlee75@yuhs.ac)