화석연료 연소 모사공정에서 원소수은 및 질소산화물 동시저감 특성연구
Abstract
In this study, a catalyst in which CuCl2 was injected into activated carbon and zeolite was prepared to analyze the removal of elemental mercury and the simultaneous reduction of NOx in the SCR (Selective Catalyst Reaction) reaction. The purpose of this study is to analyze the reaction characteristics of elemental mercury and NOx by simultaneously injecting NH3, CO, O2, and H2O which occupy a large part of exhaust gas, in order to select the optimal control method during fossil fuel combustion. As a result of the experiment, BZC[Beta Zeolite+CuCl2 (6 wt%)] catalyst showed higher efficiency in simultaneously reducing elemental mercury and NOx more than ACC[Activated Carbon+CuCl2 (6 wt%)]. This could potentially be used in real fossil fuel processes. Since the influence of moisture in the mixed gas is very large, it was confirmed that moisture control for exhaust gas is necessary as an optimal management method. It is thought that it can be used as basic data when controlling elemental mercury and NOx simultaneously.
Keywords:
Fossil-fuel combustion, Elemental mercury, Oxidized mercury, De-NOx, Zeolite catalyst1. 서 론
2013년 UNEP에서 수은에 대한 국제적 공동 대응을 위해 미나마타협약을 채택하였다. 이에 우리나라 환경부는 ‘수은관리 종합 대책 (2016~2020)’을 수립하고 ‘잔류성 오염물질 관리법’을 개정하여 수은을 제조와 취급 단계에서부터 규제하고 있다 (Kim, 2017). 또한, ‘대기오염물질 배출허용기준’을 2020년 부터 선진국 수준인 0.04~0.1 mg/m3로 낮추는 등 규제를 강화하고 있다. US EPA 보고서에 따르면, 미국 전체 연간 수은 배출량의 약 87%를 화력발전, 소각시설 등의 연소설비가 차지하는 것으로 나타났으며, UNEP에서는 전 세계 연간 배출량이 2015년 기준 최소 2,000 ton/yr에서 최대 2,820 ton/yr에 이르는 것으로 추정되고 있다 (UNEP, 2018; US EPA, 1997). 배출가스 중 수은은 주로 원소수은 (Elemental Mercury; Hg0)과 산화수은 (Oxidized Mercury; Hg2+) 형태로 가스상으로 배출되고, 입자상 물질은 대부분 기존 집진설비를 통해 완벽하게 제거 가능하지만, 가스상 물질의 경우 기존 집진설비로는 효과적으로 제거하기 어려운 점이 있다 (Carey et al., 1998; Schroeder et al., 1991).
최근의 연구동향은 수은의 흡착 제거가 아닌 SCR (Selective Catalyst Reaction) 등의 산화 반응을 이용한 원소수은 제거에 대한 연구가 활발히 진행되고 있다 (Li and Zhao, 2015; Lee et al., 2012; Presto and Granite, 2006; Zacharewski and Cherniak, 1987). 기존 방지시설에 의한 원소수은의 산화·제거가 가능하다는 점과 경제적 측면을 고려하면 별도의 수은 제거설비가 필요 없다는 의견도 있지만 SCR 반응에 의해 원소수은을 산화시킬 경우, 후단에 습식탈황설비 (FGD; Flue Gas Desulfurization) 등의 후단 설비 없이 원소 수은과 산화수은을 완벽히 제거하기는 어렵다. 또한 배기가스 냉각 시 원소수은 또는 유기수은 등으로의 전환을 배제할 수 없다.
화석연료에서 수은은 대부분 HgS (Mercuric Sulfide)의 형태로 존재하여, 석탄화력 연소 공정 시 다음의 반응식에 의해 증기 수은이 발생하게 된다.
연소 공정에서 발생되는 수은은 물리화학적으로 반응할 수 있는 매개체가 없으면 증기 상태로 대기상에 배출된다. 즉, 온도가 600°C 이상에서는 Hg0 상태로 배출되며, 열교환기 등의 후단 설비를 통과하면서 300~550°C 정도로 배기가스가 냉각되면 Hg0은 O2에 의해 HgO로 산화되며, 300°C 이하로 온도가 내려가면 이러한 반응속도는 매우 느려지게 된다 (Hall et al., 1990). Wu et al. (1998)에 의하면 대기 중의 Hg0의 산화는 매우 느리며, 산화되어 에어로졸로 전환되는 주요 경로가 아니라고 하였다. 석탄 화석연료 중 함유된 수은은 연소 시 Hg0으로 전환되고 대기오염 방지시설을 거치면서 그림 1과 같이 산화-환원 반응이 일어나며, 이 과정에서 대기 중으로 배출되는 수은 화합물의 화학종이 결정되는 것이다 (Galbreath and Zygarlicke, 2000).
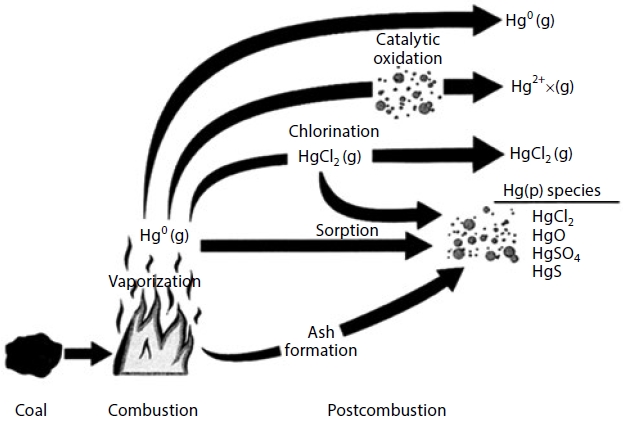
Potential mercury transformations during coal combustion subsequently. *Source : Galbreath and Zygarlicke, 2000.
화석연료 배출가스 중 NOx 제거를 위한 SCR 촉매 반응에서 금속 담지 제올라이트 촉매는 저온에서 V2O5/TiO2 촉매보다 활성이 우수하고 먼지 (PM) 배출기준을 위하여 적용되는 Diesel Particulate Filter (DPF)의 재생 시 사용되고 있다. 고온상에서 촉매는 아나타제 상이 루틸 상으로의 전환됨에 따라 표면적 감소로 이어져 비활성화가 일어나는 데 반해, 제올라이트는 고온에서 안정되어 있다고 하였다 (Colombo et al., 2012). Fe/ZSM-5는 SCR 반응에서 효과적인 촉매로 알려져 왔으며 (Kim et al., 2012; Ma et al., 2012), Fe/H-Beta 촉매는 자동차용 디젤엔진 배출가스의 NOx 제거를 위한 SCR 촉매의 하나로 각광받고 있다 (Shwan et al., 2012; Balle et al., 2009).
NH3-SCR 촉매의 경우 제올라이트에 이온교환시킨 Fe, Cu에 조촉매인 Mn과 Ce를 첨가시킨 금속 촉매가 좋은 활성을 나타낸 것으로 보고되고 있다 (Li et al., 2011). 제올라이트 촉매의 경우 Fe 담지 촉매의 연구가 많이 진행되어 왔으며, 담체로는 제올라이트 BEA (Beta Polymorph A)가 많이 사용되어 왔다 (Ma et al., 2012). Rahkamaa-Tolonenet (2005)은 제올라이트에 기초한 촉매가 NH3-SCR 반응에 매우 가능성이 큰 것으로 보고한 바 있다. Fe를 포함하는 산화물과 Fe 이온교환 촉매의 경우 특히 Fe-BEA와 Fe-ZSM-5 촉매가 SCR 반응에 좋은 활성을 보였으며 그중에서 Fe-BEA는 다른 금속 이온교환 촉매에 비하여 우수한 NOx 저감 특성과 N2 선택성, 노화 특성을 보였다 (Stanciulescu et al., 2012). Cu로 이온교환된 ZSM-5 촉매의 경우는 산소 존재 하에서 암모니아에 의한 NO의 환원 반응에 활성적인 촉매로 알려져 있다 (Roy et al., 2009).
본 연구는 국내 기술로서 활성탄 및 제올라이트에 전이금속-할로겐 염을 대표하는 CuCl2를 담지한 촉매를 제조하고, 이를 이용하여 원소수은 및 NOx 동시 저감 가능성과 기존 SCR 설비의 활용성을 연구하고자 하였다. 또한, 배출가스 중 많은 비율을 차지하고 있는 NH3, CO, H2O, O2 등 혼합 가스를 동시에 주입하여 원소수은과 NOx 반응 특성을 분석하여 화석연료 연소 모사 공정에서 최적 방안을 선택하기 위한 것이 본 연구의 목적이다.
2. 실험재료 및 방법
2. 1 활성탄
흡착제로는 Jacobi사에서 시판되고 있는 Pellet 형태의 활성탄을 사용하였으며, 표 1에 특성을 나타내었다. 수분 및 불순물을 제거하기 위하여 실험 전에 증류수에 담가 세척하고, 110°C 드라이오븐에 건조한 후 사용하였다.
2. 2 Beta 제올라이트
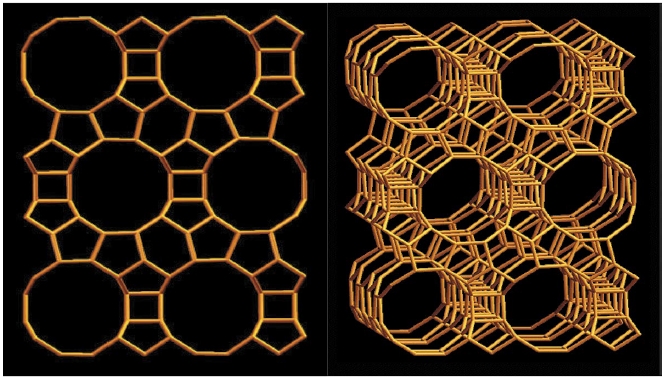
실험에 사용된 Beta 제올라이트는 국제 제올라이트 협회의 분류상 BEA 구조를 가진 시중에서 판매되는 것으로, SiO2/Al2O3 비가 127인 H-Beta 제올라이트를 준비하였으며, H-Beta 제올라이트의 구조도는 그림 2와 같다. 실험 전에 드라이오븐에서 110°C 온도로 3시간 이상 건조하여 수분을 제거한 후 사용하였다.
2. 3 CuCl2 담지
CuCl2 담지에는 모두 Pellet (직경 3 mm) 형태의 시료를 이용하였으며, 200~300 μm 크기로 분쇄하여 사용하였다. CuCl2 담지하기 위해 먼저 금속 전구물질 수용액을 만들고 준비된 전구물질 수용액에 지지체를 넣고 지지체의 공극이 전구물질 수용액으로 완전히 채워져서 더 이상 금속 수용액을 흡수할 수 없게 되었을 때 이것을 110°C 드라이 오븐에서 충분히 건조했다. 수분을 모두 증발시키고 450°C 전기로에서 5시간 동안 소성하여 최종적으로 CuCl2를 담지한 활성탄 및 제올라이트를 촉매를 제조하여 준비하였다. 표 2는 본 연구에서 사용된 CuCl2 담지 전·후 활성탄 및 제올라이트 촉매를 나타낸 것이다.
2. 4 실험방법
실험재료인 활성탄과 제올라이트 시료에 대하여 CuCl2 담지 전·후 비표면적과 기공 크기 및 Si/Al 구성비를 분석하기 위해 BET 및 XRF 분석을 하였다.
또한, Ontario hydro method을 통해 배출가스 중의 원소수은 및 산화수은 분석을 하여 CuCl2 담지된 활성탄 및 제올라이트에 의한 원소수은의 제거 기작이 산화와 흡착 중에 어느 곳에 관여하는지 확인하였다.
원소수은 및 NOx 동시저감 실험의 시료량 및 실험조건은 표 3과 같으며, ACC와 BZC 촉매에 대하여 Hg0 주입 농도 200 μg/m3으로 고정하고, NOx, NH3, CO, H2O, O2를 주입하여 원소수은 및 NOx 동시저감 실험에 대한 영향을 분석하였다.
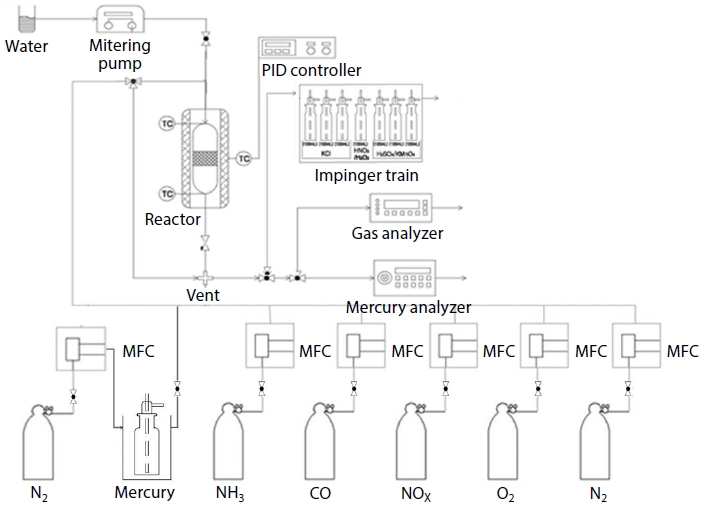
이는 화석 연소 공정에서 주로 SCR 환원제인 NH3와 배출가스 중 많이 존재하는 CO, H2O, O2 등 혼합 가스의 모사 공정으로 분석하였으며, 실험 장치 Diagram은 그림 3과 같다.
원소수은은 질소 가스로 Bubbling하여 Air와 혼합하여 반응기에 주입하였다. 유량은 시료의 크기에 따라 달리하였으며 분체상 시료 Test 2.7 L/min, Pellet 시료의 경우 12.7 L/min으로 MFC를 통해 일정하게 공급하였다. 원소수은은 농도 200 μg/m3로 주입 (Carrier Gas N2) 하였다.
반응기는 활성탄 및 제올라이트가 원소수은과 직접 접촉하여 반응할 수 있도록 회분식 SUS 반응기를 제작하여 사용하였다. 반응기는 약 2~3 g의 시료를 투입할 수 있도록 길이 50 mm, 내경 16 mm의 크기로 제작하였고 시료가 반응기의 후단으로 유출되지 않도록 다공판과 Quartz Wool을 반응기 끝부분에 삽입하였다. Pellet 시료의 실험 시 반응기는 약 20 g 이상의 시료를 투입할 수 있도록 길이 150 mm, 내경 34 mm의 크기로 Quartz 반응기를 제작하였으며, 후단으로 시료가 유출되지 않도록 후단에 다공판이 부착된 것을 사용하였다.
반응기 전·후단의 온도를 각각 측정할 수 있도록 두 개의 K-type Thermocouple을 설치하여 반응 온도가 일정하게 유지되도록 하였으며, 가스가 반응기를 거치기 전에 Bypass할 수 있는 Line을 두어 반응기로 반응 가스를 공급하기 전에 안정화된 원소수은 농도를 측정할 수 있도록 하였다. 반응기 후단에는 냉각용 임핀저를 설치하여 냉각된 가스가 원소수은 분석기기로 유입되도록 하였다.
원소수은 분석에는 수은 분석기 (VM-3000, Mecury Instrument)를 사용하였다. 이 분석기는 수은의 검출 방법으로 CVAAS (Cold Vapor Atomic Absorption Spectroscopy) 법을 채택하고 있고 파장 253.7 nm의 UV를 이용한다. 수은 농도 0.1 μg/m3의 정밀도로 최대 측정 범위는 2,000 μg/m3, 측정 해상도는 0.1 μg/m3인 기기이다. 수은 분석기 (VM-3000)로는 배출되는 원소수은만 분석하기 때문에 화학종 분석을 수행할 수 없으므로, 산화수은 분석을 위해서 산화된 수은을 환원시키는 산화수은 환원용 임핀저를 냉각용 임핀저 후단에 설치하고 냉각된 반응 가스는 수은 분석기에 탑재된 흡입펌프로 1.5 L/min 정도만 흡입되고 나머지는 수은 분석기를 거친 샘플 가스와 합쳐져 약 200 mL의 활성탄이 충진된 활성탄 Bed를 거치도록 하였다. Ontario Hydro Method에 의한 배출가스 중 산화수은 및 원소수은을 분석하였고 실험 조건은 유량 12.7 L/min, 원소수은 주입농도 200 μg/m3, 반응기 체류시간 2.78 sec, 흡수액은 KCl, KMnO4+H2SO4 용액이며 유입되는 총 sampling 유량은 1.017 m3이다.
3. 실험 결과
3. 1 BET 및 XRF 분석
표 4와 같이 활성탄과 제올라이트 시료의 CuCl2 담지 전·후 비표면적의 차이는 크지 않았다. 기공 부피와 기공 크기는 CuCl2 담지 후 약간 감소한 것을 알 수 있었다. 이와 같이 2~3.0 nm micropore를 갖는 촉매로서, 원소수은 산화 및 저감 가능성이 있음을 알 수 있다.
XRF 분석을 통해 표 5와 같이 활성탄의 Si/Al 구성비와 Cu와 Cl의 성분비를 비교할 수 있었다. 제올라이트의 Si/Al 및 담지 성분비는 CuCl2 담지 전·후 상관없이 Si/Al 구성비가 127로 차이가 없었음을 알 수 있었다.
3. 2 원소수은 및 산화수은 분석
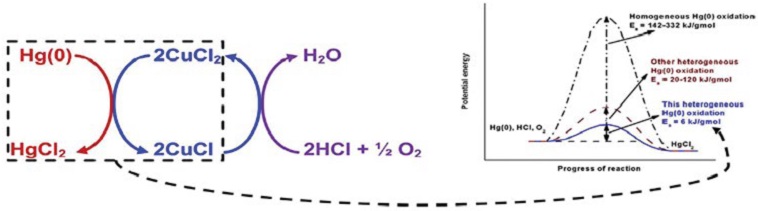
Grinite et al. (2000)은 Cl, S 및 Mn 등의 전이금속을 활성탄과 알루미나 등에 담지함으로써 수은 제거효율이 증가하였으며, 도입된 전이금속은 산화촉매로 작용하는 것을 확인하였다. Tsai et al. (2017)과 Siriram et al. (2018) 등은 전이금속 및 할로겐염으로 처리된 흡착제는 수은이 화학적으로 결합된 형태를 띠는 것으로 밝혀내기도 했는데, 100~180°C 온도 조건에서 활성탄 또는 알루미나에 도입된 CuCl2에 의해 Hg0가 HgCl2로 전환되는 과정을 다음의 식으로 나타내었다.
원소수은 제거는 산화-화학적 결합에 의한 것으로 Sriram (2018), Tsai (2017)의 연구 (그림 4 참고)와 같이 Cu 이온의 전자 이동, Cl에 의한 산화의 결과라고 볼 수 있다.
CuCl2 담지된 활성탄 및 제올라이트에 의한 원소수은의 제거 기작이 산화와 흡착 중에 어느 곳에 관여하는지 Ontario hydro method을 통해 확인하였다.
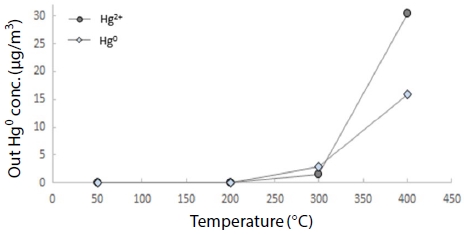
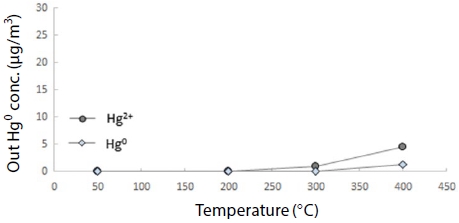
그림 5는 활성탄 및 제올라이트가 충진되지 않은 Blank 반응기, 그림 6은 활성탄을 충진한 상태, 그림 7은 제올라이트를 충진한 상태에서 원소수은 200 μg/m3,를 통과시켜 온도 변화에 따른 산화수은 및 원소수은의 비율을 분석하였다.
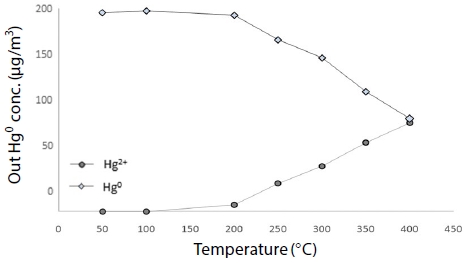
Blank 반응기에서는 200°C부터 원소수은이 산화되기 시작하여 400°C에서 50% 이상 산화되었고, 이는 Galbreath의 (180°C 이상에서 산화되기 시작) 연구와도 유사한 결과다 (Galbreath and Zygarlicke, 2000).
ACC의 경우 그림 6과 같이 400°C부터 원소수은보다 산화수은 비율이 높게 나타났다. 반면 BZC의 경우 그림 7과 같이 고온 영역에서 산화수은과 원소수은 배출농도가 큰 차이를 보이지 않았으며 ACC와는 차별화된 결정구조로 인하여 활성과 선택성이 높아 결과적으로 BZC가 200~400°C의 고온 영역에서 ACC보다 더 효과적으로 원소수은을 제거할 수 있음을 나타내고 있다.
3. 3 혼합 가스상 온도변화에 따른 원소수은 및 NOx 동시저감 영향분석
제올라이트에 기초한 촉매가 NH3-SCR 반응에 매우 가능성이 큰 것으로 보고한 바 있다 (Rahkamaa-Tolonen et al., 2005). 화석연료 연소 배출가스의 전형적인 SCR 반응 조건은 주로 다음과 같은 반응식에 의해서 NOx 환원 반응이 이루어지며, 모두 가스상에서 반응하는 것을 기반으로 하고 있다.
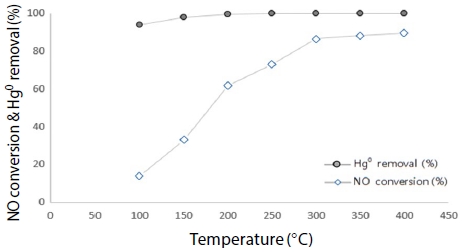
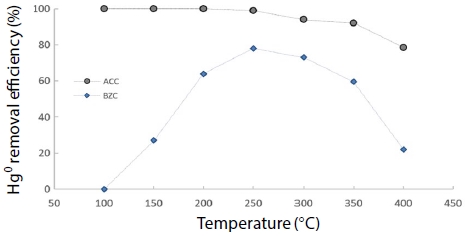
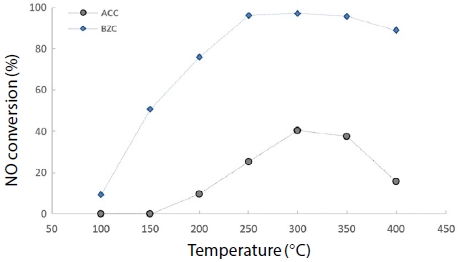
그림 8과 그림 9는 혼합 가스상에서 온도 변화에 따른 원소수은과 NOx 동시저감 실험 결과를 나타냈다. 유입 가스 농도는 NOx, NH3, CO를 200 ppm으로 고정하고, O2를 12%로 고정하여 반응 온도를 100~400°C 영역에서 50°C씩 증가시켜 실험한 결과, 혼합 가스상에서 원소수은 제거효율이 ACC 경우 200°C까지 100%의 효율을 유지하다가, 200°C 이상 부터 80%로 급격히 감소되었고, 반면 BZC는 100°C에서 94.5%를 보였고 200°C부터 효율 100%를 유지하였다. 이는 고온 영역에서 ACC보다 BZC가 원소수은을 효율적으로 제거하고 있음을 알 수 있었다. 아울러, NOx 제거효율은 ACC와 BZC가 150°C 이내에서는 효율 차이가 없었으나, 350°C에서 ACC는 57.1%로 꾸준히 증가하였으며, BZC 경우 300°C부터 97.6%로 급격한 효율 증가를 보였다.
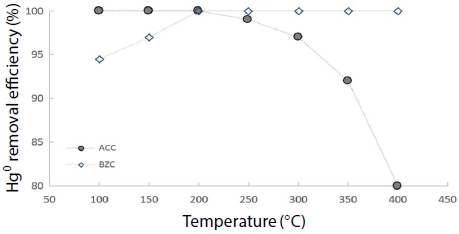
Hg0 removal efficiency according to temperature using CuCl2-A/C and zeolite (Hg: 200 μg/m3, NOx: 200 ppm, NH3: 200 ppm, CO: 200 ppm, O2: 12%, H2O: 0%).
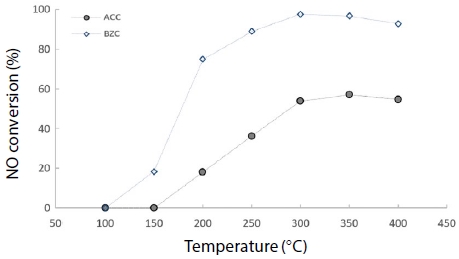
NOx conversion according to temperature using CuCl2-A/C and zeolite (Hg: 200 μg/m3, NOx: 200 ppm, NH3: 200 ppm, CO: 200 ppm, O2: 12%, H2O: 0%).
고온 영역에서 NOx 제거효율 또한 ACC보다 BZC가 효율적으로 제거하고 있음을 알 수 있었다. 이는 BZC가 고온에도 효율이 떨어지지 아니하고, SCR 반응을 함께 할 수 있음을 나타내고 있다.
3. 4 원소수은 및 NOx 동시저감 수분영향 분석
그림 10과 그림 11은 혼합 가스상에서 원소수은과 NOx 동시저감에서 수분에 의한 영향 실험 결과를 나타냈다. NOx, NH3, CO를 200 ppm으로 고정하고, O2를 12%로 고정하여 수분을 5% 투입하여 실험한 결과, 원소수은 제거효율은 ACC 경우 200°C까지 100%의 효율을 유지하다가 고온 영역에서 78.5%로 효율이 감소하였다. 반면 BZC는 150°C에서 27%, 250°C에 78%로 상승하다가 고온 영역인 400°C부터 급격히 효율이 감소하여 22%를 나타냈다.
Hg0 removal efficiency according to temperature using CuCl2-A/C and zeolite (Hg: 200 μg/m3, NOx: 200 ppm, NH3: 200 ppm, CO: 200 ppm, O2: 12%, H2O: 5%).
NOx conversion according to temperature using CuCl2-A/C and zeolite (Hg: 200 μg/m3, NOx: 200 ppm, NH3: 200 ppm, CO: 200 ppm, O2: 12%, H2O: 5%).
이는 수증기가 ACC보다 BZC 기공에 먼저 흡착되고 있으며, 경쟁 흡착으로 인한 영향으로 BZC 원소수은 제거효율이 저하됨을 알 수 있었다.
아울러, NOx 저감효율을 살펴본 결과 ACC는 300°C에서 40.5%의 최고효율을 보이고 이후 고온 영역에서 감소한 반면, BZC는 100°C부터 효율이 급상승하여 250°C에서 96.1%의 높은 효율을 보였다.
NOx 저감효율에서는 ACC보다 BZC가 전 온도 영역에서 수분에 대한 영향 없이 제거효율이 좋음을 나타냈다.
3. 5 CuCl2-Beta Zeolite (BZC)의 원소수은 및 NOx 동시저감 영향
고온 영역에서 원소수은과 NOx 제거효율이 좋은 CuCl2-Beta Zeolite (BZC) 촉매를 대상으로 혼합 가스 영향을 분석하였다. 또한 Ontario Hydro Method를 통해 배출가스 중 원소수은 또는 산화수은 중 어떤 형태로 존재하는지 분석하였다.
그림 12는 BZC를 대상으로 CO, O2, H2O 혼합 가스를 고정하고, NH3 200 ppm를 주입하여 실험을 진행한 결과, 원소수은 저감효율에 NH3 영향 없이 95% 이상 효율을 나타냈으며, NOx 저감효율에서는 300°C 이상 고온 영역에서 87%로 꾸준히 증가하였음을 나타냈다. 이는, SCR 환원제인 NH3가 존재하는 상태에서 원소수은 및 NOx 동시저감에서 NH3 영향이 미미함을 알 수 있다.
그림 13은 원소수은 및 NOx 동시저감 효율에서 특히 수분에 의한 영향이 있을 것으로 판단되어, BZC 시료를 대상으로 250°C에서 NH3, CO, O2를 고정하고, H2O를 0, 2, 4, 10, 15%로 수분 함량을 증가 주입하였다.
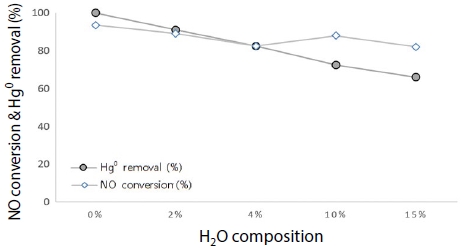
NOx conversion and Hg0 removal efficiency according to H2O using BZC at 250°C (Hg: 200 μg/m3, NOx: 200 ppm, NH3: 0 ppm, CO: 0 ppm, O2: 0%, H2O: 0, 2, 4, 10,15%).
실험 결과, 수분 함량 영향은 매우 중요한 요소로 발생되었으며, 수분 함량이 점점 증가할수록 원소수은 100% 제거율이 66%까지 효율이 저하되었음을 알 수 있었다. NOx 제거효율 또한 수분 함량이 증가할수록 94%에서 82%로 효율이 저하되었다. 이는, 수증기가 많아질수록 수증기가 BZC 기공에 먼저 흡착되는 경쟁 흡착으로 인한 영향임을 알 수 있었다.
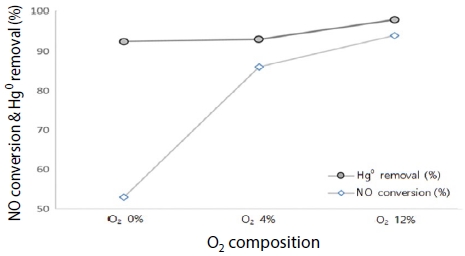
그림 14는 BZC를 대상으로 원소수은과 NOx 동시 저감에서 O2 농도 증가에 따른 영향을 분석한 것이다. O2 농도를 0, 4, 12%에서 실험한 결과, 산소 농도와 비례하여 원소수은과 NOx 제거효율이 증가하였으며, 이는 산소의 농도가 증가할수록 수은 산화 반응에 매우 기여하고 있음을 시사하고 있음을 알 수 있었다.
BZC를 대상으로 온도 300°C, Hg 200 μg/m3, NOx 200 ppm, NH3 200 ppm, H2O 0% 조건에서 Ontario Hydro Method를 통해 배출가스 중 원소수은 또는 산화수은 중 어떤 형태로 존재하는지 분석하였다.
그림 15는 산소 농도를 증가하면서 Hg0와 Hg2+ 성분비를 분석 실험한 결과, 무산소 조건에서도 산화수은이 원소수은보다 2~4.5배 이상인 것으로 나타났으며, 산소 농도가 12%였을 때 원소수은이 0%, 산화수은 비율이 7.5%, 원소수은 제거효율은 92.5%로 나타났다. 이는 원소수은 없이 산화수은 형태로 존재하여 SCR 후단 방지시설에서 수은 제거가 가능할 것으로 효율을 상승시킬 수 있을 것이다.
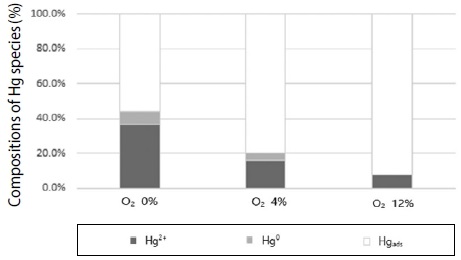
Hg0 and Hg2+ composition ratio with different O2 concentrations (Temp.: 300°C, Hg: 200 μg/m3, NOx: 200 ppm, NH3: 200 ppm, H2O: 0%).
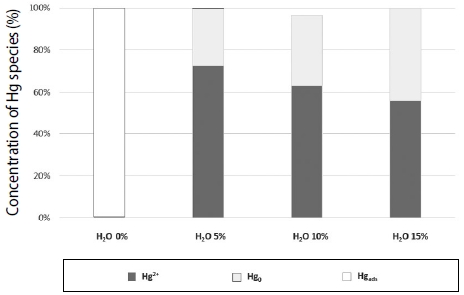
그림 16은 같은 조건에서 수분 농도 증가에 따른 원소수은과 산화수은 성분비를 분석한 결과, 수분이 15%이였을 경우 원소수은 44.2%, 산화수은 55.8%로 나타났으며, 이는 수분 농도가 증가할수록 산화수은 비율이 감소하고, 원소수은 비율이 증가하였으나 수분에 의한 영향으로 천천히 산화되고 있음을 알 수 있다.
4. 결 론
본 연구에서는 화석연료 연소시설의 모사 공정을 통해 배출되고 있는 원소수은의 산화 반응과 NOx 동시저감 처리효율 변화를 연구하였다. 주로 수은 화합물을 SCR 및 FGD 등의 기존의 방지시설로 제거가 가능하다고는 하나, 실제 연소가스의 성상에 따라 그 제거효율이 일정 수준 이상을 유지하지 못하고 있는 것이 현실이다. 이에 기존 설비에 쉽게 적용이 가능하고 유사한 SCR로 활용되고 있는 Cu-Zeolite를 이용하여 수은 제거 및 NOx 동시저감 실험을 통하여 적용 가능성을 확인하고자 하였다.
4. 1 CuCl2 담지 후 촉매의 BET 및 XRF 분석 결과 2~3.0 nm micropore를 갖는 촉매로서, 원소수은 산화 및 저감 가능성이 있음을 알 수 있었다. ACC의 경우 Ontario Hydro Method를 통해 분석한 결과, 원소수은보다 산화수은 비율이 높게 나타난 반면, BZC의 경우 고온 영역에서 산화수은과 원소수은 배출농도가 큰 차이를 보이지 않아 ACC와는 차별화된 결정구조로 인하여 활성과 선택성이 높아 결과적으로 BZC가 고온 영역에서 ACC보다 더 효과적으로 원소수은을 제거할 수 있음을 알 수 있었다. 혼합 가스상에서 온도 변화에 따른 원소수은과 NOx 동시저감의 실험 결과에서도 고온 영역에서 BZC가 ACC보다 원소수은과 NOx 제거에 효율적임을 알 수 있었다.
4. 2 원소수은과 NOx 동시저감의 수분 영향 (5%)에 따른 실험 결과, 수증기가 촉매 기공에 먼저 흡착되는 경쟁 흡착으로 인해 원소수은과 NOx 제거효율에 영향이 있었으며, 이는 수증기가 ACC보다 BZC 기공에 먼저 흡착되고 있으며, 경쟁 흡착으로 인한 영향으로 BZC 수은 제거효율이 저하됨을 알 수 있었다. NOx 저감효율에서 ACC는 300°C에서 40.5%의 효율을 보이고, 이후 고온 영역에서 감소하는 반면, BZC는 100°C부터 효율이 급상승하여 250°C에 96.1%의 높은 효율을 보였다.
4. 3 효율이 좋은 BZC의 원소수은 및 NOx 동시저감에 따른 혼합 가스 영향을 실험한 결과, NH3는 원소수은 저감효율에 영향 없이 95% 이상 효율을 나타냈으며, NOx 저감효율에서도 300°C 이상 고온 영역에서 87%로 꾸준히 증가하였음을 나타냈다. 이는, SCR 환원제인 NH3가 존재하는 상태에서 원소수은 및 NOx 동시저감에서 NH3 영향이 미미함을 알 수 있었다.
또한, 수분함량이 점점 증가할수록 원소수은 100% 제거효율이 66%까지 저하되었으며, NOx 제거효율 또한 수분함량이 증가할수록 94%에서 82%로 효율이 저하되었다. 이는, 혼합 가스상에서 원소수은과 NOx 동시저감에서 수증기는 매우 큰 영향을 주고 있음을 알 수 있었다. 혼합 가스상에서 산소의 농도가 증가할수록 산화 반응에 기여하고 있어, 원소수은과 NOx 동시저감 효율이 증가하였음을 알 수 있었다.
4. 4 BZC 촉매를 통과한 원소수은이 어떤 형태로 존재하는지 Ontario Hydro Method를 통해 분석한 결과, 무산소 조건에서도 산화수은이 원소수은보다 2~4.5배 이상인 것으로 나타났으며, 배출가스 중 산화수은 형태로 존재하여 SCR 후단 방지시설에서 수은 제거가 가능하여 효율을 상승시킬 수 있을 것이다.
본 연구에서는 국내 수은 화합물의 제거기술로서 활성탄 및 제올라이트에 전이금속-할로겐염을 대표하는 CuCl2를 담지하고 이를 이용하여 원소수은 및 NOx 동시저감 반응 실험을 수행하였다. 그 결과 활성탄보다 제올라이트 촉매가 높은 효율을 나타냈으며, 화석연료 연소 공정에서 수분의 영향이 큼으로 현장 적용성에 한계점이 있으나, 수분 함량이 낮은 배기가스에서 활용가치가 높을 것으로 판단된다.
추가적으로 SO2, HCl 등의 산가스에 의한 영향 등 다양한 변수를 적용하는 연구를 진행한다면 실제 공정 적용성을 판단하는 데 크게 도움이 될 것으로 판단된다.
References
- Baerlocher, Ch., McCusker, L.B. (2017) Database of zeolite structure, http://www.iza-structure.org/databases
-
Balle, P., Geiger, B., Klukowski, D., Pignatelli, M., Wohnrau, S., Menzel, M., Zirkwa, I., Brunkalus, G., Kureti, S. (2009) Study of the selective catalytic reduction of NOx on an efficient Fe/H-BEA zeolite catalyst for heavy duty diesel engines, Journal of Applied Cataysis. B: Environment, 91, 587-595.
[https://doi.org/10.1016/j.apcatb.2009.06.031]

-
Carey, T.R., Hargrove Jr., O.W., Richardson, C.F. (1998) Factors affecting mercury control in utility flue gas using activated carbon, Journal of the AWMA, 48, 1166-1174.
[https://doi.org/10.1080/10473289.1998.10463753]

-
Colombo, M., Nova, I., Tronconi, E. (2012) Detailed kinetic modeling of the NH3-NO/NO2 SCR reaction over a commercial Cu-zeolite for diesel exhausts after treatment, Journal of Catalysts Today, 197, 243-255.
[https://doi.org/10.1016/j.cattod.2012.09.002]

-
Galbreath, K.C., Zygarlicke, C.J. (2000) Mercury transformations in coal combustion flue gases, Journal of Fuel Processing Technology, 65-66, 289-310.
[https://doi.org/10.1016/S0378-3820(99)00102-2]

-
Grinite, E.J., Pennline, H.W., Hargis, R.A. (2000) Novel Sorbents for Mercury Removal form Incineration Flue Gas by Organic and Inorganic Adsorbents, Journal of Chemosphere, 47, 907-913.
[https://doi.org/10.1016/S0045-6535(01)00329-0]

-
Hall, B., Oliver, L., Evert, L. (1990) Mercury chemistry in simulated flue gases related to waste incineration condition, Journal of Environ Science & Technology, 24, 108-111.
[https://doi.org/10.1021/es00071a013]

-
Kim, M.S., Lee, D.W., Lee, K.Y. (2012) Selective catalytic oxidation of ammonia over novel catalysts supported on acidic Fe-ZSM5 supports, Journal of Clean Technology, 18, 89-94.
[https://doi.org/10.7464/ksct.2012.18.1.089]

- Kim, S.M. (2017) A Study on the legislative proposal for the 「Rules on mercury」 of the European Union (EU) for the implementation of the minamata convention, Korean Legal Association & Law Research, 17(1), 1-23.
-
Lee, S.S., Kim, G.l., Oh, K.J., Jeon, J.M., Kim, D.J., Kim, J.Y. (2012) The characteristics of mercury oxidation in selective reduction catalysts by gas composition, Journal of Particle and Aerosol Research, 8, 125-132.
[https://doi.org/10.11629/jpaar.2012.8.4.125]

-
Li, C., Zhao, L. (2015) A review on oxidation of element mercury from coal-fired flue gas with selective catalytic reduction catalysts, Journal of Catalysis Science & Technology, 5, 3459-3472.
[https://doi.org/10.1039/C5CY00219B]

-
Li, J., Chang, H., Ma, L., Hao, J., Yang, R.T. (2011) Low-temperature selective catalytic reduction of NOx with NH3 over metal oxide and zeolite catalysts-A review, Journal of Catalysts Today, 175, 147-156.
[https://doi.org/10.1016/j.cattod.2011.03.034]

-
Ma, L., Chang, H., Yang, S., Chen, L., Fu, L., Li, J. (2012) Relations between iron sites and performance of Fe/H-BEA catalysts prepared by two different methods for NH3-SCR, Journal of Chemical & Engineering, 209, 652-660.
[https://doi.org/10.1016/j.cej.2012.08.042]

-
Presto, A.A., Granite, E.J. (2006) Survey of catalysts for oxidation of mercury in flue gas, Journal of Catalysts, 40, 5601-5609.
[https://doi.org/10.1021/es060504i]

-
Rahkamaa-Tolonen, T.K., Maunula, T., Lomma, M., Huuh-Tanen, M., Keiski, R.L. (2005) The effect of NO2 on the activity of fresh and aged zeolite catalysts in the NH3-SCR reaction, Journal of Catalysts Today, 100, 217-222.
[https://doi.org/10.1016/j.cattod.2004.09.056]

-
Roy, S., Hegde, M.S., Madras, G. (2009) Catalys for NOx abatement, Journal of Applied Energy, 86, 2284-2297.
[https://doi.org/10.1016/j.apenergy.2009.03.022]

-
Schroeder, W.H., Yarwood, G., Niki, H. (1991) Transformation processes involving mercury species in the atmosphere-Results from a literature survey, Journal of WASP, 56, 653-666.
[https://doi.org/10.1007/BF00342307]

-
Shwan, S., Jansson J., Korsgren, J., Olsson, L., Skoglundh, M. (2012) Kinetic modeling of H-BEA and Fe-BEA as NH3-SCR catalysts effect of hydrothermal treatment, Journal of Catalysts Today, 197, 24-37.
[https://doi.org/10.1016/j.cattod.2012.06.014]

-
Sriram, V., Li, C., Liu, Z., Jafari, M., Lee, J.Y. (2018) Reaction kinetic study of elemental mercury vapor oxidation with CuCl2, Journal of Chemical Engineering, 343, 244-257.
[https://doi.org/10.1016/j.cej.2018.02.127]

-
Stanciulescu, M., Caravaggio, G., Dobri, A., Moir, J., Burich, R., Charland, J.P., Bulsink, P. (2012) Low-temperature selective catalytic reduction of NOx with NH3 over Mn containing catalysts, Journal of Applied Cataysis. B: Environment, 123-124, 229-240.
[https://doi.org/10.1016/j.apcatb.2012.04.012]

-
Tsai, C., Chiu, C., Chuang, M., His, H. (2017) Influences of Copper (II) chloride impregnation on activated carbon for low concentration elemental mercury adsorption from simulated coal combustion flue gas, Journal of Aerosol and Air Quality Reaserch, 17, 1637-1648.
[https://doi.org/10.4209/aaqr.2016.10.0435]

- U.S. Environmental Protection Agency (US EPA) (1997) Mercury Study Report to Congress Volume II. https://www.epa.gov/sites/production/files/2015-09/documents/volume2.pdf, (EPA-452/R-97-004 Dec 1997).
- United Nation Environment Programme (UNEP) (2018) Technical Background Report for the Global Mercury Assessment 2018. https://www.amap.no/documents/download/3409/inline
-
Wu, C.Y., Lee, T.G., Tyree, G., Arar, E., Biswas, P. (1998) Capture of mercury in combustion systems by in situ-generated titania particles with UV irradiation, Journal of Environ Energy & Science 15, 137-148.
[https://doi.org/10.1089/ees.1998.15.137]

-
Zacharewski, T.R., Cherniak, E.A. (1987) FTIR Investigation of the heterogeneous reaction of HgO with SO2 at ambient temperature, Journal of Atmospheric Environment, 21, 2327-2332.
[https://doi.org/10.1016/0004-6981(87)90368-4]

김완수 (서울시립대학교 환경공학과 박사과정)
이경원 (서울시립대학교 환경공학과 박사)
동종인 (서울시립대학교 환경공학과 교수)