PM2.5 중심의 대기오염물질 건강 위해성 평가
Abstract
The purpose of this study is to review current research trends, evaluation cases, and methodologies applied in health risk assessments of PM2.5, aiming to inform policy development and suggest improvements. According to WHO (2025) data on mortality rates per 100,000 people from five diseases linked to indoor and outdoor air pollution, South Korea recorded mortality rates of 29.4 for men and 12.9 for women, indicating that men experienced a mortality rate 2.3 times higher than that of women. In comparison, Japan’s mortality rates for men and women were 57% and 63%, respectively, of Korea’s rates. Meanwhile, China’s mortality rates were notably higher, at 4.3 times for men and 7.8 times for women compared to Korea. Through February 2024, the most frequently published category in the health risk assessment of air pollution, as reported in the Journal of the Korean Society for Atmospheric Environment, was policy and evaluation methods, accounting for 22 out of 63 studies (34.9%). The next most published categories were volatile organic compounds (VOCs) and polycyclic aromatic hydrocarbons (PAHs) (14.3%), indoor and public facilities (12.7%), particulate matter (PM2.5 and PM10) (12.7%), industrial complexes (9.5%), abnormal climatic conditions (6.3%), automobiles (4.8%), and others (4.8%). This study introduces the following key research cases related to the health risks of air pollutants: estimation of excess mortality due to air pollutants, health risk assessment of PM2.5 using the Odds Ratio (OR), regional relative risk (RR) analysis of respiratory diseases associated with air pollution, calculation of PM2.5 deposition in the human respiratory system, evaluation of delayed inflammation in the respiratory system resulting from reduced alveolar-interstitial (AI) deposition of PM2.5, estimation of Disability-Adjusted Life Years (DALYs) attributable to air pollution, and health risk assessment of air pollution conducted by the European Environment Agency (EEA). In addition, the limitations of various evaluation methods used to assess the health risks of air pollutants were analyzed, and directions for future research were proposed.
Keywords:
Air pollutants, Health effects, PM2.5, Particulate matter, Risk assessment1. 서 론
대기오염과 실내공기오염은 호흡기질환을 유발하거나 그 증상을 악화시키며, 특히 영유아 및 고령자의 주요 사망 원인으로 작용한다 (Brauer, 2010). Brauer (2010)와 Cohen et al. (2017)은 전 세계적으로 매년 약 700만 명이 대기오염으로 사망하며, 전 세계 인구의 90% 이상이 오염된 공기를 호흡하고 있다고 보고하였다. 또한, 선진국이 많은 유럽에서도 2012년 한 해 동안 대기오염으로 인한 사망자가 193,000명에 이르렀다 (Ortiz et al., 2017). 세계보건기구 (WHO, 2018)에 따르면, 도시를 뒤덮는 스모그부터 실내 흡연까지 대기오염은 전 세계인의 건강에 심각한 위협이 되고 있으며, 전 세계 인구 10명 중 9명이 대기오염물질에 노출되어 심장질환, 뇌졸중, 만성폐쇄성폐질환 (COPD), 암, 폐렴 등의 질병 위험이 증가하고 있다. Yorifuji et al. (2011)은 일본 도쿄에서 경유차 배출가스와 사망률 간의 관계를 분석한 연구에서, 일평균 초미세먼지 (PM2.5) 농도가 10 μg/m3 증가할 때마다 뇌혈관질환으로 인한 사망률이 1.3% 증가한다고 보고하였다. PM2.5는 주요 대기오염물질 중 하나로, 대기 중에 부유하는 입자상 물질 중 그 크기가 2.5 μm 이하인 미세입자를 의미한다. 최근 세계보건기구 (WHO, 2024)에 따르면, 대기오염으로 인해 전 세계에서 매년 약 409만 명이 사망하며, 이 중 상당수가 고농도 PM2.5 노출과 관련이 있는 것으로 나타났다. 한편, Ostro (2004)는 대기 중 미세먼지 농도를 3 μg/m3까지 낮추면 호흡기질환으로 인한 사망률을 감소시킬 수 있다고 밝혔다.
최근 우리나라에서도 PM2.5 문제는 가장 심각한 환경 이슈 중의 하나이다. 우리나라는 1960년대부터 고도성장기를 거쳐 공업화가 진행되었으며, 일부 제조업 공장이 해외로 이전되었지만 제철·정유 등 대규모 중화학공업은 여전히 주요 산업으로 유지되고 있다. 이러한 각종 산업시설은 자동차와 함께 PM2.5의 주요 발생원으로 작용하고 있다. 이러한 상황에서 우리나라는 대기질을 관리·개선하고 이를 통해 국민의 삶의 질을 향상시키기 위해 환경부 및 지방자치단체에서 총 12개 종류의 대기오염측정망 919개소 (2022년 12월말 기준)를 전국에 운영하고 있다. 특히, 인구밀집지역인 수도권에는 수도권 대기환경 개선에 관한 특별법을 제정하고, 2005년부터 수도권대기환경청을 발족해 운용하고 있다. 또한 2005년부터 2014까지 1차 기본계획을 시행하였으며, 2015년부터 2024년까지 2차 사업으로 사업장 관리대책 (수도권 사업장 총량 관리제)과 자동차 관리대책 (경유차 저공해화 사업)을 추진하고 있다. 그러나 이러한 지속적인 노력에도 불구하고, 수도권을 중심으로 우리나라의 대기질은 여전히 개선되지 않고 있는 것이 현실이다. 특히, 우리나라의 PM2.5 농도는 2022년 기준 17.9 μg/m3로 경제협력개발기구 (OECD) 회원국 중 가장 높은 것으로 나타났다 (Statistics Korea, 2023). 한국환경정책·평가연구원에서 발표한 2018년 국민환경의식조사에 따르면, 국민 10명 중 3명 이상이 미세먼지를 포함한 대기질 개선을 가장 시급한 환경문제로 인식하고 있는 것으로 나타났다. 또한, 같은 조사에서 우리나라 국민의 76.5%가 다양한 매체를 통해 미세먼지 정보를 확인하며, “하루 1회” 확인하는 비율이 42.2%로 가장 높았다. “일주일에 1~2회” 확인하는 비율은 27.5%, “1~2시간에 한 번씩” 확인하는 비율은 19.4%로 조사되었다 (KEI, 2018).
본 연구에서는 PM2.5를 중심으로 대기오염과 관련된 주요 질병 및 피해 실태를 고찰하고, 대기오염물질의 건강 위해성 평가에 관한 국내 연구 동향과 주요 평가 사례 및 적용 기법을 체계적으로 정리하였다. 또한, 현재 활용되고 있는 건강 위해성 평가 방법의 한계를 분석하고, 향후 연구에서 고려해야 할 과제를 제안하였다. 이러한 연구 결과는 대기질 개선 방안 마련은 물론 관련 법·제도 정비 및 정책 입안을 위한 기초 자료로 활용될 수 있을 것으로 기대된다.
2. 주요 건강 위해성 대기오염물질
우리나라는 「환경정책기본법」, 「대기환경보전법」, 그리고 「악취방지법」을 통해 대기오염물질의 관리 및 배출 규제를 시행하고 있다. 「환경정책기본법」은 대기오염물질에 대한 기본적인 환경기준과 정책방향을 제시하며, 대기오염물질의 위해성 평가 및 규제는 주로 「대기환경보전법」에서 다루고 있다.
「대기환경보전법」에서는 대기오염물질을 대기오염물질, 유해성대기감시물질, 특정대기유해물질로 구분하여 관리하고 있으며, 이는 대기 중 오염물질의 특성과 위해성을 고려한 차등 관리의 필요성에 따른 것이다. 2025년 3월 기준으로 대기오염물질은 총 64종, 유해성대기감시물질은 총 43종, 특정대기유해물질은 총 35종이 지정되어 있다.
특정대기유해물질은 유해성 대기감시물질 중 위해성 심사 및 평가 결과, 저농도에서도 장기적으로 섭취하거나 노출될 경우 인체 건강이나 동·식물의 생육에 직접적 또는 간접적으로 위해를 끼칠 수 있어 대기배출관리가 필요하다고 인정된 물질을 의미한다. 대표적인 물질로는 카드뮴 (Cd) 및 납 (Pb) 화합물 등을 포함하고 있으며, 해당 물질들은 발암성, 돌연변이성, 생식독성 등의 특성이 있어 더욱 엄격한 배출허용기준이 적용된다.
대기 중에 존재하는 오염물질은 성상에 따라 크게 가스상 물질과 입자상 물질로 구분할 수 있다. 가스상 물질은 연소, 합성, 분해 등의 과정에서 발생하거나 물질적 성질로 인해 자연적으로 발생하는 기체 형태의 물질로 존재한다. 반면, 입자상 물질은 물질이 파쇄, 선별, 퇴적, 이적될 때나 기계적 처리, 연소, 합성, 분해 과정에서 발생하는 미세한 고체상 또는 액체상의 물질을 의미하며, 대표적으로 분진, 에어로졸, 연기, 안개, 훈연, 액적, 검댕, 석면 등이 포함된다. 특히, 초미세먼지 (PM2.5)는 입자 크기가 작아 공기 중에 오래 머무르며, 사람이 흡입할 경우 기관지나 폐에 침착하여 급성 및 만성 질환을 유발할 수 있다. PM2.5는 같은 중량의 미세먼지보다 폐에 접촉하는 표면적이 넓고, 유해성분을 다량 포함하고 있어 호흡기계와 순환기계에 미치는 영향이 더욱 크다고 보고된 바 있다 (Lin et al., 2017). 휘발성유기화합물 (VOCs)은 탄화수소를 포함하는 유기화합물로 석유화학제품, 유기용제, 도료, 접착제, 세정제 등에서 방출되는 휘발성이 높은 물질을 통칭한다. 일반적으로 100°C 이하의 비등점을 가지거나, 상온 (25°C)에서 증기압이 0.01 kPa 이상인 물질로 정의된다. VOCs는 대기 중에서 쉽게 증발하여 광화학 반응을 일으켜 오존 (O3)과 2차 유기입자 (Secondary organic aerosol, SOA) 생성을 촉진하여 대기오염을 심화시킨다. 또한 대부분의 VOCs는 독특하고 자극적인 냄새를 방출하며, 일부 물질은 인체에 유해한 영향을 미칠 수 있다.
한편, 「악취방지법」은 생활환경과 산업활동으로 인해 발생하는 악취물질을 체계적으로 관리하기 위해 제정된 법률로, 악취로 인한 국민의 불편을 줄이고 공중보건을 보호하는 것을 목적으로 한다. 「악취방지법」에서는 암모니아 (NH3), 황화수소 (H2S), 메틸머캅탄 (CH3SH) 등 대표적인 악취물질을 포함한 총 22종의 지정악취물질을 규제하고 있으며, 이들 물질은 주로 공장, 축산시설, 폐기물 처리시설 등에서 배출된다. 악취관리방안으로는 악취배출시설의 설치 신고 및 허가제도를 운영하며, 악취 배출허용기준을 설정하여 초과 시 개선명령 및 행정처분을 부과하도록 하고 있다. 또한, 악취발생지역을 악취관리지역으로 지정하여 집중적인 관리와 저감 대책을 시행하고 있다.
3. 대기오염 관련 주요 질병 및 피해 실태
표 1은 Thurston et al. (2017)이 발표한 자료를 바탕으로, 2017년 한 해 동안 주요 질병으로 인한 전 세계 사망자 수와 그중 대기오염과 관련된 사망자의 비율 (%)을 나타낸 것이다. 대기오염과 관련된 사망률은 만성폐색성폐질환 (Chronic Obstructive Pulmonary Disease, COPD)이 41%로 가장 높았으며, 급성 폐렴 35%, 당뇨병 20%, 폐암 19%, 허혈성 심장병 16%, 뇌졸중 11% 순으로 나타났다. 이와 같이, 대기오염으로 인한 사망에 이르는 질병에는 호흡기질환뿐만 아니라 뇌·심혈관 관련 질환 또한 이에 해당한다는 사실을 확인할 수 있다.
Summary of diseases considered in the 2017 Global Burden of Disease (GBD) study associated with air pollution (Thurston et al., 2017).
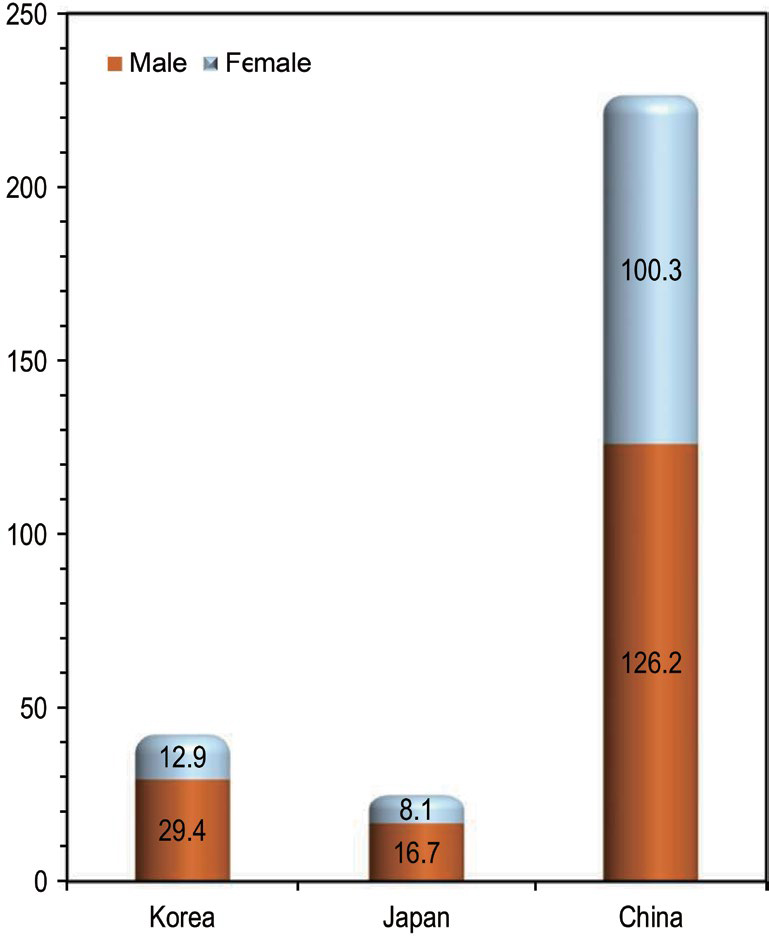
한국, 일본, 중국에서 대기오염 및 실내공기오염이 원인인 5가지 질병으로 인한 사망자 수를 표 2에 제시하였다. 이는 WHO가 2025년에 발표한 자료로, 연령을 보정한 주요 질병 (하부 호흡기 감염, 기관·기관지·폐암, 허혈성 심장병, 뇌졸중, 만성폐쇄성폐질환)에 의한 인구 10만 명당 성별 사망자 수를 나타낸 것이다. 우리나라에서는 남녀 모두 하부 호흡기 감염으로 인한 사망자 수가 인구 10만 명당 각각 6.77명과 3.74명으로, 다른 질병에 비해 상대적으로 높았다. 일본의 경우, 남성은 하부 호흡기 감염 3.93명, 여성은 허혈성 심장병 2.57명으로 다른 질병보다 상대적으로 높은 사망률을 보였다. 한편, 중국에서는 남성이 뇌졸중으로 33.66명, 여성의 경우 허혈성 심장병으로 31.89명이 사망하는 것으로 나타났다. 이처럼 한국·일본·중국에서 대기오염 및 실내공기오염이 원인인 5가지 질병으로 인한 사망자 수에 특이적인 경향이 있는 것으로 분석되었다.

Age-standardized mortality rate per 100,000 population in Korea, Japan, and China from five major diseases attributable to indoor and outdoor air pollution.(Deaths/100,000 people)
그림 1은 표 2의 데이터를 바탕으로, 한국·일본·중국의 남녀별 대기오염 및 실내공기오염이 원인인 5가지 질병으로 인한 인구 10만 명당 사망자 수를 나타낸 것이다. 우리나라의 경우 남성은 29.4명, 여성은 12.9명으로, 남성이 여성보다 약 2.3배 높은 사망자 수를 보였다. 일본에서는 남성이 16.7명, 여성이 8.1명으로, 각각 우리나라의 57%와 63% 수준의 사망률을 기록하였다. 한편, 중국에서는 남성이 126.2명, 여성이 100.3명으로, 우리나라에 비해 남성은 4.3배, 여성은 7.8배 높은 사망률을 보였다. 이는 중국이 우리나라와 일본에 비해 상대적으로 고농도의 대기오염 및 실내공기오염물질에 더 많이 노출되었기 때문으로 사료된다.
4. 대기오염물질의 건강 위해성 평가에 대한 국내의 연구 동향
4. 1 연구대상 오염물질
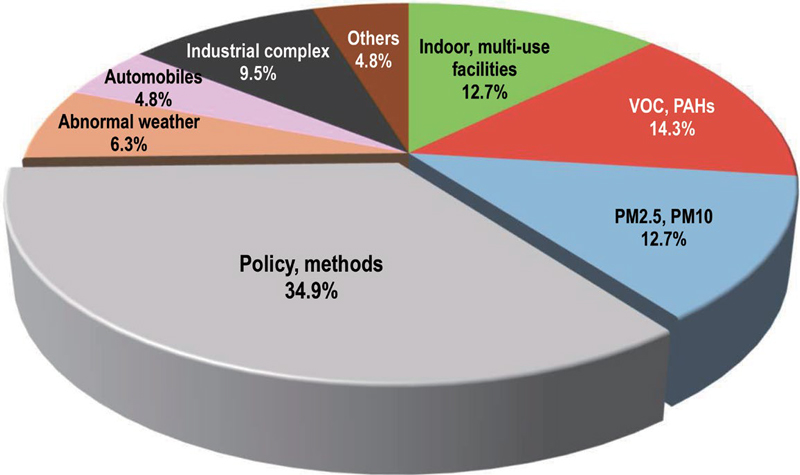
그림 2는 2024년 2월까지 한국대기환경학회지 (Journal of Korean Society for Atmospheric Environ-ment)에 발표된 건강 위해성 평가 관련 연구의 대상별 건수와 그 비율을 정리한 것이다. 여기에서, 가장 높은 비중을 보인 분야는 정책 및 평가기법에 관한 연구로, 전체 63건 중 22건 (34.9%)을 차지하였다. 다음으로 VOC 및 PAHs 14.3%, 실내 및 다중이용시설 12.7%, PM2.5 및 PM10 12.7%, 산업단지 9.5%, 이상기후 6.3%, 자동차 4.8%, 기타 4.8% 순으로 나타났다.
4. 2 연구대상 및 질병
표 3은 2024년 2월까지 한국대기환경학회지 (Jour-nal of Korean Society for Atmospheric Environment)에 발표된 대기오염의 건강 위해성 평가 관련 연구에서 연구대상 질병별 건수와 그 비율을 정리한 것이다. 여기에서, 인체 질병을 대상으로 한 연구는 38건으로, 동물을 대상으로 한 연구 (4건)보다 현저히 많았다. 인체 질병을 대상으로 한 연구 중에서는 알레르기, 천식, 발암성 관련 연구가 각각 10건으로 동일하였으며, 염증 및 독성과 관련된 연구가 8건으로 그 다음을 차지하였다.
5. 대기오염물질의 건강 위해성에 관한 국내외 연구사례
5. 1 대기오염물질로 인한 초과 사망자 수 추정
Shin (2013)은 서울지역에서 PM10 농도 변화에 따른 초과 사망자 수를 용량-반응 함수 (Dose-Response Function)를 적용한 평가모델을 통해 산출한 연구 결과를 제시하였다. 산출 과정에서는 대기오염물질 농도와 용량-반응 함수에서 도출된 기울기 (단위 농도별 연간 유병자 수 또는 단위 농도별 연간 사망률 변화)를 고려하였으며, 여기에 노출 가능한 인구 수나 기대 사망자 수를 곱하여 최종 위해도를 산출하였다. 노출 인구 수는 수도권 각 도시에 거주하는 인구가 대기오염물질에 100% 노출된다고 가정하고, 해당 연도의 사망률을 반영하여 연간 기대 사망자 수와 유병자 수를 각각 산출하였다. 대기오염물질로 인한 초과 사망자 수를 추정하기 위해 농도-반응 함수 (Concentration-Response Function, C-R function)를 활용하였다. 농도-반응 함수는 시간의 흐름에 따른 인체 사망률 변화를 지수 분포 (exponential distribution)로 설명하는 Gompertz 공식 (Gompertz formula)을 적용한 Rabl (1998)의 로그-선형 (log-linear) C-R 함수를 사용하였다. 이 연구에서 사용된 농도-반응 함수와 인체위해성 평가모델의 기본 구조는 다음과 같다.
Δy=y[exp (βΔx)-1]
Β=ln (RR) / Δx
Δy: 건강영향 지표의 변화량
y: 건강영향 지표의 기저값
Δx: 대기오염도 변화량
β: 계수
RR: 상대위험도
농도-반응 함수를 적용함으로써 서울지역에서 하루 동안 사고사를 제외한 사망자 수를 N이라 할 때, PM10 농도의 변화량에 따른 초과 사망자 수를 산출할 수 있다.
ΔN=y0 (exp (-βΔPM10)-1))×Pop
ΔN: 초과 사망자 수
y0: PM 변화 이전의 사망자 수
ΔPM10: PM 농도의 변화량
Pop: 인구 수
초과 사망자 수 산출 결과에 따르면, 서울시의 PM10 농도를 20 μg/m3 저감시킬 경우 연간 대기오염으로 인한 초과 사망자가 약 385~1,077명 감소할 것으로 추정되었다.
5. 2 Odds Ratio (OR)에 의한 PM2.5의 건강 위해성 평가
Ma et al. (2024)은 전국 평균보다 PM2.5 농도가 높은 전라북도 지역을 대상으로, 2021년 전라북도에서 시행된 미세먼지 및 대기환경 인식도 설문조사 자료 (Jeollabuk-do, 2021)를 바탕으로 PM2.5로 인한 생활의 불편함 (또는 불안감)에 대한 응답 결과를 분석하였다. 이를 통해 오즈비 (Odds ratio, OR)를 산정하여 PM2.5 등 대기오염물질과 관련된 건강영향에 대한 연구를 수행하였다. 오즈비 (OR)는 어떤 현상의 발생 가능성을 두 개의 그룹 간 비교하여 나타내는 통계학적인 척도 중 하나이다. 오즈 (Odds)는 어떤 현상의 발생 확률을 p라 할 때, p/(1-p)로 구할 수 있다. OR은 어떤 현상에 대해 한 그룹 (Group-1)과 다른 한 그룹 (Group-2)에서 계산된 Odds의 비로 정의되며, 다음과 같은 식으로 나타낼 수 있다.
OR=OddGroup-1/OddGroup-2
따라서, 어떤 현상에 대해 두 그룹의 확률을 각각 p (Group-1)와 q (Group-2)로 할 때, OR은 다음과 같이 구할 수 있다.
여기에서, OR=1이라 함은 두 그룹에서 현상의 발생 가능성이 동일함을 의미한다. OR>1인 경우 Group-1에서의 발생 가능성이 Group-2보다 더 높음을 의미하는 반면, OR<1인 경우 Group-1에서의 발생 가능성이 Group-2보다 낮음을 의미한다.
OR 산정 결과에 따르면, 전라북도 내 3개 도시 (전주, 익산, 군산)에서 PM2.5로 인해 “생활의 불편함 (또는 불안감)을 느낀다”는 응답의 Odds 값이 각각 6.3, 5.7, 8.7로 산출되어 군산>전주>익산 순으로 분석되었다. 이러한 결과에 대해 Ma et al. (2024)은 군산 시민들이 전주와 익산에 비해 PM2.5로 인한 생활의 불편함 또는 불안감을 상대적으로 더 크게 느끼고 있음을 시사한다고 보고하였다.
5. 3 대기오염에 의한 호흡기질환의 지역별 비교위험도 (Relative Risk, RR) 평가
코호트 연구 (cohort study)는 분석역학적 연구 방법 중 하나로, 특정 위험요인에 노출된 집단 (예: 흡연군)과 노출되지 않은 집단 (예: 비흡연군)을 장기간 추적 관찰하여 연구대상 질병 (예: 폐암)의 발생률 (DI-rate, %)을 조사하여 비교위험도 (Relative Risk, RR)를 산정함으로써 위험요인과 질병 간의 관련성을 조사하는 연구기법이다 (Brauer et al., 2008). 이 방법은 위험요인의 노출 여부에 따라 인구집단 (cohort)을 추적하여 결과를 도출하기 때문에 시간이 많이 소요되지만, 질병발생 위험도를 직접 구할 수 있는 장점이 있다.
그림 3은 Ma and Kang (2023)이 수행한 코호트 연구의 RR 산정 과정 및 산출식을 나타낸 것이다. 이 연구에서는 평가대상지역 (At)으로 도쿄 내에서 인구밀도가 높고 교통량 등 오염 발생원이 많아 상대적으로 대기오염이 심한 신주쿠 (Shinjuku)와 타마시 (Tamashi)를 선정하였다. 비교지역 (Ac)으로는 행정구역상 도쿄에 포함되지만, 남동쪽으로 약 1,000 km 떨어져 있고 대기오염 발생원이 거의 없는 오가사와라섬 (Ogasawara)을 선정하였다. RR 산정 과정에서 Np는 대기오 염 관련 환자 수를, Nh는 건강한 사람 수를 의미한다.
RR 산정 결과에 따르면 중장년층의 연령대에서는 신주쿠와 타마시가 각각 6.14와 5.20으로 큰 값을 나타내 비교지역인 오가사와라보다 비교위험도가 높은 것으로 나타났다.
5. 4 PM2.5의 호흡기계 침착량 산정
Ma et al. (2024)은 PM2.5의 폐포간질 (Alveolar-interstitial, AI) 침착량을 산출하기 위해, Löndahl et al. (2007)이 제안한 호흡기계 침착량 산정식을 다음과 같이 적용하였다. 실제 침착량 산정에는 COVID-19 발생 이전인 2019년과 팬데믹 기간인 2020년 각각 1년 동안 전라북도 대기관리권역과 비대기관리권역에서의 PM2.5 평균농도가 사용되었다.
Dep.PM2.5 (mg/year)
=Texp.(h)×CPM2.5 (µg/m3)×RI/O
×(1-Emask-cut)×Fdep. in AI×Rbre.(m3/h)
PM2.5의 호흡기계 AI 침착량 산정을 위한 변수는 다음과 같다.
Texp.(h): 각 행동패턴별 하루 중 활동시간
CPM2.5(µg/m3): 해당 지역별 PM2.5 농도
RI/O: 옥외 대기 중 PM2.5 농도에 대한 실내PM2.5 농도 비 (Choi and Kang, 2018)
(1-Emask-cut): 호흡패턴별 마스크에 의한 차단율 (Ma et al., 2024)에 기반한 PM2.5의 마스크 통과율
Fdep. in AI: PM2.5의 폐포간질 최대 침착률 (Yamada et al., 2007)
Rbre.(m3/h): 호흡패턴별 호흡량 (Chihara et al., 2003)
호흡기계 침착량의 산정 결과에 따르면 COVID-19팬데믹 기간 중 PM2.5의 AI 침착량은 전라북도 대기관리권역에서 남성이 15.98 mg, 여성이 9.62 mg으로 나타난 반면, 비대기관리권역에서는 남성이 30.37 mg, 여성이 22.33 mg으로 분석되었다. 이러한 결과는 두 권역에서 가정된 각 행동패턴별 하루 중 활동시간과 그에 따른 호흡량 및 AI 침착률의 차이 때문으로 해석되었다.
5. 5 PM2.5의 AI 침착량 저감에 따른 호흡기계 염증 지연효과 평가
Ma and Kang (2024)은 PM2.5의 AI 침착량 저감에 따른 알레르기성 호흡기계 염증 (Allergic airway inflammation, AAI)의 지연일수를 이론적으로 평가하였다. 연구에서는 COVID-19 발생 전후의 전라북도 대기관리권역과 비대기관리권역을 대상으로 AAI 지연일수를 평가하였다.
Balakrishnan and Jacob (2016)은 실험용 쥐를 대상으 로 AAI 연구를 수행하여 체중 1 kg당 AAI 유발 PM2.5 노출량 (Dose)이 1.58 mg/kg인 것을 밝혔다. 이들은 실험용 쥐의 AAI 용량을 사람에게 적용하기 위해 다음의 식을 제안하였다.
Dose PM2.5 Human (mg/kg)=Dose Mouse (mg/kg)×RKm
여기에서, 이고, Km Mouse와 Km Human는 다음 식으로 구하였다.
여기에서, BSA (Body Surface Area)는 일반적으로 신체의 총 외부 표면적 (m2)을 추정하기 위해 의료분야에서 사용되는 신체계측 정보로 DuBois and DuBois (1916)가 제안한 다음 수식이 가장 일반적으로 사용되고 있다.
BSA (m2)=0.007184×Weight0.425×Height0.725
위 식에서 Ma and Kang (2024)은 한국 성인의 체중을 남성 71 kg, 여성 56.8 kg으로 그리고 신장의 경우 남성 177.2 cm, 여성 158.8 cm로 각각 대입하였다 (KATS, 2015). 한편, 실험용 쥐의 표준체중과 BSA는 Balakrishnan and Jacob (2016)이 제시한 0.02 kg과 0.007 m2 를 이용하였다. 그리고, 한국인 성인 남녀의 AAI 유발 PM2.5 노출량 (Dose, AAI dosePM2.5 (mg))은 다음 식을 이용하여 산출하였다.
AAI dosePM2.5 (mg)
=DosePM2.5 (mg/kg)×Weight (kg)
최종적으로 AAI를 유발시키는 데 소요되는 일수 (Day to AAI dosePM2.5)를 다음 식으로 구하였다.
또한, AAI dosePM2.5 (mg)를 Day dosePM2.5 (µg/day)로 나누어 대상지역별 또는 대상시기별 AAI를 유발시키는 데 소요되는 일수 (Days to AAI)를 계산하고, 그 일수의 차이를 이용하여 최종적으로 AAI 지연일수 (Days of delayed AAI)를 산출하였다.
Ma and Kang (2024)의 연구 결과에 따르면, COVID-19 팬데믹으로 인한 일상생활의 제한 및 사회·경제적 활동의 제약으로 인해 PM2.5 농도가 감소하였으며, 그로 인한 긍정적인 효과로 AAI 지연일수 증가가 보고되었다. 즉, AAI 지연일수는 전라북도 대기관리권역의 경우 남성이 129일간, 여성이 190일간을 보였으며, 비대기관리권역의 경우 남성이 59일간, 여자가 69일간으로 나타났다.
5. 6 대기오염에 의한 장애보정생존연수 (Disability Adjusted Life Years, DALYs) 평가
장애보정생존연수 (DALYs)는 특정 질환으로 인해 건강하게 살 수 있는 기간이 얼마나 감소했는지를 정량화하는 지표이다. 1990년대에 처음 도입된 이후, 세계 각국에서 국가 차원의 질병부담을 평가하는 데 활용되고 있으며, WHO 또한 국가 간 건강수준을 비교하는 표준지표로 인정하고 있다. DALYs는 조기사망으로 인한 손실생애년수 (Years of Life Lost, YLL)와 질병 또는 장애로 인해 건강하지 않은 상태에서 생활한 기간에 장애 중증도를 반영해 산출한 장애생활연수 (Years Lived with Disability, YLD)의 합으로써 다음 식으로 산출할 수 있다. 여기에서, DALYs 값이 클수록 해당 질병이 전체 인구에 미치는 건강 부담이 크다는 것을 의미한다.
DALY=YLL+YLD
YLL: 특정 질환으로 인해 기대수명보다 조기사망하여 손실된 생애년수 (year)
YLD: 질병 또는 장애로 인해 건강하지 않은 상태에서 생활한 기간에 장애 중증도 (Disability Weight, DW)를 반영하여 산출한 생애년수 (year)
위 식에서 각 항목의 산출식은 다음과 같다.
YLL=N×LYLL
YLD=I×DW×LYLD
N: 특정 질환으로 인한 사망자 수
LYLL: 평균 기대수명 (year)
I: 장애발생 건수
DW: 장애 중증도에 따른 가중치
LYLD: 장애 상태가 유지되거나 사망할 때까지의 연수 (year)
그림 4는 대기오염으로 인해 질병에 이환된 4세 아동이 11세에 조기사망한 경우의 DALYs 산출 개념도를 나타낸 것이다.
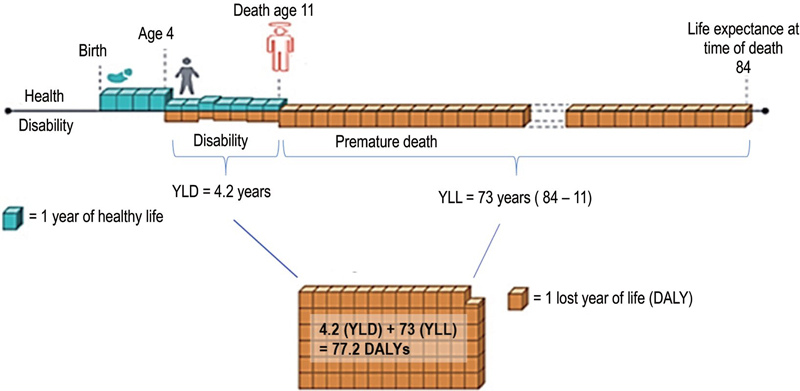
Conceptual diagram for the estimation of DALYs in a child affected by air pollution from age 4 and dying prematurely at age 11.
Ma and Kang (2021)은 WHO (2020)의 국가 및 질병별 YLL 및 YLD 데이터를 활용하여, 입자상 물질 (PM) 노출에 따른 기준 연령대별 DALY (R-DALYsPM)를 산출하는 식을 다음과 같이 제안하였다. 이 식은 입자상 물질로 인해 특정 연령대에서 조기사망 또는 장애 발생 확률을 반영하여, 연령별 DALYs의 변화량을 추정하는 방식이다.
YLL과 YLD: 기관, 기관지, 폐암에 대한 질환별 DALY 값 (WHO, 2020)
DALYs PM과 DALYs All: WHO (2020)에서 제시한 PM으로 인한 DALY 값과 모든 요인에 대한 총 DALY 값
DALYs PM과 DALYs All의 값은 각각 69,673과 996,554 로, [DALYs PM/DALYs All]은 0.0699가 된다. Ma and Kang (2021)의 연구에서는 기관지 및 폐암 관련 YLL과 YLD 값이 15세 미만에서 0으로 나타남에 따라 (WHO, 2020), 기준 연령대를 YLL과 YLD 값이 0 이상이면서 15세 이상의 연령대 중 최소값을 보인 15~29세로 설정하였다. 또한, 이들은 DALYs PM보다 PM2.5의 인체 (폐포간질) 침착량을 반영하여 보다 실질적으로 PM의 건강 위해성 평가에 사용할 수 있는 새로운 지표 즉, DALYs PM/DepositionPM2.5 (g)을 개발하였다.
: 각 연령대별 생애 침착량
Ma and Kang (2021)은 2016년 광주의 평균 PM2.5 농도 (23 µg/m3)를 적용하여 연령대별 인체 생애 침착량 기반 기관·기관지·폐암에 대한 성별 및 연령별 DALYs PM/DepositionPM2.5 (g)을 산출하였다. 그 결과 40세, 55세, 65세, 76세 남성에서 각각 1.42, 1.67, 2.47, 3.53 (g)으로 나타났다. 또한, 40대 이상의 연령대에서는 남성이 여성보다 1.68~2.7배 높게 나타났다.
이처럼 PM2.5의 인체 생애 침착량 (g)으로 보정된 DALYs PM/DepositionPM2.5 (g)은 기존 DALYs보다 PM2.5의 건강영향을 보다 구체적으로 평가할 수 있는 지표로 활용될 수 있음을 시사한다.
5. 7 유럽 환경청 (European Environment Agency, EEA)의 대기오염의 건강 위해성 평가
유럽 환경청 (EEA)은 매년 대기오염의 건강 위해성 평가를 실시하고 있다. 이는 대기오염이 인간의 건강에 미치는 영향을 객관적으로 평가하고, 대기질 개선책의 개발 및 시행을 위한 자료를 제공하며, 대기오염의 건강 위해성에 대한 대중의 인식을 높이는 것을 목적으로 한다. EEA의 대기오염에 따른 건강 위해성 평가는 WHO (2016)에서 제안한 다음의 3단계를 주요 골자로 한다.
- (1) 대상 대기오염물질에 대한 인간의 노출평가
- (2) 대기오염물질 노출에 따른 건강 위해성 추정
- (3) 추정결과의 불확실성 평가
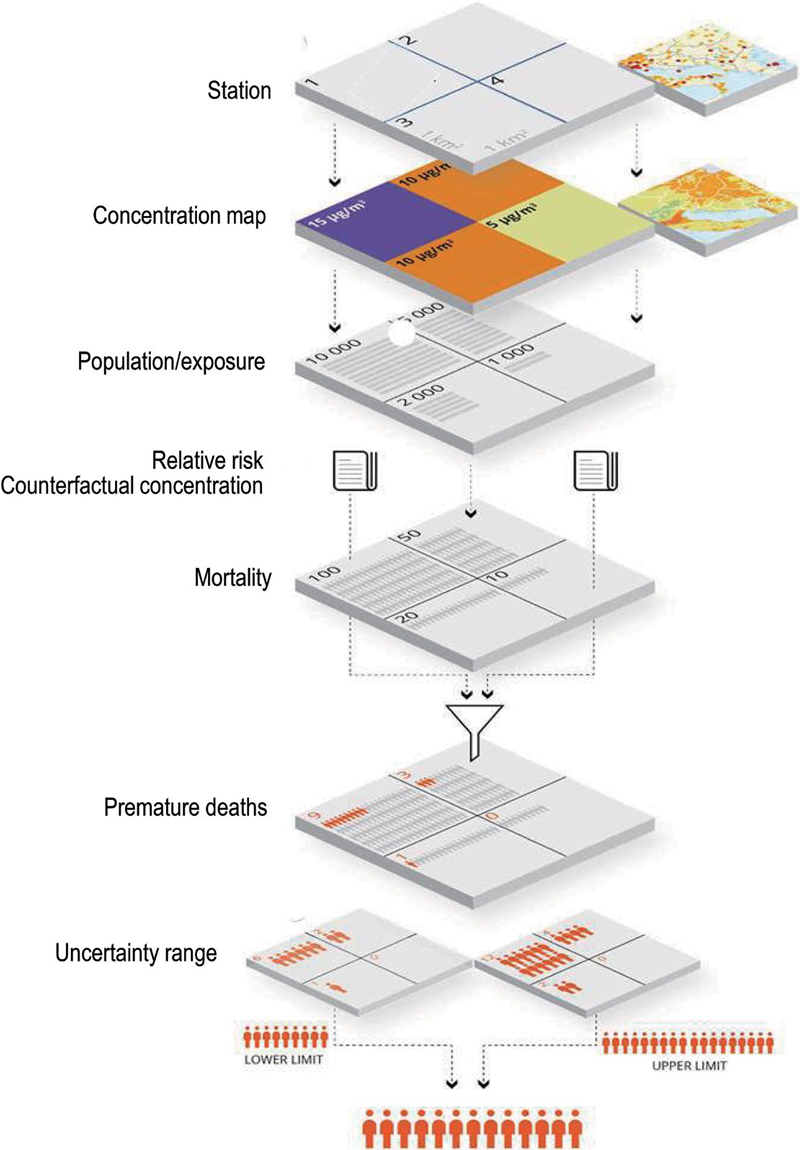
그림 5는 EEA의 대기오염에 따른 건강 위해성 평가과정을 나타낸 것이다 (EEA, 2023). 구체적인 평가과정은 건강유해성 평가 대상지역 선별 → 대기오염 측정소 데이터를 활용한 평가대상 지역별 초미세입자 (PM2.5) 평균농도 산출 → 평가대상 지역별 인구 산정 → PM2.5 농도가 10 µg/m3 증가 시 전체 요인을 고려한 PM2.5의 상대적 사망률 산정 → 평가대상 지역별 PM2.5 평균농도에 따른 영향평가 → 평가대상 지역별 PM2.5 평균농도에 따른 영향평가 → 30세 이상 국민을 대상으로 1년간 사망률을 기준으로 한 평가대상 지역별 사망률 산정 → 평가대상 지역별 PM2.5에 의한 조기사망률 산정 → 불확실성 평가 순으로 이루어진다.
표 4는 대기오염물질의 건강 위해성에 관한 국내외 연구에 활용된 각각의 위해성 평가방법에 대해 그 개요와 산출방법을 정리한 것이다.
6. 대기오염물질의 건강 위해성 평가의 제한성과 개선 노력
우리나라를 비롯한 여러 국가의 연구자 및 연구기관들은 다양한 연구 방법을 통해 대기오염의 건강 위해성에 대한 병리적 기전을 밝혀왔다. 동시에, 일반 대중들에게 대기오염의 위험성을 인지시키기 위해 지속적으로 노력하고 있다. 또한 WHO와 같은 국제기관들도 대기오염에 대한 경각심을 높이고 피해를 줄이기 위해 다양한 활동을 추진하고 있으며, 그중 하나가 BreathLife 캠페인이다 (UNEP, 2025). 이 캠페인은 전 세계 도시, 지역 및 국가가 2030년까지 WHO 대기질 가이드라인을 준수하도록 촉구하는 글로벌 이니셔티브이다. WHO는 대기오염을 안전하다고 판단되는 수준으로 줄이면 2030년까지 대기오염으로 인한 사망자 수를 절반으로 감소시킬 수 있으며, 동시에 기후변화 속도 저감에도 기여할 수 있을 것으로 발표하였다.
대기오염물질의 건강 위해성 평가의 주요 연구 방향은 크게 다음과 같이 분류할 수 있다.
- (1) 병리학적 연구: 질병과 환경유해인자 간의 연관성을 규명하는 연구
- (2) 정량적 평가: 노출량 평가 및 위해성 정량화 연구
- (3) 평가방법 및 모델 개발: 대기오염의 건강영향 평가기법 및 모델링 연구
- (4) 빅데이터 기반 연구: 대규모 데이터를 활용한 가설 설정 및 검증 연구
- (5) 설문조사 및 역학연구: 무작위 표본을 이용한 건강영향 분석
- (6) 기회주의적 연구: 특정의 대규모 사건 및 자연재해를 대상으로 한 실험적 연구
이러한 대기오염의 건강 위해성 연구는 상호 연계적이며 복합적이라는 것을 인식하는 것이 중요하다. 단일 연구 방법은 다양한 제반 상황에 따라 그 결과가 달라질 수 있으므로, 각 방법의 장·단점을 고려한 복합적인 접근이 필요하다. 이를 통해 결과의 불확실성을 최소화하고 현황 파악 및 평가, 예측 과정에서 오류를 방지해야 한다. 불확실성과 오류를 포함하거나 과학적 증거가 부족한 연구 결과는 정확한 예측 및 진단, 해결 과정에서 역효과를 초래할 수 있기 때문 이다.
수많은 환경유해물질 중 건강 위해성과 연관성이 높은 화학물질을 사전에 선별할 수 있는 시스템이 구축된다면, 위해성 평가와 예측, 그리고 선제적인 관리가 더욱 효과적으로 이루어질 것이다. Ka and Ji (2021)는 특정대기오염물질 (환경유해인자)과 건강유해성 (환경성 질환) 간의 과학적 인과관계를 정확히 규명하기 위해 질환 발생과 관련된 다양한 노출 생체지표 (exposure-biomarker)와 독성영향 생체지표 (effect-biomarker)를 개발해야 하며, 독성동태학 (toxicokinetic) 연구도 병행할 필요가 있다고 지적하였다.
또한, 대기오염으로 인한 건강 위해성을 예방하기 위해서는 대기오염물질 노출과 질병 발생 간의 독성기전을 조사하여 부작용 경로 (adverse outcome path-ways, AOP)를 구축하는 것이 필수적이다. 부작용 경로 (AOP)란 인체 등 유기체가 위해물질에 노출되었을 때 독성 효과 (증상 등)를 유발하는 분자 및 세포 수준에서의 사건 순서를 식별하는 모델을 의미한다.
현재까지의 동물실험 (in vivo)에 기반한 건강 위해성 연구는 높은 비용과 낮은 효율성, 그리고 윤리적 문제로 인해 점차 감소하는 추세이며, 특히 다양한 신종 위해 화학물질을 대상으로 한 동물실험에는 많은 제약이 따른다. 이에 따라, 미국 환경보호청 (US EPA)은 환경 위해성 물질들의 잠재적인 독성효과를 평가하고 식별하기 위해 ‘실험실 독성 테스트 (toxicity forecaster, ToxCast)’를 활용해 왔다 (US EPA, 2025). 실험실 독성 테스트란 살아있는 세포, 단백질, 또는 생물학적 분자를 환경유해물질 (화학물질)에 노출시킨 후 변화를 관찰하여 위해성을 평가하는 검사법이다. 최근에는 이러한 실험실 독성 테스트 데이터가 축적되면서, 인공지능 (AI) 기술을 활용한 예측 독성 (in silico) 연구가 활성화되고 있다. 특히, 기계학습 (machine learning) 및 심층학습 (deep learning) 기법이 적용되면서, 보다 정밀한 위해성 평가가 가능해지고 있다 (Tang et al., 2018).
국내에서도 빅데이터를 활용하여 대기오염으로 인한 건강 위해성을 정량적으로 평가하거나, 빅데이터와 인공지능 (AI)을 활용한 예측모형을 구축하는 연구가 진행되고 있다. KISTI (2022)는 전 국민 보건의료 빅데이터와 인공지능을 활용하여 PM10에 의한 비감염성 질환의 위해도를 예측하는 모형을 구축하는 연구를 수행하였다. 구체적으로, 국내 전 지역의 PM10 농도를 혼합 모형 (mixed model)을 활용하여 추정한 후, 전국의 미세먼지 데이터에 대한 공간 보간 (spatial interpolation)을 수행하였다. 이 PM10 보간 데이터를 공개된 전 국민건강보험 청구자료의 거주지역 정보와 대조하여 인공지능 알고리즘을 적용함으로써 비감염성 질환 (non-communicable disease, NCD)의 위험도를 정량적으로 평가하였다.
KEI (2016)는 국민건강보험공단의 표본 코호트 데이터베이스 (DB)를 포함한 빅데이터를 활용하여 대기오염으로 인한 건강 위해성을 정량적으로 평가하고, 그 결과를 기반으로 사회적 비용을 산정함으로써 관련 정책 평가의 기반을 마련하였다. 특히 최근 활용 가능해진 표본 코호트 DB를 적용하여 대기오염으로 인한 건강 위해성 평가체계를 개선하고, 건강영향 (Health End-Point)을 고려한 단위가치를 추정함으로써 건강영향과 경제성 분석 간의 연계성을 강화하였다.
7. 결 론
PM2.5와 PM10을 포함한 각종 대기오염물질은 우리나라 공중보건의 주요 위험요인 중 하나로, 단순히 호흡기질환을 악화시키는 것에 그치지 않고, 뇌심혈관질환 악화, 출산 영향, 대사질환, 정신질환 등 다양한 건강문제를 유발하여 국민의 삶의 질을 저하시키고, 막대한 의료비 지출을 초래하고 있다. HRI (2019)는 우리나라에서 PM10으로 인한 직·간접적인 경제적 비용이 연간 4조 230억 원에 달하며, 이는 명목 국내총생산 (GDP)의 0.2%에 해당한다고 보고하였다. 또한 미세먼지 주의보가 발령되는 날에는 경제활동의 제약으로 인한 매출 감소로 인해 하루 경제적 손실이 1,586억 원에 달하는 것으로 추산되었다. 또 다른 국내 연구에서는 PM10 농도가 월평균 1%씩 1년 동안 증가할 경우, 각종 질환을 겪는 환자 수가 약 260만 명 증가하며, 이로 인해 매년 600억 원 이상의 추가 의료비가 발생하는 것으로 보고되었다 (Rhee et al., 2018). 이처럼 대기오염으로 인한 국민의 건강 위해성과 경제적 손실을 줄이기 위해서는 대기질과 건강 위해성 간의 연계성을 과학적으로 규명하는 것이 중요하다.
본 연구에서는 대기오염물질의 건강 위해성에 대한 국내 연구 현황 및 주요 평가사례, 그리고 평가기법을 소개하였다. 또한, 단일 평가기법의 한계를 알아보았고, 빅데이터와 인공지능 (AI)을 활용해 건강 위해성 평가체계를 개선한 연구사례를 소개하였다.
대기오염으로부터 국민의 건강과 재산을 보호하기 위해 중앙정부 및 지방자치단체는 새로운 관련 정책을 수립하는 동시에 기존 법령을 보완하고 개선하는 데 지속적으로 노력해야 한다. 또한, 상대적으로 취약한 계층을 위한 다양한 지원사업을 적극 추진할 필요가 있으며, 중국 등 인접 국가에서 유입되는 대기오염물질의 저감을 위해 국제적인 협력과 외교적 대응 방안을 강화하는 것이 필수적이다.
References
-
Balakrishnan, N.A, Jacob, S. (2016) A simple practice guide for dose conversion between animals and human, Journal of Basic and Clinical Physiology and Pharmacology, 7, 27-31.
[https://doi.org/10.1515/jbcpp-2016-0008]

-
Brauer, M. (2010) How much, how long, what, and where: air pollution exposure assessment for epidemiologic studies of respiratory disease, Proceedings of the American Thoracic Society, 7, 111-115.
[https://doi.org/10.1513/pats.200908-093RM]

-
Brauer, M., Lencar, C., Tamburic, L., Koehoorn, M., Demers, P., Karr, C. (2008) A cohort study of traffic-related air pollution impacts on birth outcomes, Environmental Health Perspectives, 116, 680-686.
[https://doi.org/10.1289/ehp.10952]

-
Chihara, H., Otsubo, Y., Yoneyama, Y., Sawa, R., Suzuki, S., Power, G.G., Araki, T. (2003) Basal metabolic rate in hyperemesis gravidarum: Comparison to normal pregnancy and response to treatment, American Journal of Obstetrics and Gynecology, 188(2), 434-438.
[https://doi.org/10.1067/mob.2003.74]

-
Choi, D.H., Kang, D.H. (2018) Indoor/outdoor relationships of airborne particles under controlled pressure difference across the building envelope in Korean multifamily apartments, Sustainability, 10, 1-14.
[https://doi.org/10.3390/su10051590]

-
Cohen, A.J., Brauer, M., Burnett, R., Anderson, H.R., Frostad, J., Estep, K., Balakrishnan, K., Brunekreef, B., Dandona, L., Dandona, R., Feigin, V., Freedman, G., Hubbell, B., Jobling, A., Kan, H., Knibbs, L., Liu, Y., Martin, R., Morawska, L., Pope, C.A. III, Shin, H., Straif, K., Shaddick, G., Thomas, M., van Dingenen, R., van Donkelaar, A., Vos, T., Murray, C.J.L., Forouzanfar, M.H. (2017) Estimates and 25-year trends of the global burden of disease attributable to ambient air pollution: an analysis of data from the Global Burden of Diseases Study 2015, Lancet, 389, 1907-1918.
[https://doi.org/10.1016/S0140-6736(17)30505-6]

-
DuBois, D., DuBois, E.F. (1916) A formula to estimate the approximate surface area if height and weight be known, Archives of Internal Medicine, 17, 863-871.
[https://doi.org/10.1001/archinte.1916.00080130010002]

- European Environment Agency (EEA) (2023) Assessing the risks to health from air pollution. https://www.eea.europa.eu/publications/assessing-the-risks-to-health/assessing-the-risks-to-health, (accessed on March 3, 2025).
- Hyundai Research Institute (HRI) (2019) Public perception survey on fine dust. https://hri.co.kr/kor/report/report-view.html?mode=1&uid=30120, (accessed on March 3, 2025), (in Korean).
- Jeollabuk-do (2021) Implementation Plan for Jeollabuk-do in Accordance with the Comprehensive Plan for Fine Dust Management and the Basic Plan for Improving Air Quality in the Central Region, p. 346-366, (in Korean).
-
Ka, Y.J., Ji, K.H. (2021) A Systematic Review of Toxicological Studies to Identify the Association between Environmental Diseases and Environmental Factors, Journal of Environmental Health Sciences, 47(6), 505-512.
[https://doi.org/10.5668/JEHS.2021.47.6.505]

- Korea Institute of Science and Technology Information (KISTI) (2022) A study of non-communicable disease risk expectation model by utilizing Korean healthcare big data and artificial intelligence, Sejong University Industry-Academic Cooperation Foundation. https://scienceon.kisti.re.kr/commons/util/originalView.do?cn=TRKO202200014618&dbt=TRKO, (accessed on March 3, 2025), (in Korean).
- Korean Agency for Technology and Standards (KATS) (2015) The final report on the 7th Korean Human Dimension Survey Project. https://sizekorea.kr/human-info/measreport?measDegree=8, (accessed on March 3, 2025), (in Korean).
- Korean Environment Institute (KEI) (2016) Assessment of human health effects of air-pollution using cohort DB and estimation of associated economic costs in Korea (II). https://scienceon.kisti.re.kr/commons/util/originalView.do?cn=TRKO201800014467&dbt=TRKO, (accessed on March 3, 2025), (in Korean).
- Korean Environment Institute (KEI) (2018) Environmental and economic integrated analysis for comprehensive environmental valuation: 2018 national environmental awareness survey. https://scienceon.kisti.re.kr/commons/util/originalView.do?cn=TRKO201900017290&dbt=TRKO, (accessed on March 3, 2025), (in Korean).
-
Lin, H., Liu, T., Xiao, J., Zeng, W., Guo, L., Li, X., Xu, Y., Zhang, Y., Chang, J.J., Vaughn, M.G., Qian, Z.M., Ma, W. (2017) Hourly peak PM2.5 concentration associated with increased cardiovascular mortality in Guangzhou, China, Journal of Exposure Science & Environmental Epidemiology, 27, 333-338.
[https://doi.org/10.1038/jes.2016.63]

-
Löndahl, J., Massling, A., Pagels, J., Swietlicki, E., Vaclavik, E., Loft, S. (2007) Size-resolved respiratory-tract deposition of fine and ultrafine hydrophobic and hygroscopic aerosol particles during rest and exercise, Inhalation Toxicology, 19, 109-116.
[https://doi.org/10.1080/08958370601051677]

-
Ma, C.-J., Jang, N.J., Kang, G.U. (2024) A preliminary study on the current status and health effects of PM2.5 for evaluating the act on air quality management regions in Jeollabuk-do province, Journal of Environmental Health Society, 44(6), 539-547.
[https://doi.org/10.5668/JEHS.2024.44.6.539]

-
Ma, C.-J., Kang, G.U. (2021) A case study on the chemical compositions and health risk of PM2.5, Toxicology and Environmental Health Science, 13, 269-277.
[https://doi.org/10.1007/s13530-021-00091-9]

-
Ma, C.-J., Kang, G.U. (2023) A study on the air pollution status and health effects in Tokyo, Journal of Korean Society for Atmospheric Environment, 39(4), 469-477.
[https://doi.org/10.5572/KOSAE.2023.39.4.469]

-
Ma, C.-J., Kang, G.U. (2024) Variation of PM2.5 concentration during the COVID-19 pandemic in Jeollabuk-do, Korea and its health effect, Journal of Korean Society for Atmospheric Environment, 40(4), 456-466.
[https://doi.org/10.5572/KOSAE.2024.40.4.456]

-
Ortiz, C., Linares, C., Carmona, R., Díaz, J. (2017) Evaluation of short-term mortality attributable to particulate matter pollution in Spain, Environmental Pollution, 224, 541-551.
[https://doi.org/10.1016/j.envpol.2017.02.037]

- Ostro, B. (2004) Outdoor air pollution: Assessing the environmental burden of disease at national and local levels, World Health Organization, Environmental Burden of Disease Series, 5. https://iris.who.int/handle/10665/42909, (accessed on March 3, 2025).
-
Rabl, A. (1998) Mortality risks of air pollution: the role of exposure-response functions, Journal of Hazardous Materials, 61, 91-98.
[https://doi.org/10.1016/S0304-3894(98)00112-5]

-
Rhee, H.C., Ahn, K.A., Kim, T.Y. (2018) A socio-economic loss of respiratory disease caused by particulate matter pollution: Focusing on panel VAR model, Journal of Management Consulting Research, 18(4), 173-186.
[https://doi.org/10.46254/jmcr.18.4.8]

-
Shin, D.C. (2013) The domestic research trend and the road map of health risk assessment of the air quality in Korea, Journal of Korean Society for Atmospheric Environment, 29(5), 528-535.
[https://doi.org/10.5572/KOSAE.2013.29.5.528]

- Statistics Korea (KOSTAT) (2023) Korea’s Safety Report 2023. https://kostat.go.kr/board.es?mid=a90101010100&bid=11887&act=view&list_no=430545, (accessed on March 3, 2025), (in Korean).
-
Tang, W., Chen, J., Wang, Z., Xie, H., Hong, H. (2018) Deep learning for predicting toxicity of chemicals: a mini review, Journal of Environmental Science and Health, Part C: Environmental Carcinogenesis and Ecotoxicology Reviews, 36(4), 252-271.
[https://doi.org/10.1080/10590501.2018.1520246]

-
Thurston, G.D., Kipen, H., Annesi-Maesano, I., Balmes, J., Brook, R.D., Cromar, K., De Matteis, S., Forastiere, F., Forsberg, B., Frampton, M.W., Grigg, J., Heederik, D., Kelly, F.J., Kuenzli, N., Laumbach, R., Peters, A., Rajagopalan, S., Rich, D., Ritz, B., Samet, J., Sigsgaard, T., Sunyer, J., Brunekreef, B. (2017) A joint ERS/ATS policy statement: What constitutes an adverse health effect of air pollution? An analytical framework, European Respiratory Journal, 49, 1600419.
[https://doi.org/10.1183/13993003.00419-2016]

- United Nations Environment Programme (UNEP) (2025) Breathe-Life Campaign. https://www.ccacoalition.org/projects/breathelife-campaign, (accessed on March 3, 2025).
- United States Environmental Protection Agency (US EPA) (2025) EPA is moving towards the future of chemical assessments with new approach methods. https://www.epa.gov/sciencematters/epa-moving-towards-futurechemical-assessments-new-approach-methods, (accessed on March 3, 2025).
- World Health Organization (WHO) (2016) Health risk assessment of air pollution: general principles. https://www.who.int/publications/i/item/9789289051316, (accessed on March 3, 2025).
- World Health Organization (WHO) (2018) 9 out of 10 people worldwide breathe polluted air, but more countries are taking action. https://www.who.int/news/item/02-05-2018-9-out-of-10-people-worldwide-breathepolluted-air-but-more-countries-are-taking-action, (accessed on March 3, 2025).
- World Health Organization (WHO) (2020) WHO methods and data sources for global burden of disease estimates 2000-2019. https://www.who.int/docs/default-source/gho-documents/global-health-estimates/ghe2019_daly-methods.pdf, (accessed on March 3, 2025).
- World Health Organization (WHO) (2024) Ambient (outdoor) air quality and health. https://www.who.int/news-room/fact-sheets/detail/ambient-(outdoor)-air-quality-andhealth, (accessed on March 3, 2025).
- World Health Organization (WHO) (2025) DG Indicator 3.9.1: Mortality rate attributed to household and ambient air pollution (per 100 000 population, age-standardized). https://www.who.int/data/gho/data/indicators/indicator-details/GHO/ambient-and-household-air-pollution-attributable-death-rate-(per-100-000-populationage-standardized) (accessed on March 3, 2025).
- Yamada, Y., Fukutsu, K., Kurihara, O., Momose, T., Miyabe, K., Akashi, M. (2007) Influences of biometrical parameters on aerosol deposition in the ICRP 66 human respiratory tract model: Japanese and Caucasians, Aarozoru Kenkyu, 22, 236-243, (in Japanese).
-
Yorifuji, T., Kawachi, I., Kanedam, M., Takao, S., Kashima, S., Doi, H. (2011) Diesel vehicle emission and death rates in Tokyo, Japan: a natural experiment, Science of The Total Environment, 409(19), 3620-3627.
[https://doi.org/10.1016/j.scitotenv.2011.06.002]

마창진 (일본 후쿠오카여자대학교 환경과학과 교수) (ma@fwu.ac.jp)
강공언 (원광보건대학교 보건의료행정과 교수) (gukang@wu.ac.kr)