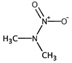
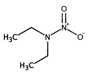
대기 중 입자상 니트로(소)화합물 농도를 결정하는 주요 변수
Abstract
Nitro(so) compounds in the atmosphere can be directly emitted through vehicle exhaust, landfill emissions, and combustion of plastics and rubber, and/or secondarily formed through reactions of amines in the atmosphere. Previous studies have investigated their formation mechanisms through chamber experiments for gas-phase reactions, laboratory studies for aqueous aerosol phase reactions, field measurements, and box modeling analyses. These studies indicated that gas-phase formation may be limited due to rapid photolysis, aqueous-phase reactions showed low yields, gas-liquid partitioning was identified as an important pathway, and reduced photolysis rates in aqueous phase could allow nitro(so) compounds to persist in aqueous phase including aerosols with water. This study comprehensively reviewed the major emission sources and the roles of major factors influencing the formation of particulate nitro(so) compounds. We further analyzed the major reaction pathways based on the measurement results in Seoul and Seosan during 2018~2019 reported in previous studies, by incorporating findings on atmospheric chemical reaction characteristics from other earlier studies. Additionally, we summarize cancer risks associated with atmospheric nitro(so) compounds from existing literature. The concentration of particulate nitrosamines generally increased with aerosol liquid water content, while nitramines showed no significant correlation. Nitrogen oxides exhibited distinct patterns of influence on nitrosamines and nitramines. Nitrosamines showed strong correlations with both NO and NO2, with NO correlations being particularly pronounced in winter, indicating the importance of the N2O3 formation pathway. Nitramines demonstrated stronger correlations with NO2, suggesting different formation mechanisms. Both compounds showed significantly reduced correlations with nitrogen oxides during summer, highlighting the seasonal variability in atmospheric chemical conditions affecting their formation. Ozonation reactions contributed to nitro(so) compound formation to varying degrees across seasons, with th
Keywords:
Nitrosamine, Nitramine, Aerosol liquid water content, Nitrosation, Ozonation1. 서 론
대기 중 초미세먼지 (particulate matter with an aerodynamic diameter equal to or less than 2.5 μm, PM2.5)는 호흡기 침투 시 유발되는 심각한 건강상의 위험성으로 인해 그 발생원과 대기 중 거동 특성에 관한 연구가 활발히 진행되었다. 초미세먼지는 호흡기 침투로 인한 직접적인 인체 위해성뿐만 아니라, 그 구성성분인 다양한 유기물질들의 독성으로 인해 암 발병과 유전자 변이를 유발할 수 있는 것으로 알려져 있다 (Davidson et al., 2005). 초미세먼지의 주요 배출원 규명과 인체 위해성 평가를 위해 수행된 화학성분 특성화 연구들은 주로 알칸류, 다환방향족탄화수소류, 당류, 카르복실산류와 같은 유기탄소성분들에 초점이 맞춰져 왔으며 (Chen et al., 2025; Zhang et al., 2025; Choi et al., 2024a; Choi et al., 2016), 상대적으로 유기 질소성분에 대한 연구는 미흡한 실정이다.
대기 중 초미세먼지를 구성하는 유기질소성분의 중요성이 부각되면서 국내외 연구에서 대기 중 유기질 소성분 연구가 수행되었다. 먼저 Cape et al. (2011)은 해양배출, 인위적 배출, 생물성 연소, 비료/분뇨 사용, 토양먼지 등을 대기 중 유기질소성분의 주요 배출원으로 제시하였고, 수용성 유기질소성분의 분석방법을 상세히 정리하였다. Ge et al. (2011)은 대기 중 약 150 종의 아민류와 30여 종의 아미노산의 배출원, 기체상 반응, 기체-입자 전환 및 침적을 포함한 거동 특성과 건강영향을 포괄적으로 검토하였으며, 특히 지방족 및 방향족 아민류의 건강영향과 함께 아미노산 및 요소의 대기화학반응에 대해서도 상세히 조사하였다. 한편 Nielsen et al. (2012)은 탄소중립 정책에 따른 CO2 포집 및 저장 기술의 발전에 따라 공정에서 사용되는 아민의 대기화학반응으로 인체에 유해한 니트로 (소)화합물이 생성될 수 있음을 밝히고, 이들의 생성, 배출 및 분해 메커니즘과 함께 독성학적 특성 및 환경 조건에 따른 거동 특성을 제시하고 있다.
국내에서도 대기 중 유기질소성분의 화학조성 및 거동 특성에 관한 연구들이 수행되었는데, Jang et al. (2020)에서는 베이징과 광주의 미세먼지에서 CHON 화합물을 분석하여 두 지역 모두 PM2.5 고농도 시 CHON 화합물의 비율이 높음을 확인하였고, 특히 광주에서는 CHON 화합물이 입자상 질산염 및 암모늄 이온과 양의 상관관계를 보여 질산암모늄에 의한 질소 함유 유기화합물의 2차 생성 영향이 베이징보다 더 강함을 시사하였다. 또 Baek et al. (2022)에서는 서울 대기 중 아미노산과 아민류의 정성 및 정량분석을 통해 아미노산 중에서는 글리신, 아민류 중에서는 트리메틸아민이 가장 높은 비중을 차지하며 이들이 복잡한 일차 배출원 및 2차 생성 반응의 영향을 받아 환경, 기후 및 건강에 영향을 미칠 수 있음을 보고하였다. Choi et al. (2020a)은 아민의 분석법을 고안하고 이를 통해 대기 중 아민의 농도를 보고하였는데, 이 연구에서는 입자상 아민류 농도가 계절적 차이가 크지 않으며 그 수준이 터키, 중국, 제주보다는 낮고 일 본 고베보다는 다소 높다고 밝혔다.
대기 중 입자상 유기질소성분은 전체 질소성분 중 약 20~80%를 차지하는 것으로 알려져 있으며 (Ng et al., 2017), 니트로사민 (nitrosamine), 니트라민 (nitramine), 아민 (amine), 이민 (imine), 아마이드 (amide), 니트로다방향족탄화수소 (nitro-polycyclic aromatic hydrocarbons, nitro-PAHs) 등으로 구성되어 있다. 전통적으로 대기 중 질소성분에 대한 연구는 초미세먼지의 주요 구성성분인 질산염 (NO3-)과 같은 무기질 소성분에 초점을 맞춰왔는데 (Seinfeld and Pandis, 2016), 이는 무기질소성분이 PM2.5 질량의 상당 부분을 차지하고 있고 특히 대기 중 초미세먼지의 농도가 증가할 때 질산염의 농도와 비중도 함께 증가하는 현상을 보였기 때문에, 질산염의 농도 저감이 대기질 관리의 주요 대상으로 인식되어 왔기 때문이다 (Kim et al., 2017). 그러나 최근 연구들은 유기질소성분 또한 전체 질소순환에서 중요한 역할을 수행함을 보여주고 있으며, 특히 대기질 관리에서 유기질소성분의 중요성이 점차 부각되고 있다 (Ng et al., 2017; Cape et al., 2011).
대기 중 유기질소성분의 대기 거동 특성은 무기질소성분의 거동 특성과 상호 연관되어 있다. NO, NO2, N2O5 등과 같은 기체상 질소화합물과 휘발성유기화합물 (Volatile Organic Compound, VOC)의 반응으로 생성된 유기질소화합물은 대기 중 산화과정을 거쳐 입자상 유기질소성분을 생성한다 (Nielsen et al., 2012; Ge et al., 2011) (그림 1). 입자상 유기질소성분은 광분해 또는 가수분해 등과 같은 반응을 통해 제거되기도 하는데, 그 과정에서 이산화질소 및 휘발성유기화합 물의 생성에 기여할 수 있고 결과적으로 무기질소성분의 농도에도 영향을 줄 수 있다 (그림 1). 이러한 복잡한 대기 중 화학반응은 유기질소성분이 대기 중 질 소산화물의 일시적 또는 영구적 저장소로 작용하면서 초미세먼지 생성에 주요하게 관여할 수 있음을 시사한다.
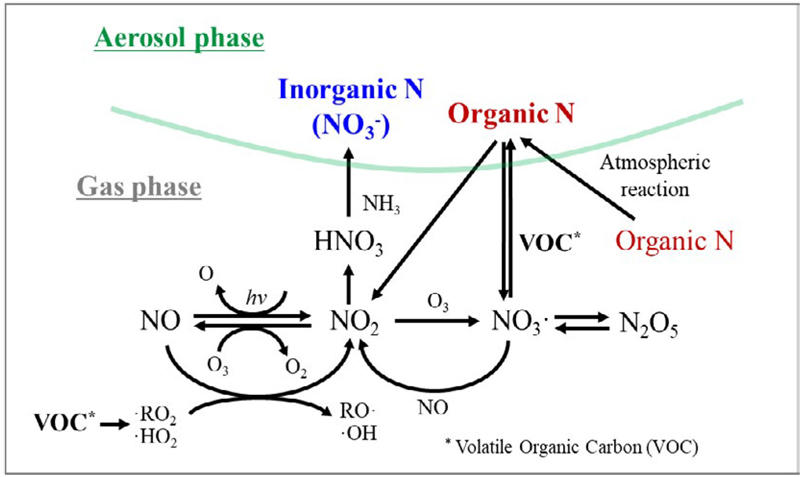
Intercorrelated atmospheric reaction in gas and particle phase of inorganic and organic nitrogen (Reconstructed based on Seinfeld and Pandis, 2016; Nielsen et al., 2012).
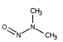
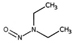
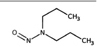
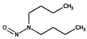
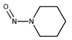
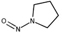
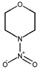
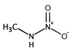
유기질소성분 중 니트로사민은 니트로소 작용기 (N-NO)를, 니트라민은 니트로 작용기 (N-NO2)를 갖는 유기질소성분이며, 표 1에 이 연구에서 다루는 니트로(소)화합물 종류를 보였다. 이들은 인체 위해성이 크다고 알려져 있다. 국제암연구소 (IARC)는 대부분의 니트로사민을 Group 2A (인체 발암 추정물질) 또는 2B (인체 발암 가능물질)로 분류하고 있으며 (IARC, 1978), 이러한 분류에 따라 여러 기관에서 다양한 매체에서의 니트로사민 농도에 대한 규제나 가이드라인을 수립하였다. 세계보건기구 (WHO)는 음용수 중 nitrosodi-methylamine (NDMA)에 대해 100 ng/L의 가이드라인 값을 권고하고 있으며, 미국 환경보호청 (US EPA)은 음용수, 폐수, 상업용 제품에서의 니트로사민 수준에 대한 규제와 권고사항을 시행하고 있다. 또한 미국 식품의약국 (U.S. Food and Drug Administration, US FDA), 유럽위원회 (European Commission, EC), 한국 식품의약품안전처 (Korea Food and Drug Safety, KFDS)는 고무 제품 중 니트로사민의 가이드라인 농도를 제안하였다 (KFDS, 2013; EC, 1993; USFDA, 1984). 특히 노르웨이 공중보건연구소는 대기 중 총 니트로사민 농도를 0.3 ng/m3 이하로 권고하고 있어 (Låg et al., 1984), 대기 중 니트로사민의 위해성에 대한 관리기준을 제시하고 있다.
Physicochemical properties1, IARC carcinogenic classification2, and inhalation unit risk3 of target nitro (small) compounds.
니트로(소)화합물은 자동차배기가스, 매립지 배출가스, 고무와 플라스틱의 연소 등과 같은 일차배출을 통해 대기 중에 존재할 수 있으며, 대기 중 아민과 아마이드의 기체상, 액체상 및 비균질 반응을 통해서도 생성될 수 있다. 특히 최근에는 탄소중립 정책에 따른 CO2 포집 및 저장 기술의 확대로 아민계 화합물의 사용이 증가할 것으로 예상되어, 이로 인한 유기질소화 합물의 배출 관리가 더욱 중요한 과제로 대두되고 있다. 이산화탄소 포집 및 저장 (Carbon capture and storage, CCS) 시설에서 사용되는 아민계 화합물은 대기 중으로 배출될 경우 니트로사민이나 니트라민과 같은 유해한 유기질소화합물로 전환될 수 있어 (Nielsen et al., 2012), 이에 대한 체계적인 관리방안 마련이 시급한 실정이다.
아민 및 아마이드의 대기 중 반응을 통한 니트로 (소)화합물의 생성은 크게 기체상 (gas phase), 액체상 (aqueous aerosol phase), 그리고 비균질 (heterogeneous) 반응을 통해 이루어진다 (그림 2). 기체상 반응은 아민류가 OH 라디칼과 반응하여 아민 라디칼을 생성하고, 이후 NO 또는 NO2와의 반응을 통해 니트로사민이나 니트라민을 생성한다. 액체상 반응은 질산화 (nitrosation) 반응과 오존과의 반응 (ozonation)을 통해 진행된다고 보고되고 있다 (Karl et al., 2012; Nielsen et al., 2012). 질산화 반응의 경우 N2O3, N2O4, HONO와 같은 질소산화물이 아민류와 반응하여 니트로사민과 니트라민을 생성한다. 액체상에서 아민의 오존화 반응을 통해서도 입자상 니트로사민과 니트라민이 일부 생성될 수 있다 (Choi et al., 2024b). 오존화 반응은 아민류가 오존과 반응하여 히드록실아민 (NH2OH)을 생성하고, 이후 아민류와의 연쇄반응을 통해 니토로사민을 생성하는 경로를 따른다. 액체상 반응은 에어로졸에 포함된 물에서도 일어날 수 있다. 마지막으로 비균질 반응은 기-액 계면에서 일어나는 반응으로, NO와 NO2가 동시에 존재할 때 아민류와 반응하여 니트로사민을 생성하는 것으로 알려져 있다. 본 연구에서는 비균질반응에 대한 특성을 다루지 않았는데, 이는 비균질반응의 메커니즘과 관련 인자들의 영향이 아직 충분히 규명되지 않았기 때문이다. 향후 비균질 반응의 메커니즘을 이해하고 관련 인자들의 영향을 정량적으로 평가하기 위한 체계적인 연구가 요구된다.
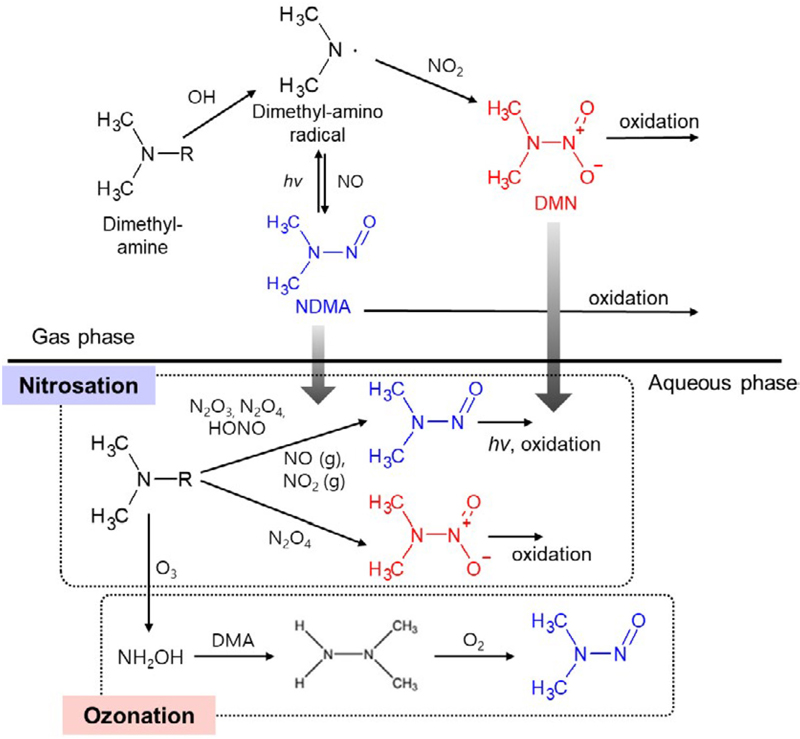
Atmospheric reaction forming nitrosodi-methylamine (NDMA) and nitro-dimethylamine (DMN) in gas and aqueous aerosol phase (Choi et al., 2024b, 2021).
본 연구에서는 현재까지 연구에서 보고하고 있는 (1) 니트로(소)화합물 측정 결과를 수집, 검토하고, (2) 아민과 아마이드의 반응을 통해 니트로(소)화합물을 생성하는 대기화학반응 특성에 대한 연구 결과를 정리하여 생성 메커니즘을 이해하고, (3) 이를 통해 대기 중 니트로(소)화합물 농도에 대기 생성 기여도를 평가하고, (4) 니트로(소)화합물에 의한 인체 건강영향 결과를 정리함으로써, 앞으로 인체 위해성 저감을 위한 효과적인 니트로(소)화합물을 포함한 유기질소입자 관리 방안 수립을 위한 과학적 근거를 마련하고자 한다.
2. 니트로(소)화합물 측정 자료
대기 중 전 세계 니트로사민 측정 연구 결과를 표 2에 보였다. 니트라민 농도 관측 결과는 우리나라에만 존재하며, 표 3에 보였다. 세계 여러 도시에서 수행된 대기 중 니트로사민 농도 측정 결과는 도시의 규모와 특성, 계절적 변동, 그리고 지역별 배출원 특성에 따라 매우 다양한 농도 분포를 보여주고 있다. 해외 도시 경우에도 지역과 계절에 따른 현저한 농도 차이가 관찰되었다. 터키 Zonguldak에서는 2008~2009년 측정에서 NDMA의 농도가 겨울철이 여름철보다 약 5배 높은 수준을 보였으며 (겨울: 9.43±4.99 ng/m3, 여름: 1.90±0.76 ng/m3) (Akyüz and Ata, 2013), 영국 런던에서도 2012년 측정에서 유사한 계절적 패턴이 관찰되었다 (겨울: 0.45~1.36 ng/m3, 여름: 0.24~0.49 ng/m3) (Farren et al., 2015). 중국 우루무치의 경우 2021~2022년 겨울철 측정에서 NDMA가 매우 넓은 농도 범위를 보였는데 (0.01~14.78 ng/m3), 이는 도시 내 지역별 배 출원 분포와 2차 생성 반응의 기여도 차이에 기인한 것으로 판단된다 (Wang et al., 2023). 특히 주목할 만한 것은 1975년 미국 Baltimore의 식품 제조 공장 인근에서 보고된 극단적인 고농도 사례로 (84~32,200 ng/m3) (Grosjean, 1991; Fine et al., 1976), 이는 특정 산업시설이 대기 중 니트로사민의 주요 직접 배출원 이 될 수 있으며, 적절한 배출 관리의 중요성을 보여주고 있다.
우리나라에서는 Hong et al. (2017)이 서울의 도로변과 주거지역의 PM2.5 중 니트로사민을 측정하였는데, 도로변에서는 NDMA (0.55 ng/m3), NDEA (0.01 ng/m3), NDPA (0.41 ng/m3), NDBA (0.01 ng/m3), NPIP (0.04 ng/m3), NPYR (0.3 ng/m3), NMOR (1.02 ng/m3)이 검출되었고, 주거지역에서는 NDMA (0.3 ng/m3), NDEA (0.31 ng/m3), NDPA (0.01 ng/m3), NDBA (0.22 ng/m3), NPIP (0.04 ng/m3), NPYR (0.43 ng/m3), NMOR (0.7 ng/m3)이 검출되었다. NPIP와 NPYR은 도로변과 주거지역에서 비슷한 수준을 보였으나, NDMA와 NDPA은 도로변에서 주거지역보다 높은 농도를 보인 반면, NDEA, NDBA 및 NMOR는 주거 지역이 도로변보다 높은 농도를 보였다 (표 1). 또 2018년 서울의 경우 7종 니트로사민의 농도가 계절에 따라 극명한 변동을 보였다 (Choi et al., 2021, 2020b) (표 1). 봄철에 가장 높은 총 농도를 보였고 (NDMA: 8.69±11.66 ng/m3, NDEA: 1.36±1.67 ng/m3, NDPA: 0.01±0.01 ng/m3, NDBA: 0.38±0.42 ng/m3, NPIP: 0.17±0.14 ng/m3, NPYR: 0.17±0.21 ng/m3, NMOR: 0.79±1.17 ng/m3), 여름철에 가장 낮은 수준을 보였다 (NDMA: 0.92±2.63 ng/m3, NDEA: 0.55±2.57 ng/m3, NDBA: 0.61±0.95 ng/m3, NPIP: 0.18±0.18 ng/m3, NPYR: 0.01±0.04 ng/m3, NMOR: 0.05±0.08 ng/m3) (Choi et al., 2021; 표 1). 이와 같은 니트로사민의 농도 변화는 여름철 1차 배출원의 영향 감소와 더불어, 니트로사민의 주요 전구체인 질소산화물 및 아민류의 낮은 농도에 기인한 것으로 추정된다.
산업시설과 농업활동의 영향을 받는 서산에서는 2019년 가을 측정에서 NDMA와 NDPA가 특히 높은 농도를 보였는데 (NDMA: 7.47±10.94 ng/m3, NDPA: 3.86±4.67 ng/m3), 이는 석유화학단지와 같은 산업시설로부터의 직접 배출이나 농업활동에서 발생하는 아민류와 질소산화물 등 전구물질의 광화학 반응이 주요하게 기여했을 것으로 추정된다 (Choi et al., 2022; 표 2). 계절에 따른 농도 분포 양상의 변화도 보였는데, 봄철 서산에는 NDMA와 NDBA가 높은 농도를 보였고 (NDMA: 6.83±6.92 ng/m3, NDBA: 7.86±8.59 ng/m3), 가을철 NDMA (1.82±2.73 ng/m3; Choi et al., 2022)와 NDPA (4.38±10.65 ng/m3; Choi et al., 2022)의 농도가 봄철보다 상대적으로 낮은 농도를 나타냈다 (표 2). 이러한 계절별 농도와 조성의 차이는 배출원의 특성뿐만 아니라 계절에 따른 대기 중 화학반응 조건의 변화도 니트로사민 농도에 중요한 영향을 미칠 수 있음을 시사한다. 반면 중소도시인 춘천은 2021~2022년 측정에서 겨울철과 여름철 모두 서울과 서산과 비교할 때 현저히 낮은 NDMA 농도를 보였으며 (겨울: 1.22±1.03 ng/m3, 여름: 0.07±0.11 ng/m3), 특히 기체상 농도 (겨울: 6.63±3.16 ng/m3, 여름: 0.50±0.33 ng/m3; Mai and Kim, 2024)가 입자상보다 높게 나타나는 특징을 보였다 (표 2).
최근 수행된 베이징과 서울의 비교 연구에서는 서울이 베이징보다 전반적으로 높은 니트로사민 농도 수준을 나타냈는데, 특히 NDMA와 NDBA에서 그 차이가 두드러졌다. 겨울철의 경우 서울의 NDMA와 NDBA 농도 (NDMA: 3.01±5.77 ng/m3, NDBA: 3.46±5.84 ng/m3)가 베이징 (NDMA: 0.71±1.58 ng/m3, NDBA: 0.11±0.00 ng/m3)보다 현저히 높았으며, 여름철에도 이러한 경향이 유지되어 서울 (NDMA: 2.04±1.77 ng/m3, NDBA: 3.17±3.39 ng/m3)이 베이징 (NDMA: 1.00±1.20 ng/m3, NDBA: 0.09±0.00 ng/m3)보다 높은 농도를 보였다 (표 2). 이러한 도시 간 농도 차이는 배 출원의 분포와 특성과 지역적 기상 조건의 차이에 기인했을 것으로 추정된다.
우리나라 대기 관측 자료만 있는 니트라민은 2018년 서울의 PM2.5 중 MN, DMN, DEN의 농도는 계절별로 다양한 변동을 보였다 (표 3). MN의 경우 여름철에 0.58±0.56 ng/m3로 가장 높았고 가을철에 0.17±0.09 ng/m3로 가장 낮았다. DMN은 여름철에 1.19±0.47 ng/m3로 가장 높은 농도를 보였고 겨울철에 0.26±0.24 ng/m3로 가장 낮았다. DEN은 봄철에 0.05±0.04 ng/m3로 가장 높았고 여름철에 0.01±0.01 ng/m3로 가장 낮은 농도를 나타냈다. 2019년의 경우 서울과 서산에서 측정이 이루어졌는데, 서울의 경우 MN은 검출되지 않았고 DMN은 봄과 가을 모두 0.08 ng/m3 수준으로 유지되었으며, DEN은 봄철 (0.62±0.49 ng/m3)이 가을철 (0.26±0.21 ng/m3)보다 높은 농도를 보였다. 서산의 경우 가을철에 DMN은 0.06±0.03 ng/m3, DEN은 0.84±0.97 ng/m3의 농도를 나타냈다.
대기 중 니트로(소)화합물의 다양한 1차 배출원은 NTP (2016) 보고서에서 제시한 니트로사민의 사용처 및 노출원으로부터 유추할 수 있다. NTP (2016)에 따르면, 니트로사민은 공통적으로 요리과정, 플라스틱 및 고무의 연소, 매립지 배출가스를 통해 배출된다고 보고되고 있으며, Ge et al. (2011)에서는 자동차 배기가스를 통해서도 대기 중에 존재할 가능성이 있다고 밝히고 있다. 개별 성분들의 배출원을 살펴보면, NDMA는 고무 및 아크릴로니트릴 중합체의 가소제 제조, 섬유 및 플라스틱의 용매, 윤활유 첨가제의 생산, 로켓 연료 제조시설, 고에너지 배터리의 금속-전해질 시스템 생산 시 사용되고 있다. NDEA는 섬유 산업용 용매, 공중합체 가소제 제조, 플라스틱 및 고무 제품 생산 공정에 사용되고 있으며, 담배연기, 요리과정, 플라스틱과 고무의 연소, 산업연소, 매립지 배출가스에 의해 대기 중에 배출될 수 있다. NDPA는 고무제품과 제초제의 생산에 사용되고 있으며 요리과정, 담배연기 및 매립지 배출가스에 의해 대기 중에 배출될 수 있다. NDBA는 디부틸하이드라진의 생산과정에서 사용되며 요리과정, 매립지 배출가스, 고무제품의 연소, 담배연기를 통해 대기 중에 존재할 가능성이 있으며, NPIP와 NPYR도 담배연기, 요리과정, 매립지 배출가스를 통해 대기 중에 배출될 수 있다. NMOR의 경우 항균제 제조, 폴리아크릴로니트릴 용매 사용 시설 및 N-아미노모르폴린 생산공정에 사용되고 있으며 다른 니트로사민과 마찬가지로 요리과정, 매립지 배출가스, 플라스틱 및 타이어 제조과정을 통해 대기 중에 배출될 가능성이 있다. 니트라민 계열 화합물의 경우 폭발물 (Yang et al., 2018)과 추진제 (Alexander et al., 1991) 제조 시 사용된다고 알려져 있으나, 구체적인 1차 배출원에 대한 정보는 제한적인 상황이다.
한편, 최근에는 기후변화 대응을 위한 이산화탄소 포집 및 저장 기술의 일환으로 아민 흡수제를 사용하는 연소 후 이산화탄소 포집 기술이 주목받고 있다. 이 기술이 국내에 도입되어 대규모로 적용될 경우, 운영 과정에서 상대적으로 적은 양이지만 의미 있는 수준의 아민이 대기 중으로 배출될 수 있다 (Buist et al., 2015; Nielsen et al., 2012). 아민 기반 이산화탄소 포집 모사 시설의 배출 연구에 따르면, 이산화탄소 포집 공정에서 사용되는 복잡한 구조의 아민 화합물이 분해되면서 메틸아민, 디메틸아민과 같은 단순한 구조의아민들이 생성된다 (Nielsen et al., 2012). 이러한 현상은 이산화탄소 포집에 사용되는 아민 흡수제의 종류와 관계 없이 공통적으로 발생하므로, 정화 처리된 배기가스에서도 이러한 구조가 단순한 형태의 아민들이 검출될 수 있다. 배출된 아민은 대기 중 NOx, 오존 및 기타 산화제들과의 반응에 따라 니트로사민과 니트라민을 생성할 수 있다. 따라서 이산화탄소 포집 및 저장 시설의 증가에 따른 대기 중 니트로(소)화합물의 배출 특성과 환경 영향에 대한 체계적인 연구가 요구되고 있으며, 특히 이들 화합물의 대기 중 거동과 2차생성 과정에 대한 이해가 필수적일 것으로 평가되고 있다.
3. 반응 메커니즘
3. 1 기체상 반응
기체상 반응의 경우, 표 4에서 보듯이 아민류가 OH 라디칼과 반응하여 아민 라디칼을 생성하고 (식 G1), 이후 NO와의 반응 (식 G2) 또는 NO2와의 반응 (식 G3)을 통해 니트로사민이나 니트라민을 생성한다. 이때 니트로사민의 생성속도상수 (7.1·10-13 cm3/molecule·sec; 식 G2)는 니트라민 (8.53·10-14 cm3/molecule·sec; 식 G3)에 비해 약 10배 느린 것으로 보고되고 있다. 또한 기체상 니트로사민은 대기 중 광분해 반응을 통해 매우 빠르게 제거되기 때문에 기체상 니트로사민의 농도는 매우 낮을 것으로 예상된다.

Atmospheric reaction of amine forming nitroso-dimethylamine (NDMA, (CH3)2NNO) and dimethylnitramine (DMN, (CH3)2NNO2) in gas, aqueous aerosol phase, and heterogeneous reaction.
이와 관련하여 Pitts Jr. et al. (1978)은 아민의 지속적인 배출원을 가정하여 대기 중 아민 농도를 50, 2, 0.1 ppb의 세 가지 시나리오로 설정하고, 도시 대기의 일반적인 조건 (NO =NO2=0.1 ppm, OH =10-7 ppm)에서 생성 반응과 제거 반응을 고려한 대기화학 반응 실험을 수행하였다. 실험 결과, 디에틸아민과 NO2 혼합물의 경우 일광 노출 시 니트로사민의 광분해가 암반응에 의한 생성보다 우세하였다, 트리에틸아민의 경우에는 디에틸니트로사민 농도가 60분 이상 지속적으로 증가하다가 이후에야 광분해가 우세해지는 것으로 나타났다. 이는 아민의 구조에 따라 니트로사민의 생성과 분해 속도가 다르게 나타날 수 있음을 시사한다. 일사각 40도에서 디메틸니트로사민의 정상상태 농도는 각각 200, 8, 0.4 ppt로 예측되었으며, Table 4. Atmospheric reaction of amine forming nitroso-dimethylamine (NDMA, (CH3)2NNO) and dimethylnitramine (DMN, (CH3)2NNO2) in gas, aqueous aerosol phase, and heterogeneous reaction. 이는 Grosjean (1991)에서 정리한 Los Angeles 지역 15개 지점 측정 결과와 유사한 수준으로, 광분해로 인해 기체상 니트로사민의 농도가 매우 낮게 유지되는 것이 타당함을 보여준다.
실제 측정 결과도 직접적인 배출원이 없는 Los Angeles 지역의 대부분 도시에서는 매우 낮은 수준의 기체상 니트로사민 농도가 관찰되었다 (Grosjean, 1991). Grosjean (1991)에서 제시한 Los Angeles 지역의 측정 결과를 자세히 살펴보면, Compton에서는 니트로사민이 전혀 검출되지 않았으며 (0 ppt), Torrance는 평균 1.7 ppt (최대 17 ppt)로 매우 낮은 수준을 보였다 (Grosjean, 1991). Los Angeles 도심 지역도 평균 2.3 ppt (최대 3 ppt)의 낮은 농도를 나타냈고, Hollywood의 경우도 평균 3.3 ppt (최대 27 ppt)로 유사한 수준이었다 (Grosjean, 1991). 또한 Pomona는 평균 4.3 ppt (최대 43 ppt), Whittier는 평균 5.6 ppt (최대 53 ppt), Woodland Hills는 평균 5.3 ppt (최대 27 ppt)로 모두 10 ppt 미만의 낮은 평균 농도를 보였다 (Grosjean, 1991). 이러한 측정값들은 산업시설이 밀집한 Baltimore 지역 (22~10,670 ppt)이나 아민 제조 공장이 있는 독일 (1~430 ppt)에 비해 수십에서 수천 배 낮은 수준이다 (Grosjean, 1991). 이처럼 일차 배출원이 없는 도시 지역에서 관찰된 매우 낮은 농도는 대기 중에서 일어나는 광분해 반응이 니트로사민의 효과적인 제거 기작으로 작용하고 있음을 입증하는 결과라 할 수 있다.
이전 연구에서 제시된 춘천에서 니트로사민 측정 결과 (Mai and Kim, 2024)를 LA 지역의 연구 결과와 비교해보면, 각 계절별 대표 온도 (봄·가을 15°C, 여름 30°C, 겨울 0°C)를 가정하여 온도를 보정한 춘천의 NDMA 평균 농도는 약 1.19±0.63 ppt (3.44±1.89 ng/m3)로 LA 도심 평균인 2.3 ppt보다 약 2배 낮은 수준이다. 계절별로는 겨울 2.35±1.04 ppt (6.63±3.16 ng/m3), 봄 1.38±0.90 ppt (4.03±2.73 ng/m3), 가을 0.89±0.45 ppt (2.62±1.35 ng/m3), 여름 0.15±0.11 ppt (0.50±0.33 ng/m3) 순으로 뚜렷한 계절성을 보였다. LA 지역의 농도 범위가 0~53 ppt인 것에 비해 춘천은 불검출 (Not detected, ND)~2.35 ppt (불검출~6.63 ng/m3)로 변동폭이 훨씬 작다. 특히 산업시설이 밀집한 Baltimore (22~10,670 ppt)나 아민 제조 공장이 있는 독일 (1~430 ppt)과 비교하면 LA와 마찬가지로 매우 낮은 수준이며, 이는 춘천 지역에도 직접적인 니트로 사민 배출원이 적다는 것을 시사한다. 또 춘천의 겨울철 농도 증가와 여름철 농도 감소는 각각 광분해 감소와 증가에 기인한 것으로 해석된다.
춘천의 대기 중 니트로사민 농도 연구 (Mai and Kim, 2024) 결과, 니트로사민은 입자상보다 기체상으로 더 많이 존재하는 것으로 나타났다. NDMA의 경우 모든 계절에서 기체상이 입자상보다 현저히 높았는데, 겨울철 (기체상 6.63±3.16 ng/m3, 입자상 1.22±1.03 ng/m3), 봄철 (기체상 4.03±2.73 ng/m3, 입자상 0.65±0.70 ng/m3), 가을철 (기체상 2.62±1.35 ng/m3, 입자상 0.52±0.14 ng/m3), 여름철 (기체상 0.50±0.33 ng/m3, 입자상 0.07±0.11 ng/m3) 모두에서 이러한 경향이 확인되었다. 다른 니트로사민 화합물에서도 유사한 패턴이 관찰되었는데, n-nitroso-methylethylamine (NMEA)는 겨울철 기체상 농도가 3.59±2.43 ng/m3, 입자상 농도가 0.47±0.20 ng/m3였으며, NDEA 역시 겨울철 기체상 농도 3.68±2.08 ng/m3, 입자상 농도 0.55±0.37 ng/m3로 기체상이 더 높았다. 계절별로는 겨울철에 가장 높은 농도가, 여름철에 가장 낮은 농도가 측정되었는데, 이는 겨울철의 대기 정체와 광분해 반응 감소, 여름철의 활발한 광분해와 대기 확산의 영향으로 해석된다. 이러한 결과는 춘천에서는 니트로사민의 높은 증기압으로 인해 대기 중에서 주로 기체상으로 존재함을 보여준다 (Mai and Kim, 2024). 이는 기체상으로 1차적으로 배출되었거나 기체상 아민의 반응을 통해 생성된 니트로사민이 에어로졸상으로의 상변화와 액체상 에어로졸의 반응보다 대기 중 니트로사민의 농도에 더 많은 기여를 하였기 때문이라고 추측된다. 하지만 춘천에서 보인 니트로사민의 상대적으로 높은 기체상 농도와 낮은 액체상 농도의 원인은 향후 대기오염물질 및 에어로졸의 수분함량과 같은 다른 대기환경적 특성과의 종합분석을 통해 규명 할 수 있을 것으로 예상된다.
3. 2 액체상 반응
질산화 반응은 대기 중의 아민류와 여러 질소산화물이 반응하여 니트로사민과 니트라민을 생성하는 과정을 의미한다. 표 4에 제시된 N1 반응에서 보듯이, 디메틸아민 ((CH3)2NH)과 N2O3가 반응하여 디메틸니트로사민 ((CH3)2NNO)과 HONO를 생성하며, 이 반응의 속도상수는 4.29·107 M-1 sec-1로 매우 빠른 반응속도를 보인다. 또한 N2 반응에서는 디메틸아민이 N2O4와 반응하여 디메틸니트로사민과 디메틸니트라민을 동시에 생성하며, 이 반응의 속도상수는 4.0·107 M-1 sec-1이다. 특히 HONO와의 반응 (N3)은 0.1 M-1 sec-1로 상대적으로 느린 반응속도를 보이지만, 대기 중 HONO의 높은 농도를 고려할 때 중요한 생성 경로가 될 수 있다. 한편, N4, N5, N6 반응은 생성된 디메틸니트로사민이 OH 라디칼, O3, NO3 라디칼과 각각 반응하는 것을 보여주는데, 이는 니트로사민의 대기 중 변환 과정을 나타낸다. 특히 OH 라디칼과의 반응속도 상수는 4.5·106 M-1 sec-1로 비교적 빠른 반응을 보이며, 이는 대기 중 니트로사민의 주요소멸 경로가 될 수 있음을 시사한다. N7 반응에서는 광분해에 의한 니트로사민의 분해가 일어나며, N9에서는 니트로사민이 OH 라디칼과 추가로 반응하는 것을 보여준다. 이러한 다양한 질소산화물과의 반응은 액체상에서 니트로사민 생성의 주요 경로로 작용하며, 특히 N2O3와의 빠른 반응은 액체상에서의 니트로사민 생성에 크게 기여할 수 있다. 또한 이러한 반응들의 다양한 속도상수는 대기 중 니트로사민의 생성과 소멸이 복잡한 메커니즘을 통해 이루어지며, 여러 환경 조건에 따라 그 중요도가 달라질 수 있음을 보여준다.
Hutchings et al. (2010)에서는 액체상에서의 질산화반응과 기-액 분배가 액체상의 NDMA 생성에 미치는 영향을 규명하기 위해 실측과 박스모델 연구를 수행했다. 이를 위해 먼저 안개에서의 NDMA 농도 실측은 Caltech Active Strand Cloudwater Collector를 이용하여 애리조나 주 Flagstaff, 캘리포니아 주 Fresno, 그리고 펜실베니아 주 Selinsgrove에서 복사안개 (radiation fog)와 구름수 시료를 채취하여 수행하였다. 펜실베니아 주의 Selinsgrove 지역에서 채취한 3개의 시료에서는 242~497 ng/L의 비교적 높은 농도가 검출되었으며, 같은 지역의 현장 바탕시료에서도 136 ng/L의 NDMA가 검출되었다 (Hutchings et al., 2010). 애리조나 주 Flagstaff의 Mt. Elden에서 채취한 2개의 시료에서는 153~208 ng/L 범위의 농도가 관찰되었다 (Hutchings et al., 2010). 캘리포니아 주의 Fresno 지역은 여러 해에 걸쳐 시료를 채취하였는데, 2004년에는 240 ng/L (10개 시료), 2006년에는 130~397 ng/L (4개 시료)로 비슷한 수준을 유지하다가 2010년에는 7.5~35.3 ng/L (9개 시료)로 크게 감소하였다 (Hutchings et al., 2010). 기체상 시료의 경우 실험실에서 제작한 기체 샘플러를 사용하여 0.55 L/min의 유량으로 공기를 채취하였으며, 코코넛 활성탄이 충진된 고체상 추출 카트리지 (coconut charcoal SPE cartridge)를 통과시켜 NDMA를 포집하였다. Fresno 지역의 경우 2010년에 측정된 기체상 농도 (8.4 ng/m3)와 비교할 때 액체상에서의 농도가 상대적으로 높은 수준임을 알 수 있으며 (Hutchings et al., 2010), 대기 중 NDMA가 수분에 잘 용해되는 특성을 가지고 있음을 시사한다.
Hutchings et al. (2010)에서는 실험을 통해 구름에서 아질산에 의한 디메틸아민의 니트로화 반응과 수용액 상에서 광분해를 통한 NDMA의 잠재적 분해를 모사하고자 하였다. NDMA 생성 반응 모사를 위한 실험에서는 아질산과 디메틸아민의 액체상 반응을 통한 NDMA 생성을 연구하였는데, 이를 위해 다양한 농도의 아질산 (HNO2)과 디메틸아민 ((CH4)2NH) 용액을 조제하여 빛이 차단된 갈색 바이알에 보관하였다. 또 용액의 pH와 아질산나트륨 (NaNO2)의 농도를 조절하였고, 주야를 모사하기 위해 명/암 조건에서 NDMA의 생성 수율을 확인하였다. 실험 결과에 따르면 액체상에서의 NDMA 생성 수율이 매우 낮아 (<1%) 액체상에서 관측된 NDMA의 농도를 설명하는 데 한계가 있었다고 Hutching et al. (2010)에서 밝히고 있다.
실험 결과를 종합한 박스모델 계산 결과에서는 기체상에서 NDMA가 생성된 후 액적으로 유입되는 과 정이 액체상 NDMA 생성의 주요 경로임을 확인하였다 (Hutchings et al., 2010). 모델링 연구에서는 초기 디메틸아민 농도를 1~25 ppt로, HONO 최대 농도를 1~4 ppb로 변화시키면서 민감도 분석을 수행하였는데, NDMA 농도가 디메틸아민의 초기 농도에 비례하여 증가하는 것을 발견하였다 (Hutchings et al., 2010). 특히 디메틸아민 10 ppt와 HONO 4 ppb 조건에서는 액체상 NDMA 농도가 약 220 ng/L까지 도달하였으며, 이는 현장 관측 결과와도 잘 일치하였다 (Hutchings et al., 2010). 이 연구에서는 측정과 모델 계산을 통해 NDMA가 최종적으로는 광분해되지만, 일출과 일몰 시간대에는 수 시간 동안 대기 중에 존재할 수 있음을 보여주었다. 이는 액체상에서의 광분해가 기 체상에서보다 낮기 때문으로 해석된다. 또한 안개 조건에서의 모델링을 통해 NDMA가 오전 10시경까지도 20 ng/L 이상의 농도로 유지될 수 있음을 확인하였으며 주간에도 상당량의 안개가 존재할 경우 NDMA의 광분해가 감소될 수 있다는 점을 시사하였다. HONO의 일변화도 NDMA 농도에 큰 영향을 미쳤는데, HONO 농도가 오전 6시와 오후 6시에 최대가 되는 조건에서 NDMA 농도도 함께 증가하는 경향을 보였다. 이러한 결과들은 안개나 구름의 존재가 NDMA의 체류시간을 크게 연장시킬 수 있음을 보여주었다. 특히 액체상에서의 낮은 광분해율과 기체상 생성-분배 과정의 중요성은 대기질 관리에 있어 중요한 시사점을 제공하였다.
대기 중 니트로사민은 오존화 반응을 통해서도 생성된다 (Choi et al., 2024b). 오존화 반응은 대기 중에서 아민류와 오존이 반응하여 다양한 질소 화합물을 생성하는 과정을 의미한다. 표 4에 제시된 O1 반응에서 보듯이, 디메틸아민이 오존과 반응하여 히드록실아민 (NH2OH)을 생성하며, 이 반응의 속도상수는 3.6·102 M-1 sec-1로 비교적 빠른 반응속도를 보인다. O2 반응에서는 암모니아 (NH3)가 오존과 반응하여 히드록실아민을 생성하며, 이 반응의 속도상수는 20.4 M-1 sec-1이다. O3 반응에서는 생성된 히드록실아민이 이민 ((CH2)=NH2)과 반응하여 히드라진 유도체 ((CH2)2NNH2)를 형성하며, 이 반응은 51.1 M-1 sec-1의 속도상수를 가진다. O4와 O5 반응은 디메틸히드라진 ((CH3)2NNH2)이 오존과 반응하여 NDMA을 생성하는 과정을 보여주는데, 특히 O4 반응은 0.3 M-1 sec-1로 가장 느린 반응속도를, O5 반응은 3.8·102 M-1 sec-1로 빠른 반응속도를 나타낸다.
액체상 오존화 반응 연구 결과들을 종합하면, DMA의 니트로화 과정에서 발생하는 NDMA 생성 수율은 매우 낮은 것으로 나타났다. Andrzejewski et al. (2008)의 연구에 따르면 일반적인 조건에서는 약 0.03%의 낮은 수율을 보였으나, pH 10의 강염기성 조건에서 오존과 DMA의 농도비 (O3/DMA)가 2.769를 초과하는 고농도 오존 조건에서는 NDMA 생성이 상당한 수준으로 증가하는 것을 확인하였다. Andrzejewski et al. (2008)의 연구에 따르면, 오존화 과정에서 수산화 라디칼이 NDMA 생성에 중요한 역할을 할 수 있으며, 특히 염기성 조건에서 그 영향이 더욱 큰 것으로 나타났다. 수산화 라디칼은 염기성 조건에서 수산화 이온에 의해 가속화되는 오존의 분해 과정을 통해 쉽게 형성되는데, 이로 인해 더 많은 DMA가 아질산염과 다른 질소 함유 생성물로 분해될 수 있다. 특히 아질산은 수산화 라디칼에 의해 매우 빠른 속도 (k=1.0±0.1×1010 M-1 s-1)로 산화될 수 있는 것으로 확인되었다. Yang et al. (2009)에서는 오존과 디메틸아민 농도 조건이 NDMA 생성에 미치는 영향을 Andrzejewski et al. (2008)의 결과를 바탕으로 분석하였는데, 오존/DMA 비율이 증가할수록 NDMA 수율이 증가하고 특히 pH 8 이상의 조건에서는 NDMA 생성이 급격히 증가한다는 연구 결과를 보였다. 이러한 연구 결과들은 대기 중 수분이 존재하고 비교적 염기성 조건에서 오존의 대기 중 농도가 높을 때 오존화 반응을 통한 NDMA 생성 메커니즘을 이해하는 데도 중요한 기초 자료를 제공하였다.
4. 대기 니트로(소)화합물 생성 반응 박스모델 적용 결과
Choi et al. (2021)에서는 대기 중 니트로(소)화합물의 생성에 기여하는 다양한 반응 경로의 상대적 중요성을 평가하기 위해, 기체상 반응, 질산화 반응과 그리고 기체상과 액체상 사이의 상변화를 고려한 박스모델을 고안하였고, 실측과 박스모델링 결과를 비교하여 대기화학반응이 니트로(소)화합물 생성에 기여하는 바를 정량하였다. Choi et al. (2024b)에서는 오존화 반응을 박스모델에 추가하여 모델의 성능을 개선하고자 하였다. 이들 연구에서 고려한 반응 메커니즘과 반응속도 상수는 이전 챔버 연구들에서 도출된 것을 활용하였다 (표 4). 박스모델을 사용하여 대기 반응을 통한 니트로사민 가운데 NDMA와 니트라민 가운데 DMN의 생성 농도를 정량적으로 계산하였으며, 다양한 환경 조건에서의 민감도 분석을 실시하였다. 이 두 성분을 대상으로 한 것은 대기화학반응의 과정과 특성에 대한 연구가 다른 니트로(소)화합물보다 비교적 많이 수행되었기 때문이다. 박스모델의 시간 적분은 MATLAB의 상미분방정식 (Ordinary Differential Equation, ODE) 15s 선형 다단계 방법을 적용하였다.
여러 변수 가운데 측정이 힘든 변수는 민감도 분석을 수행하였다. 기체상 디메틸아민의 농도를 10~30 ppt 범위에서 변화시켰을 때 NDMA와 DMN의 예측 농도는 0.1% 미만의 극히 미미한 변화만을 나타냈다. 이러한 결과는 기체상에서의 반응과 기-액 간 물질전달이 이들 화합물의 최종 농도 결정에 크게 기여하지 않을 수 있음을 의미한다. 또한 에어로졸의 물리적 특성을 대표하는 반경을 1.25~2.5 μm 범위에서 변화시키고, 화학적 특성을 대표하는 pH를 1~5 범위에서 변화시켰을 때도 예측 농도의 변화는 1% 미만으로 매우 제한적이었다. 이러한 계산 결과는 이들 변수가 대기 니트로(소)화합물 생성에 중요한 변수가 아닐 가능성이 크며, 입자상 니트로(소)화합물의 생성에 있어 액체상 반응이 지배적인 역할을 할 수 있음을 의미한다. 에어로졸의 수분함량 (Liquid water content, LWC)이 입자상 니트로(소)화합물의 농도에 미치는 영향은 상당히 큰 것으로 나타나 이를 중점적으로 파악하였다 (Choi et al., 2024b, 2022).
4. 1 액체상 반응에서 에어로졸 수분함량 영향
Choi et al. (2022)에서는 에어로졸의 수분함량이 입자상 니트로(소)화합물의 농도 증가에 영향을 끼칠 수 있다는 것을 서울과 서산에서의 입자상 니트로(소)화합물의 농도 추이를 활용하여 설명하였다. 서산의 총 니트로사민 (12.48±16.12 ng/m3)과 니트라민 (0.65±0.71 ng/m3) 농도는 서울 (니트로사민: 7.41±13.59 ng/m3, 니트라민: 0.24±0.15 ng/m3)보다 높게 나타났는데, 이는 서산의 높은 상대습도 (75±9%)와 자유 암모니아 (0.13±0.09 μmol/m3) 및 총 질산 (0.09±0.07 μmol/m3) 농도로 인해 에어로졸의 수분함량 (12.92±9.77 μg/m3)이 서울 (6.20±5.35 μg/m3)보다 높았기 때문으로 분석되었다. 특히 서산에서는 에어로졸의 수분함량이 10 μg/m3 이상일 때만 30 ng/m3 이상의 높은 니트로사민 농도가 관찰되었으며, 박스모델을 통한 NDMA 생성 농도 예측 결과와 실측 농도 간의 높은 상관성 (R=0.77)은 액체상 반응이 서산의 니트로사민 농도 증가에 주요하게 기여했음을 시사하였다. 반면 서울에서는 NDMA 예측 농도와 실측 농도 간의 상관성이 낮았는데 (R=0.41), 이는 서울의 경우 1차 배출원의 영향이 더 크게 작용했기 때문으로 해석되었다. 또한 기체상에서 입자상으로의 물질 전달이 니트로사민과 니트라민의 농도에 미치는 영향은 서울과 서산 모두에서 미미한 것으로 나타났다. 이러한 결과 들은 높은 상대습도와 자유 암모니아, 총 질산에 의해 증가된 에어로졸의 수분함량이 입자상 니트로사민의 액체상 반응을 촉진시켜 대기 중 농도 증가를 야기할 수 있음을 보여준다. 반면 니트라민은 니트로사민과는 다른 양상을 보였는데, 서산과 서울 모두에서 에어로졸의 수분함량과의 상관성이 낮게 나타났다. 박스 모델을 통해 액체상 에어로졸반응을 통해 DMN이 생성되었을 예측 농도값과 실측값의 상관관계 역시 서울 (R=0.24)과 서산 (R=0.09) 모두에서 매우 낮았으며, 이는 액체상 에어로졸 반응이 니트라민 농도에 큰 영향을 미치지 않았음을 의미한다 (Choi et al., 2021). Choi et al. (2022)에서는 니트라민이 니트로사민과 유사한 화학 구조를 가지고 있음에도 불구하고, 연구기간 동안 니트라민은 니트로사민과 달리 주로 1차 배 출원에서 배출되는 것으로 추정했다. 다만 니트라민의 1차 배출원이 니트로사민과는 다를 수 있으므로 이에 대한 추가 연구가 필요하다.
2018년부터 2019년까지 서울 대기에서 측정한 입자상 니트로사민의 농도와 에어로졸의 수분함량 (LWC) 사이의 상관관계는 계절에 따라 뚜렷한 차이를 보였다 (그림 3). 2018년 겨울철의 경우 가장 강한양의 상관관계 (R2=0.589)를 나타냈으며, LWC가 증가함에 따라 니트로사민 농도가 증가하는 경향을 보였다. 특히 LWC가 200 μg/m3에 근접할 때 니트로사민의 총 농도는 최대 60 ng/m3까지 상승하는 것으로 관찰되었다. 2018년 봄철에도 유사한 양의 상관관계가 관찰되었으나 (R2=0.1796), 에어로졸의 수분함량 증가에 따른 니트로사민 농도 상승이 겨울철에 비해 상대적으로 약했다. 반면 2018년 여름철의 경우 다른 계절과는 달리 에어로졸의 수분함량과 니트로사민 농도 사이에 뚜렷한 상관관계가 나타나지 않았다 (R2=0.0054). 이는 여름철의 낮은 에어로졸의 수분함량과 함께, 높은 기온으로 인한 입자상에서 기체상으로의 분배 증가가 영향을 미쳤을 것으로 추정된다. 2018년 가을철에는 다시 양의 상관관계가 관찰되었으며 (R2=0.2493), 에어로졸의 수분함량 증가에 따른 니트로사민 농도 상승 효과가 가장 크게 나타났다 (기울기=0.7621). 특히 에어로졸의 수분함량이 50 μg/m3를 초과할 때 니트로사민 농도가 120 ng/m3 이상으로 급격히 상승하는 사례도 관찰되었다. 2019년의 경우, 봄철 (R2=0.1023)과 가을철 (R2=0.1867) 모두 에어로졸의 수분함량과 입자상 니트로사민 농도의 완만한 양의 상관관계를 보였다. 이러한 결과는 에어로졸의 수분함량이 대기 중 입자상 니트로사민의 농도에 중요한 영향을 미치는 요인임을 시사한다. 수분함량이 증가할수록 에어로졸 입자가 제공하는 액체상 반응 환경이 확대되어 기체상 전구물질의 액체상으로의 상변화와 후속 액체상 에어로졸 반응을 촉진하고, 이는 결과적으로 입자상 니트로사민의 생성을 증가시키는 것으로 해석된다. 다만 2018년도 여름철과 같이 기온이 높고 에어로졸의 수분함량이 낮은 조건에서는 이러한 효과가 제한적일 수 있을 것으로 판단된다.
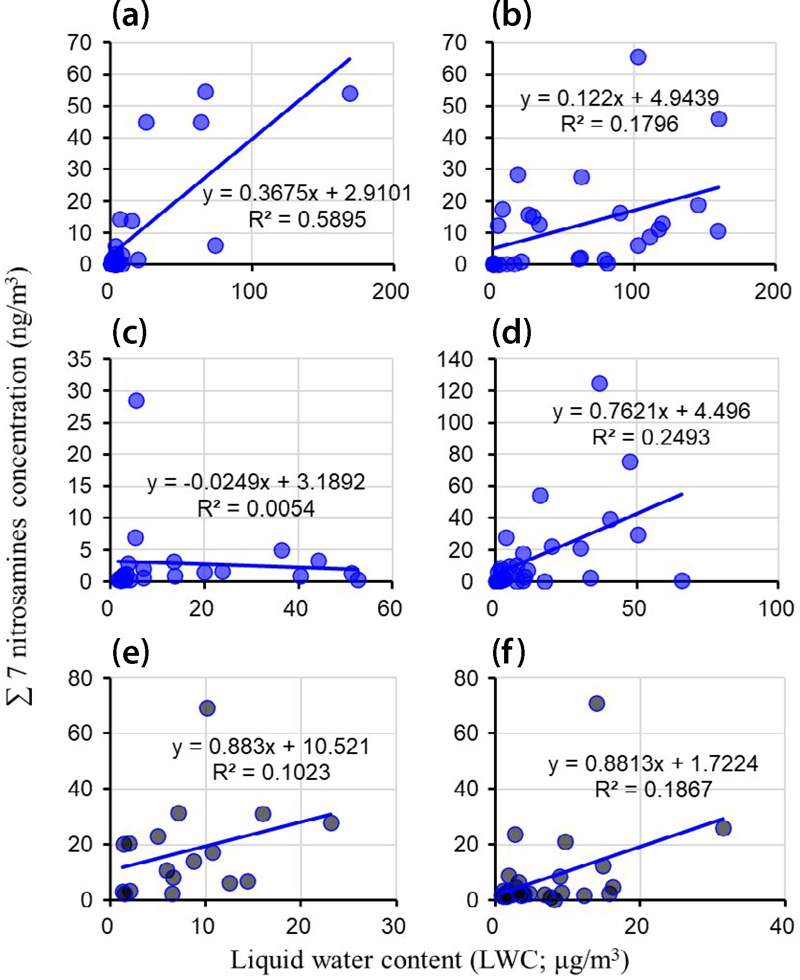
Correlation of the sum concentration of 7 nitrosamines (NDMA, NDEA, NDPA, NDBA, NPIP, NPYR, NMOR) with LWC during (a) winter 2018 (Choi et al., 2020b), (b) spring 2018 (Choi et al., 2021), (c) summer 2018 (Choi et al., 2021), (d) autumn 2018 (Choi et al., 2021), (e) spring 2019 (Choi et al., 2022), and (f) autumn 2019 (Choi et al., 2022) in Seoul, South Korea.
한편 2018년부터 2019년까지 서울에서 측정한 니트라민의 농도와 에어로졸의 수분함량 사이의 상관관계를 분석한 결과 (그림 4), 니트로사민과는 다른 경향을 보였다. 2018년 겨울철 (R2=0.0818)과 봄철 (R2=0.0033)에는 매우 약한 상관관계를 나타냈으며, 여름철에도 낮은 상관성 (R2=0.0289)을 보였다. 2018년 가을철에는 상대적으로 높은 상관계수 (R2=0.1641)를 보였으나, 동일 샘플링 기간 동안 에어로졸의 수분함량과 니트로사민 농도의 상관계수보다 작았다. 또 2019년의 경우 봄철 (R2=0.1766)에는 약한 양의 상관관계를, 가을철 (R2=0.0511)에는 오히려 약한 음의 상관관계를 나타냈다. 이러한 결과는 Choi et al. (2022)에서 밝힌 바와 같이 니트라민이 니트로사민과 달리 에어로졸의 수분함량 변화에 크게 영향을 받지 않으며, 이 기간 동안의 니트라민의 대기 중 농도는 주로 1차 배출에 의해 결정됨을 시사하는 것으로 판단된다.
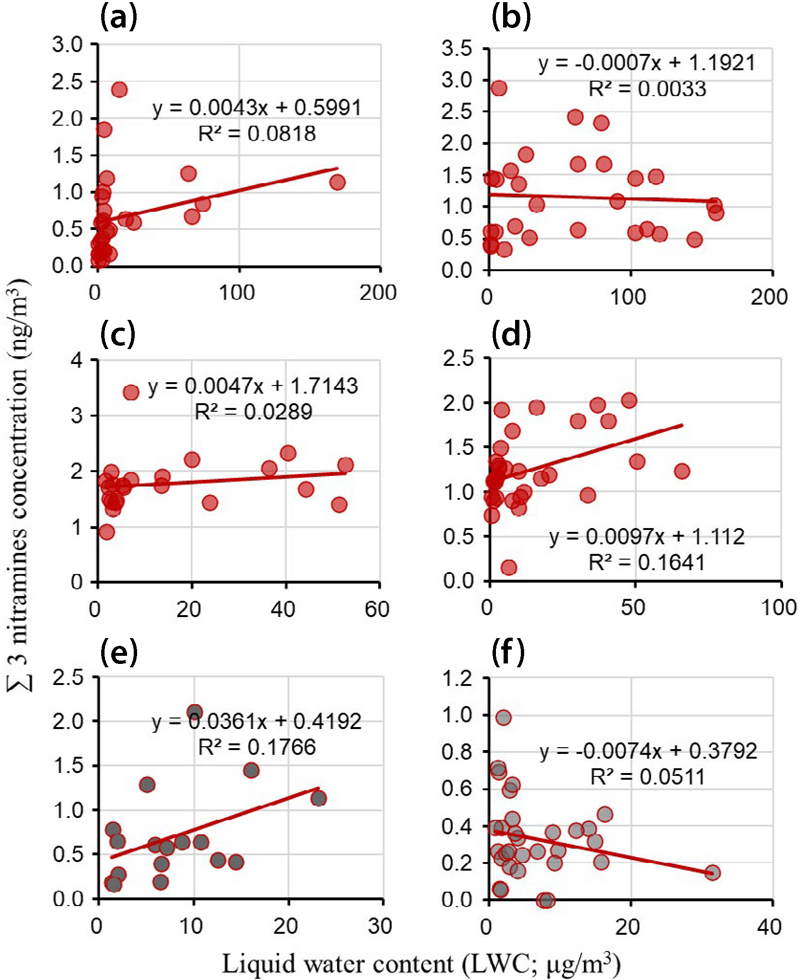
Correlation of the sum concentration of 3 nitramines (MN, DMN, DEN) with LWC during (a) winter 2018 (Choi et al., 2020b), (b) spring 2018 (Choi et al., 2021), (c) summer 2018 (Choi et al., 2021), (d) autumn 2018 (Choi et al., 2021), (e) spring 2019 (Choi et al., 2022), and (f) autumn 2019 (Choi et al., 2022) in Seoul, South Korea.
4. 2 질산화반응
입자상 니트로(소)화합물의 생성에 질소산화물의 역할이 중요할 수 있다고 여러 이전 연구에서 밝히고 있다 (Choi et al., 2022, 2021, 2020b, 2018; Ge et al., 2011; Nielsen et al., 2011). 먼저 Choi et al. (2018)에서는 2013~2014년에 겨울과 여름, 밤과 낮으로 구분하여 초미세먼지를 채취하여 분석하였으며, 서울에서 분석된 입자상 총 5종의 니트로사민 농도 (Nitrosomethylethylamine (NMEA), NDEA, NPYR, NPIP, NDBA)의 합이 NO2와 매우 높은 상관관계를 보인다는 사실을 보였다 (R=0.759).
이후 박스모델을 통해 입자상 니트로(소)화합물을 생성하는 대기화학반응의 기여를 규명하는 연구 (Choi et al., 2021)에서도 대기 중 입자상 니트로(소) 화합물의 생성에 질소산화물이 주요한 역할을 할 수 있다는 사실을 규명하였다. 특히 겨울철의 경우, NO2 농도가 높았으며 이에 따라 NDMA와 DMN을 생성하는 대기화학반응의 기여도가 각각 54%와 63%로 크게 증가하였다 (Choi et al., 2021). 이는 NO2가 N2O3와 N2O4 형성의 핵심 전구물질로 작용하기 때문인데, 실제로 NO2 농도와 디메틸아민의 농도가 동시에 증가한 겨울철에 니트로아민류의 농도가 현저히 증가하는 것이 관찰되었다. 반면 NO2 농도가 낮았던 여름철의 경우, 디메틸아민의 농도가 증가하더라도 니트로아민류의 농도 증가가 제한적이었다. 이러한 결과는 니트로아민류의 대기화학반응을 통한 2차 생성에 있어 NO2 농도가 제한 인자로 작용함을 보여준다.
NDMA는 N2O3와 N2O4 반응 모두를 통해 생성되는데, NO 농도 증가는 NO와 NO2의 반응을 통한 N2O3 생성 (NO+NO2 ⇄ N2O3)을 촉진시켜 NDMA 형성에 긍정적인 영향을 미친다. 이렇게 생성된 N2O3는 수용액 상에서 디메틸아민과 반응하여 NDMA를 생성한 다 ((CH3)2NH2+N2O3 → (CH3)2NNO+HONO). 또한 NDMA는 N2O4 경로를 통해서도 생성될 수 있어 (NO2+NO2 ⇄ N2O4, (CH3)2NH2+N2O4 → 0.4(CH3)2 NNO+0.4(CH3)2NNO2+0.2CH3NHCH2+0.4HON O+0.4HNO3), 다중 생성 경로를 가지고 있다. 반면 DMN은 주로 NO2의 자체 반응으로 생성되는 N2O4 를 통한 반응으로만 생성되기 때문에 NO 농도 변화의 영향을 거의 받지 않는다. 즉, DMN의 주요 생성 경로는 NO2의 반응을 통한 N2O4 형성 (NO2+NO2 ⇄ N2O4)과 이후 디메틸아민과의 반응으로 제한되어 있어, NO 농도 증가가 DMN 생성에 직접적인 영향을 미치지 않는다.
또한 NO 농도 증가는 (CH3)2N 라디칼의 정상상태 농도에도 영향을 미친다. 대기 중에서 (CH3)2N 라디칼은 디메틸아민과 OH 라디칼의 반응 ((CH3)2NH+OH → (CH3)2N•)으로 생성되며, NO와 NO2와의 반응 ((CH3)2N•+NO → (CH3)2NNO, ((CH3)2N•+NO2 → (CH3)2NNO2)을 통해 소멸된다. NO 농도가 증가하면 (CH3)2N 라디칼과 NO의 반응이 촉진되어 (CH3)2N 라디칼의 정상상태 농도가 감소하게 된다. NDMA의 경우 이러한 라디칼 농도 감소에도 불구하고, 앞서 설명한 N2O3 생성 촉진 효과가 이를 상쇄하여 전체적으로는 농도가 증가하게 된다. 그러나 DMN은 N2O3 경로를 통한 생성 메커니즘이 없기 때문에, (CH3)2N 라디칼 농도 감소를 보완할 수 있는 대체 경로가 없어 NO 농도 증가에 따른 영향이 미미한 것으로 나타났다.
그림 5는 이전 연구에서 제시한 입자상 니트로사민 및 니트라민의 농도 합과 NO2, NO 농도 사이의 상관 관계를 정리한 그림이다 (Choi et al., 2022, 2021). 시계열 분석 결과, 총 니트로사민과 니트라민 농도는 질소산화물과의 상관관계에서 뚜렷한 계절적 변동성을 보였다. 니트로사민의 경우 (그림 5(a)), 2018년 동절기에 NO2(R2=0.73)와 NO (R2=0.83) 모두 강한 양의 상관관계를 나타내어, 이 기간 동안 NOx가 니트로사민 생성에 주요한 기여 인자로 작용했음을 시사한다. 계절 변화에 따른 상관관계의 패턴 분석 결과, NO와의 상관성은 2018년 봄철부터 급격히 감소하여 0.17 수준으로 저하되었으며, 하절기에는 상관계수가 0.04로 NO와 니트로사민과의 상관관계가 거의 없었다. 반면 NO2의 경우 상대적으로 안정적인 상관성을 유지하여 대체로 0.5~0.7 범위의 양의 상관계수를 나타냈으나, 2019년 봄철에는 0.36으로 다소 낮은 값을 보였다. 니트라민의 경우, NO2와의 상관관계는 2018년 동절기에 0.64로 강한 양의 상관관계를 보였으나, 봄철과 하절기에는 각각 -0.15와 -0.09로 상관성이 크게 감소하였다. NO와의 상관관계 역시 계절적 변동이 관찰되어, 2018년 동절기의 0.42에서 하절기에는 -0.17로 감소하였다. 2019년의 경우, NO2와의 상관계수는 봄철 0.26, 가을철 0.15로 비교적 낮은 값을 유지했으며, NO와의 상관계수 또한 봄철 -0.11, 가을철 0.34로 변동성을 보였다.
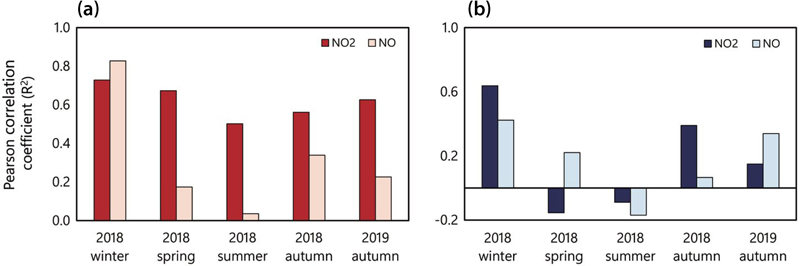
Pearson correlation coefficient (R2) between concentrations of (a) total nitrosamines and (b) total nitramines with NO2 and NO during 2018 to 2019 in Seoul, South Korea reported in the previous studies (Choi et al., 2022, 2021).
니트라민의 경우 (그림 5(b)), 2018년 동절기에 나타난 NO와 NO2의 높은 양의 상관계수는 이 시기에 질소산화물을 통한 니트라민 생성이 활발했음을 시사한다. 특히 NO2와의 더 강한 상관관계 (R2=0.64)는 NO2를 통한 니트라민 생성 경로가 NO의 반응을 통한 생성 경로 (R2=0.42)보다 상대적으로 더 중요하게 작용했음을 나타낸다. 그러나 봄철과 하절기에는 NO2와 NO 모두와의 상관계수가 급격히 감소하거나 음의 값을 보이는 현상은 질소산화물을 통한 니트라민 생성 경로의 중요성이 감소하고, 다른 생성 경로들의 영향력이 상대적으로 증가했거나 일차 배출원의 중요성이 증가했을 가능성을 시사한다. 2019년 봄철과 가을철에 관찰된 니트라민과 NOx 사이의 전반적으로 낮은 상관계수는 이 시기에 질소산화물의 반응외의 다른 요인들이 니트라민 생성에 더 큰 영향을 미쳤을 수 있음을 나타낸다.
앞서 설명된 니트로사민과 니트라민의 생성 메커니즘을 고려할 때, 관찰된 계절적 상관관계의 변동성은 다음과 같이 해석될 수 있다. 2018년 동절기에 나타난 NO와 NO2의 높은 상관계수는 이 시기에 N2O3와 N2O4 두 경로 모두를 통한 니트로사민과 니트라민의 생성이 활발했음을 시사한다. 특히 NO와 니트로사민의 농도 사이의 강한 상관관계 (R2=0.83)는 NO+NO2 ⇄ N2O3 반응을 통한 N2O3 생성 경로가 중요하게 작용했음을 나타낸다. 반대로 같은 기간 동안의 니트라민과 NO2의 상관관계는 NO보다 높았는데, 이를 통해 볼 때 니트로사민과 니트라민을 생성하는 NOx의 반응이 상이하다는 사실을 유추할 수 있다. 2018년도 하절기에는 니트로사민과 니트라민의 농도와 NOx 농도 사이의 상관계수가 급격히 감소하는 현상은 NOx의 반응을 통한 니트로사민과 니트라민의 생성보다는 다른 생성 경로와 일차 배출원의 역할이 더 중요해졌을 가능성을 시사한다.
4. 3 오존화 반응
Choi et al. (2024b)에서는 대기 중 입자상 니트로사민의 생성에 있어 오존의 역할을 규명하기 위해 2018년 서울에서 측정된 NDMA 농도와 O3/DMA 비율 사이의 상관관계를 분석하였다. 이전 연구들에서는 수용액상에서 O3/DMA 비율이 증가함에 따라 NDMA의 생성이 증가한다고 보고된 바 있으나, 2018년 서울의 대기 중 NDMA 농도는 O3/DMA 비율과 음의 상관관계를 보이거나 상관성이 없는 것으로 나타났다. 이는 오존 농도가 NDMA 생성에 크게 영향을 미치지 않았음을 시사하며, Song et al. (2022)이 보고한 낮은 오존화 수율과도 일치하는 결과이다. 또한 NDMA와 O3/DMA 비율 간의 음의 상관관계는 Choi et al. (2021)이 제시한 바와 같이 액체상 에어로졸에서의 질산화 반응이 여전히 NDMA 생성의 주된 경로임을 시사한다.
박스모델을 이용한 정량적 분석 결과, 오존화 반응의 NDMA 생성 기여도는 계절에 따라 차이를 보였다. 여름철 (10.0±0.77%)과 겨울철 (7.9±3.8%)에 상 대적으로 높은 기여도를 보였으며, 봄철 (1.9±3.0%)과 가을철 (3.6±7.3%)에는 낮은 기여도를 나타냈다. 특히 여름철의 높은 기여도는 다른 계절에 비해 높은 O3/NOx 비율 (1.63±0.69; 겨울 0.64±0.52; 봄 1.14±0.92; 가을 0.52±0.54)에 기인한 것으로 판단된다. 반면 여름철의 낮은 pH (2.2±0.4; 겨울 5.3±1.2; 봄 3.9±1.2; 가을 3.9±0.7)는 질산화 반응을 저해하는 요인으로 작용했을 것으로 추정된다.
오존화 반응을 포함한 박스모델의 예측값은 기존 모델에 비해 측정값과의 일치도가 개선되었으나 (연간 33.8% → 41.1%; Choi et al., 2024b), 여전히 상당한 차이가 존재한다. 이는 1차 배출원의 영향이나 아직 규명되지 않은 반응 경로가 존재할 가능성을 시사하며, 이에 대한 추가적인 연구가 필요하다. 특히 NH2OH, unsymmetrical dimethylhydrazine (UDMH, (CH3)2NNH2)과 같은 중간생성물에 대한 분석이 수행되지 않아 오존화 반응의 기여도를 직접적으로 검 증하는 데 제한이 있었으므로, 향후 이들 중간생성물의 분석을 통한 오존화 반응 경로의 검증이 요구된다.
2018년부터 2019년까지 서울에서 측정된 입자상 니트로사민 및 니트라민과 오존 농도 사이의 상관관계를 그림 6과 7에서 각각 분석한 결과, 계절별로 뚜렷한 차이를 보였다. 니트로사민의 경우 (그림 6, 2018년 겨울철에는 오존 농도가 증가함에 따라 니트로사민 농도가 감소하는 뚜렷한 음의 상관관계 (R2=0.28)가 관찰되었다. 봄철에도 유사한 음의 상관관계를 보였으나 (R2=0.04), 그 강도는 겨울철보다 약 했다. 이러한 니트로사민과 O3 농도 사이의 음의 상관관계는 오존화 반응에 따른 니트로사민의 생성 영향이 다른 반응 경로보다 미미하였다는 것을 의미한다. 다만 같은 기간 동안 NOx와 니트로사민의 농도가 양의 상관관계를 보였기 때문에, 이러한 경향은 NOx의 농도가 포화되었을 때 나타나는 NOx 적정반응에 의해 NOx와 O3 농도 사이의 음의 상관관계에서 기인하였을 가능성이 있다 (Choi et al., 2024b). 여름철의 경우 매우 약한 양의 상관관계 (R2=0.01)가 관찰되었는데, 이는 높은 O3/NOx 비율로 인한 오존화 반응의 기여도 증가를 반영하는 것으로 해석된다. 가을철에는 다시 음의 상관관계 (R2=0.08)를 보였다. 2019년에는 계절적 패턴이 다소 변화하여, 봄철에 뚜렷한 양의 상관관계 (R2=0.41)를 보였으며, 가을철에도 약한 양의 상관관계 (R2=0.06)가 관찰되었다.
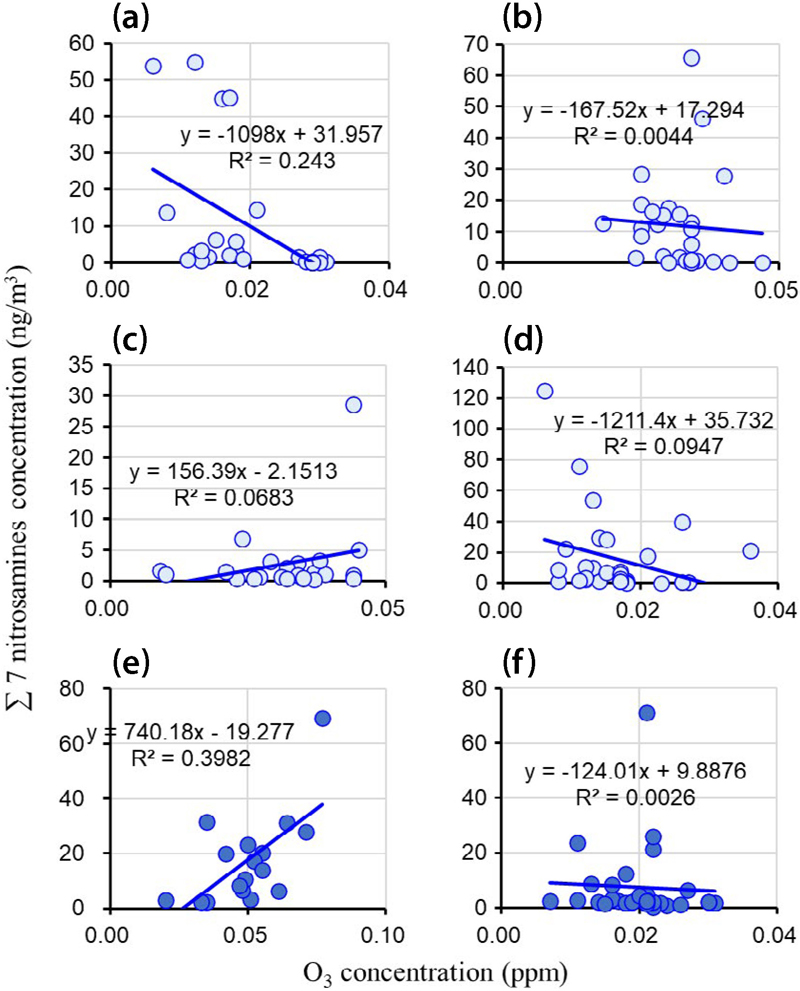
Correlation of the sum concentration of 7 nitrosamines (NDMA, NDEA, NDPA, NDBA, NPIP, NPYR, NMOR) with O3 concentration during (a) winter 2018 (Choi et al., 2020b), (b) spring 2018 (Choi et al., 2021), (c) summer 2018 (Choi et al., 2021), (d) autumn 2018 (Choi et al., 2021), (e) spring 2019 (Choi et al., 2022), and (f) autumn 2019 (Choi et al., 2022) in Seoul, South Korea.
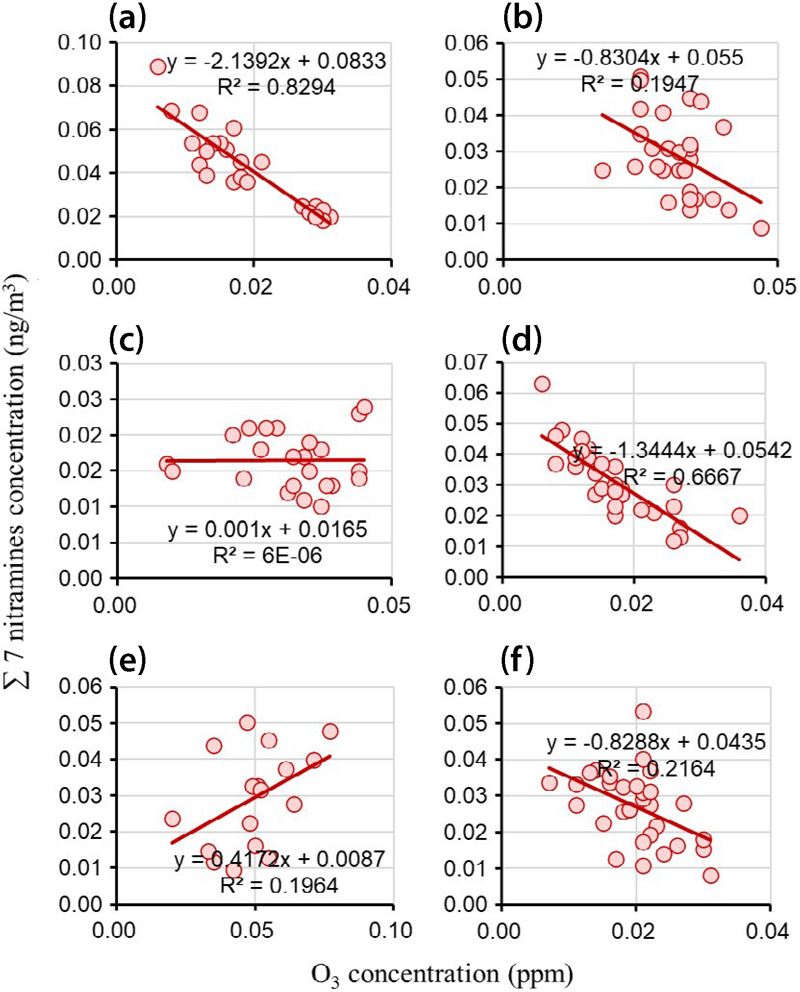
Correlation of the sum concentration of 3 nitramines (MN, DMN, DEN) with O3 concentration during (a) winter 2018 (Choi et al., 2020b), (b) spring 2018 (Choi et al., 2021), (c) summer 2018 (Choi et al., 2021), (d) autumn 2018 (Choi et al., 2021), (e) spring 2019 (Choi et al., 2022), and (f) autumn 2019 (Choi et al., 2022) in Seoul, South Korea.
한편, 니트라민과 오존의 상관관계 (그림 7)는 니트로사민과는 다소 다른 양상을 보였다. 2018년 겨울철에는 강한 음의 상관관계 (R2=0.83)가 관찰되었으며, 봄철에도 유사한 음의 상관관계 (R2=0.71)를 유지했다. 여름철과 가을철에는 상관성이 크게 감소하여, 각각 R2=0.02와 R2=0.09의 약한 상관관계를 보였다. 2019년에도 봄철 (R2=0.37)과 가을철 (R2=0.72) 모두 음의 상관관계를 나타냈다. 이러한 결과는 니트라민의 생성이 오존 농도 변화에 대해 니트로사민과는 다른 메커니즘으로 반응함을 시사하며, 특히 겨울철과 봄철에 오존이 니트라민 생성을 억제하는 역할을 할 수 있음을 보여준다. 또 마찬가지로 이러한 음의 상관관계는 NOx 농도 포화 시 NOx 적정반응에 의해 O3와 NOx 사이의 음의 상관관계를 보이는 데에서 기인했을 가능성도 배제할 수 없다 (Choi et al., 2024b).
5. 대기 중 니트로(소)화합물에 의한 건강 영향
Mai and Kim (2024)에서는 춘천에서 2021~2022년에 측정한 PM2.5와 기체상 니트로사민의 흡입 노출로 인한 암 발생 위험도를 계절별, 연령대별로 평가하였다. 입자상 니트로사민의 경우, 여름철 영아와 아동 그룹을 제외한 모든 계절과 연령대에서 세계보건기구 (World Health Organization, WHO)의 허용 가능 위험도 기준인 백만 명당 1명을 초과하였다. 겨울철에는 24시간 노출을 가정하였을 때 성인 백만 명당 16명, 영아 6명, 아동 4명의 초과 암 발생이 예측되었으며, 가을철 (성인 8명)과 봄철 (성인 9명)에도 상당한 위험도를 보였다. 반면 여름철은 성인의 경우 백만 명당 2명으로 상대적으로 낮은 수준을 나타냈다. 기체상 니트로사민의 발암 위험도는 더욱 심각한 수준으로, PM2.5 내 니트로사민보다 4~6배 높게 나타났다. 특히 겨울철 성인의 경우 백만 명당 92명이었으며, 봄철 52명, 가을철 39명, 여름철 10명으로 계절적 변동이 뚜렷했다. 모든 계절에서 성인이 가장 높은 위험도를 보였는데, 이는 장기간 노출에 기인한 것으로 분석된다. 이 연구에서는 영아의 경우 주요 장기가 발달 중이어서 환경 변화에 더욱 취약할 수 있으며, 아동의 경우 활발한 신체 활동으로 인해 실제 노출 정도가 더 높을 수 있다는 점을 지적하였다. 이러한 취약 연령대의 특성을 고려할 때, 측정된 수치 이상의 잠재적 위험이 존재할 수 있음을 강조하였다.
Farren et al. (2015)에서는 영국 North Kensington 에서 2012년도 겨울철과 여름철에 채취한 PM2.5 내 입자상 니트로사민으로부터 기인하는 인체위해성을 평가하였다. 대기 중 니트로사민 노출로 인한 암 발생 위험도를 연령대별로 평가한 결과, 성인 (21~70세)에 서 가장 높은 위험도가 관찰되었다. 모든 노출 시나리오에서 미국 환경보호청 (US EPA)의 무시 가능 위험도 기준인 백만 명당 1명을 초과하였으며, 특히 여름철에는 실외 공기에 4시간 노출 시, 겨울철에는 6시간 노출 시 미국 환경보호청의 최소 발암 위험도 기준인 백만 명당 10명을 초과하였다. 1~6세와 6~21세 연령군의 경우, 겨울철과 여름철 모두 2~3시간 노출 시 백만 명당 1명의 초과 암 발생이 예측되었다. 24시간 노출을 가정한 위험도 평가에서는 겨울철 백만 명당 41명, 여름철 68명의 초과 암 발생이 예측되었는데, 이는 도시 대기의 주요 발암물질인 벤조(a)피렌 (benzo(a)pyrene)의 영국 권고 기준치 (백만 명당 25명)를 크게 상회하는 수준이었다. 이 연구에서는 실내 공기 노출을 0으로 가정하였다는 것과 일부 니트로사민에 대해서는 독성 데이터가 부족한 것 그리고 기체상 니트로사민을 고려하지 않은 것 등을 감안할 때, 실제 인체 위해도는 본 연구에서 제시된 수치보다 더 높을 수 있다고 경고하였다.
6. 요약 및 제언
본 연구에서는 대기 중 입자상 니트로(소)화합물의 생성에 영향을 미치는 주요 인자들의 역할을 분석한 이전 연구들을 종합적으로 검토하였다. 먼저 에어로 졸의 수분함량은 입자상 니트로사민의 생성에 중요한 영향을 미치는 것으로 나타났으며, 특히 동절기에 강한 양의 상관관계를 보이는 것으로 확인되었다. 이는 에어로졸의 수분함량이 증가할수록 액체상 반응이 활발해지면서 니트로사민의 생성이 촉진되는 것으로 해석되었다. 반면 니트라민의 경우 에어로졸의 수분함량과의 상관성이 미미한 것으로 나타나, 액체상 에어로졸의 반응보다는 다른 반응 또는 1차 배출원의 영향을 더욱 크게 받는 것으로 추측되었다.
질소산화물의 영향은 니트로사민과 니트라민에서 상이한 패턴을 보이는 것으로 나타났다. 니트로사민은 NO와 NO2 모두와 강한 상관관계를 보였으며, 특히 동절기에 NO와의 상관성이 가장 높게 나타나 N2O3 생성 경로의 중요성을 시사하였다. 반면 니트라민은 NO2와의 상관성이 더 높게 나타나 서로 다른 생성 메커니즘이 작용하는 것으로 추정되었다. 특히 계절별분석 결과, 하절기에는 두 물질 모두 질소산화물과의 상관성이 크게 감소하는 것으로 나타났는데, 이는 계절에 따른 대기 화학 조건의 변화가 이들 물질의 생성에 중요한 영향을 미칠 수 있음을 보여주는 것으로 해석되었다.
오존화 반응의 기여도는 계절에 따라 변동하였으며, 특히 O3/NOx 비율이 높은 하절기에 가장 높은 기여도를 보이는 것으로 확인되었다. 그러나 전반적으로 오존화 반응의 기여도는 질산화 반응에 비해 낮은 수준인 것으로 평가되었다. 박스모델을 통한 정량적 분석 결과, 오존화 반응의 기여도는 계절에 따라 1.9~10.0%로 변동하는 것으로 나타났으며, 이는 질산화 반응이 여전히 주된 생성 경로임을 시사하는 것으로 판단되었다.
이러한 연구 결과에서 밝힌 바와 같이, 서울과 서산의 배출과 대기생성의 상대적인 중요성은 일차배출원의 존재 유무, 에어로졸의 수분함량 그리고 질소산화물과 오존의 농도에 따라 다르므로 각각의 특성을 고려한 차별화된 관리 전략의 수립이 필요한 것으로 판단되었다. 또한 계절에 따른 대기 화학 조건의 변화가 이들 물질의 생성에 중요한 영향을 미치는 것으로 나타났으므로, 계절별 특성을 고려한 맞춤형 저감 대책이 요구되는 것으로 판단되었다.
이전 연구들에서 서울, 춘천, 영국 North Kensington에서의 니트로사민의 흡입에 따른 암 발생 위해성을 평가하였다. 서울의 경우 입자상 니트로사민의 암발생 위험도는 남성 영아와 여성 영아에서 가장 높게 나타났으며, 65세 이상 노인층에서도 비교적 높은 위험도를 보였다. 춘천에서는 입자상 니트로사민보다 기체상 니트로사민의 위험도가 현저히 높았으며, 특히 겨울철 성인에서 가장 높은 발암 위험도를 나타냈다. 영국의 경우 24시간 노출을 가정했을 때의 암 발생 위험도가 도시 대기의 주요 발암물질인 벤조(a)피렌의 영국 권고 기준치를 크게 초과하는 수준이었다. 세 연구 모두 실내 노출을 고려하지 않았고 암 발생 위험도를 평가할 수 있는 일부 니트로사민에 대해서만 인체위해성을 평가하였다는 점을 감안할 때 실제 대기 중 니트로사민에 따른 인체위해성은 더 높을 수 있다고 판단된다.
향후 연구 방향으로는 다음과 같은 사항들이 고려되어야 할 것으로 판단되었다. 우선 니트라민의 경우 1차 배출원의 영향이 중요할 것으로 추정되므로, Positive Matrix Factorization (PMF)나 Chemical Mass Balance (CMB)와 같은 수용모델을 활용한 배출원 기여도 평가 연구가 수행되어야 할 것으로 사료되었다. 이를 통해 주요 배출원을 규명하고 각 배출원의 상대적 기여도를 정량화함으로써, 보다 효과적인 저감 대책 수립이 가능할 것으로 기대되었다. 또한 기존의 PMF 분석 결과와의 비교를 통해 지역별, 계절별 배출 특성의 차이를 파악하는 것도 중요할 것으로 판단되었다. 아직 규명되지 않은 반응 경로와 중간생성물에 대한 추가적인 연구도 필요한 것으로 판단되었다. 특히 오존화 반응에서 중간 생성물인 NH2OH와 같은 니트로사민과 니트라민을 생성하는 반응의 중간생성물의 거동 특성과 반응성에 대한 심층적인 분석이 요구되었으며, 실험실 규모의 챔버 실험을 통해 숨겨진 화학반응 메커니즘을 규명하는 것이 필요한 것으로 판단된다. 이러한 실험적 연구는 다양한 환경 조건에 서의 반응 경로 및 특성 그리고 반응속도상수를 도출하는 데 중요한 정보를 제공할 수 있을 것으로 기대된 다. 이와 함께 기체상-액체상-비균질 반응 간의 상호작용과 같은 복잡한 대기화학과정에 대한 이해를 높이기 위한 추가 연구도 필요한 것으로 판단되었다. 특히 에어로졸의 물리화학적 특성을 반영하기 위한 분석 및 모델링 결과의 적용을 통해 대기화학반응을 통해 대기 중 니트로(소)화합물이 생성되는 경로에 대한 이해를 넓힐 수 있을 것으로 판단된다.
Acknowledgments
이 연구는 환경부의 재원으로 국립환경과학원의 지원 (NIER-2024-04-02-010, NIER-2021-03-03-007)을 받아 수행하였습니다. 또한 본 연구는 환경부의 “미세 먼지관리 전문인력 양성사업”의 지원과 2023년도 강원대학교 학술연구조성비로 연구하였습니다.
References
-
Akyüz, M., Ata, Ş. (2013) Seasonal variations of particle-associated nitrosamines by gas chromatography-mass spectrometry in the atmospheric environment of Zonguldak, Turkey, Environmental Science and Pollution Research, 20, 7398-7412.
[https://doi.org/10.1007/s11356-013-1758-y]

-
Alexander, M., Dagdigian, P., Jacox, M.E., Kolb, C., Melius, C., Rabitz, H., Smooke, M., Tsang, W. (1991) Nitramine propellant ignition and combustion research, Progress in Energy and Combustion Science, 17, 263-296.
[https://doi.org/10.1016/0360-1285(91)90005-8]

-
Andrzejewski, P., Kasprzyk-Hordern, B., Nawrocki, J. (2008) N-nitrosodimethylamine (NDMA) formation during ozonation of dimethylamine-containing waters, Water Research, 42, 863-870.
[https://doi.org/10.1016/j.watres.2007.08.032]

-
Aragón, M., Marcé, R., Borrull, F. (2013) Determination of N-nitrosamines and nicotine in air particulate matter samples by pressurised liquid extraction and gas chromatography-ion trap tandem mass spectrometry, Talanta, 115, 896-901.
[https://doi.org/10.1016/j.talanta.2013.07.010]

-
Baek, K.-M., Park, E.H., Kang, H., Ji, M.-J., Park, H.-M., Heo, J., Kim, H. (2022) Seasonal characteristics of atmospheric watersoluble organic nitrogen in PM2.5 in Seoul, Korea: Source and atmospheric processes of free amino acids and aliphatic amines, Science of The Total Environment, 811, 152335.
[https://doi.org/10.1016/j.scitotenv.2021.152335]

-
Buist, H.E., Devito, S., Goldbohm, R.A., Stierum, R.H., Venhorst, J., Kroese, E.D. (2015) Hazard assessment of nitrosamine and nitramine by-products of amine-based CCS: Alternative approaches, Regulatory Toxicology and Pharmacology, 71(3), 601-623.
[https://doi.org/10.1016/j.yrtph.2014.01.017]

-
Cape, J., Cornell, S., Jickells, T., Nemitz, E. (2011) Organic nitrogen in the atmosphere - Where does it come from? A review of sources and methods, Atmospheric Research, 102, 30-48.
[https://doi.org/10.1016/j.atmosres.2011.07.009]

-
Challis, B.C., Kyrtopoulos, S.A. (1979) The chemistry of nitrosocompounds. Part 11. Nitrosation of amines by the two-phase interaction of amines in solution with gaseous oxides of nitrogen, Journal of the Chemical Society, Perkin Transactions, 1, 299-304.
[https://doi.org/10.1039/P19790000299]

-
Chen, Z., Cai, M., Zheng, H., Gao, Y., Xia, Y. (2025) Global geographical redistribution and source dynamics of selected semi-volatile organic compounds in the marine air boundary layer, Journal of Hazardous Materials, 481, 136528.
[https://doi.org/10.1016/j.jhazmat.2024.136528]

-
Choi, E., Lee, J.Y., Kim, Y.P. (2024a) Long-term (1993-2018) particulate polycyclic aromatic hydrocarbons (PAHs) concentration trend in the atmosphere of Seoul: Changes in major sources and health effects, Atmospheric Environment, 325, 120418.
[https://doi.org/10.1016/j.atmosenv.2024.120418]

-
Choi, N.R., Kim, Y.P., Lee, J.Y., Kim, E., Kim, S., Shin, H.J. (2024b) Impact of ozonation on the formation of particu late nitrosodi-methylamine (NDMA) in atmosphere, Chemosphere, 349, 140794.
[https://doi.org/10.1016/j.chemosphere.2023.140794]

-
Choi, N.R., Lee, J.Y., Ahn, Y.G., Kim, Y.P. (2020a) Determination of atmospheric amines at Seoul, South Korea via gas chromatography/tandem mass spectrometry, Chemosphere, 258, 127367.
[https://doi.org/10.1016/j.chemosphere.2020.127367]

-
Choi, N.R., Ahn, Y.G., Lee, J.Y., Kim, E., Kim, S., Park, S.M., Song, I.H., Kim, Y.P. (2020b) Winter-time particulate nitrosamines and nitramines in the atmosphere at seoul, South Korea, Atmospheric Environment, 237, 117582.
[https://doi.org/10.1016/j.atmosenv.2020.117582]

-
Choi, N.R., Ahn, Y.G., Lee, J.Y., Kim, E., Kim, S., Park, S.M., Song, I.H., Shin, H.J., Kim, Y.P. (2021) Particulate Nitrosamines and Nitramines in Seoul and Their Major Sources: Primary Emission versus Secondary Formation, Environmental Science & Technology, 55, 7841-7849.
[https://doi.org/10.1021/acs.est.1c01503]

-
Choi, N.R., Ahn, Y.G., Lim, H.B., Lee, J.Y., Jung, C.H., Kim, Y.P. (2018) Particulate nitrosamines in the atmosphere at Seoul and their major sources, Air Quality, Atmosphere & Health, 11, 855-865.
[https://doi.org/10.1007/s11869-018-0594-0]

-
Choi, N.R., Lee, S.P., Lee, J.Y., Jung, C.H., Kim, Y.P. (2016) Speciation and source identification of organic compounds in PM10 over Seoul, South Korea, Chemosphere 144, 1589-1596.
[https://doi.org/10.1016/j.chemosphere.2015.10.041]

-
Choi, N.R., Park, S., Ju, S., Lim, Y.B., Lee, J.Y., Kim, E., Kim, S., Shin, H.J., Kim, Y.P. (2022) Contribution of liquid water content enhancing aqueous phase reaction forming ambient particulate nitrosamines, Environmental Pollution, 303, 119142.
[https://doi.org/10.1016/j.envpol.2022.119142]

-
Davidson, C.I., Phalen, R.F., Solomon, P.A. (2005) Airborne particulate matter and human health: a review, Aerosol Science and Technology, 39, 737-749.
[https://doi.org/10.1080/02786820500191348]

- European Commission (EC) (1993) Commission Directive 93/11/EEC of 15 March 1993 concerning the release of the N-nitrosamines and N-nitrosatable substances from elastomer or rubber teats and soothers, European commission (EC).
-
Farren, N.J., Ramírez, N., Lee, J.D., Finessi, E., Lewis, A.C., Hamilton, J.F. (2015) Estimated exposure risks from carcinogenic nitrosamines in urban airborne particulate matter, Environmental Science & Technology, 49, 9648-9656.
[https://doi.org/10.1021/acs.est.5b01620]

-
Fine, D., Rounbehler, D.P., Belcher, N., Epstein, S. (1976) N-Nitroso compounds: Detection in ambient air, Science, 192, 1328-1330.
[https://doi.org/10.1126/science.192.4246.1328]

-
Ge, X., Wexler, A.S., Clegg, S.L. (2011) Atmospheric amines - Part I. A review, Atmospheric Environment, 45, 524-546.
[https://doi.org/10.1016/j.atmosenv.2010.10.012]

-
Grosjean, D. (1991) Atmospheric chemistry of toxic contaminants. 6. Nitrosamines: dialkyl nitrosamines and nitroso morpholine, Journal of the Air & Waste Management Association, 41, 306-311.
[https://doi.org/10.1080/10473289.1991.10466847]

- Herrmann, H., Weller, C. (2011) Atmospheric Chemistry-Aqueous phase chemistry. Tel-Tek report no. 2211030-AQ05 v2.
-
Hong, Y., Kim, K.H., Sang, B.-I., Kim, H. (2017) Simple quantification method for N-nitrosamines in atmospheric particulates based on facile pretreatment and GC-MS/MS, Environmental Pollution, 226, 324-334.
[https://doi.org/10.1016/j.envpol.2017.04.017]

-
Hutchings, J.W., Ervens, B., Straub, D., Herckes, P. (2010) N-nitrosodimethylamine occurrence, formation and cycling in clouds and fogs, Environmental Science & Technology, 44, 8128-8133.
[https://doi.org/10.1021/es101698q]

- International Agency for Research on Cancer (IARC) (1978) IARC monographs on the evaluation of carcinogenic risks to humans, World Health Organization (WHO).
-
Jang, K.-S., Choi, M., Park, M., Park, M.H., Kim, Y.H., Seo, J., Wang, Y., Hu, M., Bae, M.-S., Park, K. (2020) Assessment of PM2.5-bound nitrogen-containing organic compounds (NOCs) during winter at urban sites in China and Korea, Environmental Pollution, 265, 114870.
[https://doi.org/10.1016/j.envpol.2020.114870]

- Karl, M., Herckes, P., Mitch, W., da Silva, E.F. (2012) SINTEF Materials and Chemistry Process Technology Atmospheric Chemistry-Aqueous phase chemistry Project 25743 0193: D6 Final report, SINTEF.
-
Kim, H., Zhang, Q., Bae, G.-N., Kim, J.Y., Lee, S.B. (2017) Sources and atmospheric processing of winter aerosols in Seoul, Korea: insights from real-time measurements using a high-resolution aerosol mass spectrometer, Atmospheric Chemistry and Physics, 17, 2009-2033.
[https://doi.org/10.5194/acp-17-2009-2017]

- Låg, M., Lindeman, B., Instanes, C., Brunborg, G., Schwarze, P. (1984) Health effects of amines and derivatives associated with CO2 capture, IARC Sci Publ, 57, 3-22.
-
Lazarou, Y.G., Kambanis, K.G., Papagiannakopoulos, P. (1994) Gasphase reactions of (CH3)2N Radicals with NO and NO2, The Journal of Physical Chemistry, 98, 2110-2115.
[https://doi.org/10.1021/j100059a022]

-
Lee, C., Yoon, J., Von Gunten, U. (2007) Oxidative degradation of N-nitrosodimethylamine by conventional ozonation and the advanced oxidation process ozone/hydrogen peroxide, Water Research, 41, 581-590.
[https://doi.org/10.1016/j.watres.2006.10.033]

-
Mai, T.T.H., Kim, H. (2024) Occurrence of N-nitrosamines in the atmosphere and human health risk: A case study in an urban area of Chuncheon, Gangwon State, South Korea, Environmental Pollution, 349, 123802.
[https://doi.org/10.1016/j.envpol.2024.123802]

-
Mezyk, S.P., Ewing, D.B., Kiddle, J.J., Madden, K.P. (2006) Kinetics and mechanisms of the reactions of hydroxyl radicals and hydrated electrons with nitrosamines and nitramines in water, The Journal of Physical Chemistry A, 110, 4732-4737.
[https://doi.org/10.1021/jp056017r]

- Ministry of Food and Drug Safety (KFDS) (2013) Criteria for the equipment, containers and package (2013-246), Korea Ministry of Food and Drug Safety (MFDS).
- National Toxicology Program (NTP) (2016) 14th Report on Carcinogens, NTP, National Toxicology Program.
-
Ng, N.L., Brown, S.S., Archibald, A.T., Atlas, E., Cohen, R.C., Crowley, J.N., Day, D.A., Donahue, N.M., Fry, J.L., Fuchs, H. (2017) Nitrate radicals and biogenic volatile organic compounds: oxidation, mechanisms, and organic aerosol, Atmospheric Chemistry and Physics, 17, 2103-2162.
[https://doi.org/10.5194/acp-17-2103-2017]

- Nielsen, C.J., D’Anna, B., Karl, M., Aursnes, M., Boreave, A., Bossi, R., Bunkan, A.J., Glasius, M., Hallquist, M., Hansen, A.M.K. (2011) Atmospheric Degradation of Amines (ADA): Summary Report: Photo-Oxidation of Methylamine, Dimethylamine and Trimethylamine, Norsk Institutt for Luftforskning CLIMIT project no. 201604.
-
Nielsen, C.J., Herrmann, H., Weller, C. (2012) Atmospheric chemistry and environmental impact of the use of amines in carbon capture and storage (CCS), Chemical Society Reviews, 41, 6684-6704.
[https://doi.org/10.1039/c2cs35059a]

-
Pitts Jr, J.N., Grosjean, D., Van Cauwenberghe, K., Schmid, J.P., Fitz, D.R. (1978) Photooxidation of aliphatic amines under simulated atmospheric conditions: formation of nitrosamines, nitramines, amides, and photochemical oxidant, Environmental Science & Technology, 12, 946-953.
[https://doi.org/10.1021/es60144a009]

- Seinfeld, J.H., Pandis, S.N. (2016) Atmospheric chemistry and physics: from air pollution to climate change, John Wiley & Sons, USA.
-
Song, Y., Feng, S., Qin, W., Li, J., Guan, C., Zhou, Y., Gao, Y., Zhang, Z., Jiang, J. (2022) Formation mechanism and control strategies of N-nitrosodimethylamine (NDMA) formation during ozonation, Science of The Total Environment, 823, 153679.
[https://doi.org/10.1016/j.scitotenv.2022.153679]

-
Tuazon, E., Atkinson, R., Aschmann, S., Arey, J. (1994) Kinetics and products of the gas-phase reactions of O3 with amines and related compounds, Research on Chemical Intermediates, 20, 303-320.
[https://doi.org/10.1163/156856794X00351]

- U.S. Food and Drug Administration (USFDA) (1984) CPG Sec. 500.450 volatile N-nitrosamines in rubber baby bottle nipples, United States Food and Drug Administration, US FDA.
-
Wang, J., Zhou, X., Hua, Z., Jiang, N., He, X. (2023) Concentration level, health risk assessment and source apportionment of nitrosamines in PM2.5 in Urumqi during winter time, Atmospheric Pollution Research, 14, 101756.
[https://doi.org/10.1016/j.apr.2023.101756]

-
Yang, J., Wang, G., Gong, X., Zhang, J., Wang, Y.A. (2018) Highenergy nitramine explosives: a design strategy from linear to cyclic to caged molecules, ACS Omega 3, 9739-9745.
[https://doi.org/10.1021/acsomega.8b00614]

-
Yang, L., Chen, Z., Shen, J., Xu, Z., Liang, H., Tian, J., Ben, Y., Zhai, X., Shi, W., Li, G. (2009) Reinvestigation of the nitrosamine-formation mechanism during ozonation, Environmental Science & Technology, 43, 5481-5487.
[https://doi.org/10.1021/es900319f]

-
Zhang, X., Zhang, H., Wang, Y., Bai, P., Zhang, L., Toriba, A., Nagao, S., Suzuki, N., Honda, M., Wu, Z. (2025) Estimation of gaseous polycyclic aromatic hydrocarbons (PAHs) and characteristics of atmospheric PAHs at a traffic site in Kanazawa, Japan, Journal of Environmental Sciences, 149, 57-67.
[https://doi.org/10.1016/j.jes.2023.09.009]

최나래(강원대학교 환경공학과 조교수) (narae@kangwon.ac.kr)
김용표(이화여자대학교 환경블라인드스팟연구센터 명예교수) (yong@ewha.ac.kr)