LC-MSMS를 이용한 대기 중 PM2.5 유리아미노산 분석 방법 연구
 ; Seung-Sik Cho4) ; Kwang-Yul Lee5) ; Kihong Park5)
; Seung-Sik Cho4) ; Kwang-Yul Lee5) ; Kihong Park5)
Copyright © 2017 Korean Society for Atmospheric Environment
Abstract
Atmospheric nitrogen containing organic compounds (e.g. amino acids) has attracted considerable attention from the viewpoint of the oceanic biogeochemical cycle of nitrogen as well as the long range transfer. However, only a few measurements of organic nitrogen compounds have been conducted due to analytical difficulties. In this study, total of nine amino acids such as Glutamic acid, Histidine, Arginine, Tyrosine, Cystine, Valine, Methionine, Phenylalanine, Lysine have been analytically determined by Liquid Chromatography - Mass Spectrometry Mass Spectrometry (LC-MSMS). As results, Fragmentor Voltage (FV), Precursor Ion, Collision Energy, Product Ion related to individual amino acid compounds are shown. Based on the operational conditions, Lysine, Glutamine Acid, Tyrosine were analyzed during the China Oriented Smog Period. High concentrations of Lysine, Glutamine Acid, and Tyrosine are discussed with organic carbon (OC), elemental carbon (EC), and water soluble ions. The results can provide to understand the sources with aging process related to amino acids influenced by the longrange transport from the Yellow Sea area.
Keywords:
LC, LC/MSMS, LC/QQQ, Amino acid, PM2.51. 서 론
대기 중 질소 유기 성분의 일종인 아미노산 (amino acid, AA)은 유리 아미노산 (free amino acid, FAA) 및 구성 아미노산 (combined amino acid, CAA)으로 분류되며, 강한 친수성으로 구름 응결핵 (Kristensson et al., 2010)으로 작용하고, 복사강제력 (Chan et al., 2005) 등과 연관되어 기후 변화와 직간접적으로 관련이 있다. 화학 구조상 FAA 및 CAA는 성분 내 염기성인 아미노기 (-NH2)와 산성인 카르복시기 (-COOH)를 모두 가지고 있어 대기 중 완충작용 (buffering) 및 산도 등에 영향을 미치며 (Zhang et al., 2003), 대기 내 질소 및 탄소 순환에 깊게 관여한다 (Wedyan et al., 2008). 또한, Scalabrin et al. (2012)에 의하면 대기 분진의 AA 중 methionine은 오존에 의해 노화 (aging)현상이 진행되며, 형성된 이차 산물은 반감기가 최대 80시간까지 지속된다고 보고하였다. 기후 변화 관련과 더불어, 인체 유해성 측면에서의 대기 중 CAA는 알레르기, 호흡기 질환 및 안구 질환과 관련이 있다 (Filippo et al., 2014; Poschl, 2005). 또한, 해수 내 AA가 평소에 비해 50배 이상 증가하면, 지역 해상 환경 부영양화에 크게 기여하고 (Rosenstock and Simon, 2003), 해안지역 안개 내 수용성 질소 유기 화합물은 최대 22%까지 나타나며 (Zhang and Anastasio, 2001), 대기 중 질소 유기 화합물 내 AA는 약 20%까지 높은 비율로 존재할 수 있다 (Zhang et al., 2002). 따라서, 대기 중 질소를 포함한 유기성분 분석과 원인규명을 밝히는 것은 매우 중요하며, 대기 중 기후변화 영향, 인체 유해성을 정확히 밝히기 위해서 AA와 같은 질소 함유 유기성분 분석은 매우 중요하다. 해안 등으로부터 기여된 AA의 농도는 적지 않을 것으로 예상하지만, 극미량 AA 분석에 대한 분석 기술의 어려움으로 인해 국내 연구는 매우 미진하다.
지금까지 AA를 분석하는 기술은 높은 수용해성으로 인해 액체크로마토그래피 형광분석법 (Part et al., 2015; Aznar et al., 2009)이 가장 많이 이용되고 있다. 하지만, 본 분석법은 ο-phthaldialdehyde (OPA)와 9-fluorenylmethoxycarbonylchloride (FMOC)에 의한 유도체화 과정 및 광학이성질체의 상호 간섭현상 등에 의해 불확실성이 증가할 수 있다. 따라서, 대기 중 분진 내 AA 분석을 위해, 극미량 분석의 간섭현상 최소화 및 낮은 정량 한계 분석방법 연구는 필수 불가결하다. 이에, 본 연구에서는 Liquid Chromatography - Mass Spectrometry Mass Spectrometry (LC-MSMS)를 이용하여, 9성분 FAA에 대해 정성 및 정량법을 연구하고, 국내 중국발 스모그 유입 시, 분진 FAA 내 존재하는 Lysine, Glutamine Acid, Tyrosine의 농도를 분석하였다.
2. 방 법
2. 1 FAA LC-MSMS 분석 조건
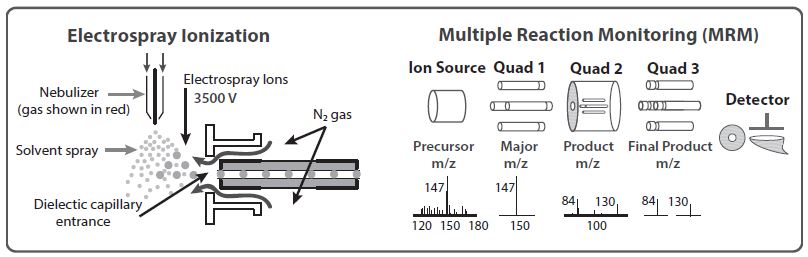
본 연구에서는 LC-MSMS (LC; 1200, MSMS; 6100, Agilent Technologies, USA)를 이용하여 AA 성분 중 Glutamic acid, Histidine, Arginine, Tyrosine, Cystine, Valine, Methionine, Phenylalanine 그리고 Lysine의 9성분에 대한 분석 방법을 연구하였다. LC-MSMS의 기본 원리는 주입된 분석 성분을 이온 (m/z)화하고, 진공 (10-5~10-7 torr) 하에 직렬로 연결된 두 개의 질량 분석기에 의해 질량 파편 (m/z)을 분리하여, 이온 증폭 검출기에서 증폭 검출한 질량 스펙트럼을 최종 검출한다. 표 1에 대기 중 AA 분석을 위한 LC-MSMS 분석 조건을 나타냈다.
LC-MSMS는 복잡한 두 분석 조건 (LC 및 MSMS 분석 조건)을 통해 이루어진다. 이를 간략히 그림 1에 나타냈다. 첫째, 질량 분석을 위한 LC조건은, 컬럼 온도 40°C 하에 Poroshell 컬럼 (Agilent Poroshell 120 EC-C18, Capillary 2.1×150 mm 4.0-Micron)을 이용하였다. 용리액 유량 0.6 mL/min 하에, DDW wt 0.1% Formic acid 및 Acetonitrile wt 0.1% Formic acid을 9 : 1의 비율로 주입하여 분석하였다. 질량 분석기 내 주입 시, 주입온도 300°C에서 40 psi 압력 하에, 40 μL 주입 시료와 함께 질량 분석기로 주입된다. 이에, 질량 분석기 분석 source는 Electrospray ionization (ESI)를 이용하여 multiple reaction monitoring (MRM) 질량 분석 조건으로 AA를 분석하였다. 둘째, 본 연구에서 AA를 분석하기 위해 사용된 LC-MSMS는 질량분석관 두 개가 직렬로 연결되어 구성된 질량분석기로서 각각의 질량분석관에서 사용할 수 있는 분석 모드 조합 하에 다양한 분석기법으로 분석할 수 있다. 간략히, Fragmentor Voltage (FV)에 의해 1차 질량 파편 이온이 생성되고, 첫 번째 질량분석관에서, 생성 파편 중 MRM Selected Ion Monitoring (SIM) 조건에서 주 파편이온이 선택적으로 분류되어 전구이온 (Precursor Ion, PI)이 생성된다. 생성된 전구이온은 두 개의 질량분석관 사이의 충돌유도분리 (collision induced dissociation)과정 중 충돌 에너지 (Collision Energy, CE)에 의해 재분리되어 생성이온 (Product Ion 또는 Quantifier)이 생성되고, 두 번째 질량분석관으로 보내진다. 최종적으로, 두 번째 질량분석관의 SIM조건 하에 생성이온 중 주 파편이온이 다시 선택되어 최종 정성, 정량 분석된다. 이에 두 개의 질량 분석기 모두 SIM 모드로 설정한 분석 방법을 MRM이라 명한다. 이는 단일 질량 분석기와 다르게 불가능한 분석 방해 질량 이온 물질을 전량 제거함으로써 목적 성분만이 갖는 고유한 생성이온에 대해서 선택적 검출하므로 매우 높은 감도를 나타낸다. 이에, 각각의 성분마다 높은 감도를 나타내는 (1) FV, (2) 전구이온, (3) CE 그리고 (4) 생성이온에 대한 최적 조건을 찾는 것은 저농도 샘플을 분석하는 데 매우 중요하다. 본 연구에서 9개 AA성분에 대한 4가지 최적 조건을 목포대학교 환경공학과에서 분석하여 최종 값을 나타냈다.
2. 2 여과지 분석
대기 중 FAA 및 PM2.5 주성분을 분석하고자 광주과학기술원 삼성동 (35.23°N, 126.84°E) 3층에서 2015년 10월 21일부터 25일까지 5일간 측정이 이루어졌다. 본 측정소는 광주광역시의 도심 북쪽 끝에 위치해 있으며, 동쪽은 교외 및 농업지역, 서쪽 및 남쪽은 산업, 도심지역이 위치해 있고, 측정소 서쪽 약 2 km 지점에 호남고속도로가 위치해 있다. PM2.5 사이클론 (URG-2000-30ENYF, URG Corp., USA)을 통해 여과지팩 (URG-2000-30F, URG Corp., USA)에 장착된 테프론 여과지 (PTFE, R2PJ047, Pall Corp., USA)에 16.7 lpm 유량 하에 PM2.5 분진 포집 후, 여과지 전후 무게 차에 의한 총 질량 분석 후, 수용성 이온성분을 분석하였다. 또한, 92 lpm 유량 하에 석영 여과지 (Pallflex, 2500QATUP, Pall Corp., USA)에 PM2.5 분진을 포집하여, 유기탄소, 원소탄소, 수용성 유기탄소를 분석하였다. 유기탄소 및 원소탄소는 National Institute of Occupational Safety & Health (NIOSH) 5040 프로토콜 (protocol)을 기초로 한 탄소분석기 (Carbon Aerosol Analyzer, Sunset laboratory Inc., USA)를 이용하였다 (Bae et al., 2013). 간략히, 1.5 cm2로 절단된 석영 여과지에 단당 (sucrose)을 이용한 외부 표준물질 및 5% CH4 내부 표준물질을 분석하였으며, 재차분석에 의해 100±5.00% 이내의 정확도 (target/actual) 분석 후 농도를 분석하였다. 이온성분은 테프론 여과지에 포집된 시료를 10 mL의 초순수액으로 추출하여 Ion Chromatography (IC Metrohm, Switzerland)로 분석하였다. 음이온 Cl-, NO3-, SO42-과 양이온 Na+, NH4+, K+, Ca2+, Mg2+의 총 8가지의 이온 성분을 현장 공시료 분석을 통해 배경농도를 보정하여 분석하였다. 간략히, 음이온은 Metrohm Metrosep A Supp-5 칼럼, 0.7 mL/min 유속, 100 μL 주입량, 3.2 mM Na2CO3 & 1.0 mM NaHCO3 용리액 조건으로 분석하였고, 양이온은 Metrohm Metrosep C3-150 칼럼, 1.0 mL/min 유속, 100 μL 주입량, 5 mM HNO3 용리액 조건으로 분석하였다. 석영 여과지에 의해 포집된 분진 중 수용성 유기탄소를 분석하고자, 유기탄소 및 원소탄소 분석을 위해 절단 후 남은 여과지를 30 mL의 초순수액을 이용하여 120분 동안 초음파기에 의해 추출하였다. 이후 시린지 여과지 (PTFE 0.45 μm pore size, Advantec, Japan)를 사용하여 불용성 분진을 제거한 후, 최종 수용성 시료를 total organi carbon (TOC) 분석기 (Sievers 900, GE, USA)로 분석하였다. 이에, 분석된 수용성 유기탄소 (water soluble organic carbon, WSOC)와 OC 농도 차이로부터 불용성 탄소 (water insoluble organic carbon, WIOC)를 계산하여 나타내었다. 마지막으로 테프론에 포집된 분진은 분석 전후로 데시게이터 내에서 12시간 동안 항냉 후, 최저 1 μg 해상도 전자저울 (DM, Sartorius Corp, Germany)로 최소 3번 이상 분석하여, 연속 3번 측정값의 차이가 5 μg 이내 평균값을 최종적으로 나타냈다.
3. 결과 및 토의
3. 1 LC-MSMS를 이용한 FAA MRM 조건 질량 파편 (m/z) 결과
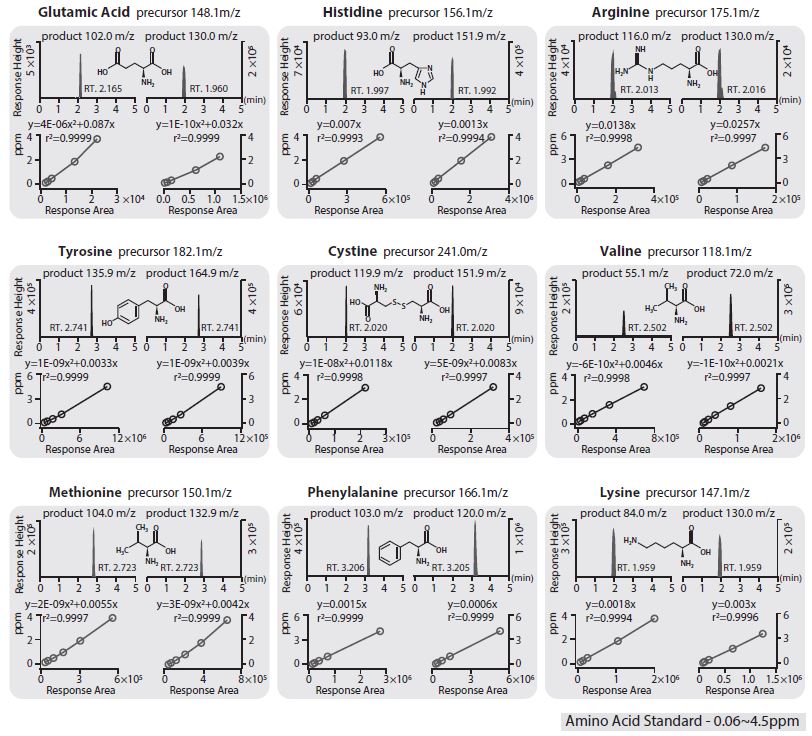
표 2는 FAA 중 Glutamic acid, Histidine, Arginine, Tyrosine, Cystine, Valine, Methionine, Phenylalanine, Lysine의 최적 LC-MSMS 질량 분석 조건인 (1) FV, (2) 전구이온, (3) CE 그리고 (4) 생성이온을 나타낸 결과이다. 즉, 표 1의 LC 분석 조건 하에, 질량 파편 이온의 가장 좋은 민감도를 여러 차례 재차 분석한 결과이다. Glutamic acid의 경우 80 V의 FV에 의해 148.1 m/z 전구이온이 생성되고, 이는 다시 4 및 8 V의 CE에 의해 130 및 102 m/z의 최종 생성이온을 나타내었다. Tyrosine은 80 V FV에 의해 182.1 m/z 전구이온이 생성되고, 4 및 8 V의 CE에 의해 164.9 및 135.9 m/z의 두 생성이온을 나타내며, Lysine은 80 V FV에 의해 147.1 m/z의 전구이온 생성에 이어, 16 및 4 V의 CE에 의해 84 및 130 m/z의 생성이온을 나타냈다. 여기서, Glutamic acid와 Lysine의 생성이온이 같을지라도 다른 전구이온에 의해 파생되므로 간섭현상은 일어나지 않는다. 표 2의 분석 조건 결과는 대기 중 FAA뿐만 아니라 다른 매체 중 AA를 LC-MSMS를 이용하여 분석하는데 적용할 수 있다. 선택된 두 생성이온 중 최종 생성이온은 표준물질 선형성 및 방법검출한계 (method detection limit; MDL) 그리고 정밀도 (relative percent differences; RPD) 분석에 의해 결정되었다.
선행 연구에서 Liquid Chromatography with Fluorescence Detection (LC-FLD) 분석법은 (1) proline의 경우 분석 체류시간의 불안정, (2) cystine 및 valine의 경우 피크 잔류 현상 (3) 그리고 거의 모든 FAA 성분에 대해서 광학이성질체의 동 체류시간 간섭 등으로 정성 분석에 한계가 있다 (Park et al., 2015). 이에, 본 연구에서 LC-MSMS를 이용하여 FAA의 9개 성분에 대해 분석조건을 연구하여 표 1과 표 2에 요약하였다. 본 분석 조건을 이용하여 9개 성분 두 생성이온에 대해 6개 다른 농도 (약 60 ppb에서 최대 4.5 ppm)의 각각의 표준 물질을 분석한 결과를 그림 2에 나타냈다. 결과, Glutamic acid (102.0 & 130.0 m/z), Tyrosine (135.9 & 164.9 m/z), Cystine (119.9 & 151.9 m/z), Valine (55.1 & 72.0 m/z), Methionine (104.0 & 132.9 m/z), Phenylalanine (103.0 & 120.0 m/z)의 경우 표준시료에 대한 분석 면적의 상관성이 이차 선형성을 나타냈으며, Histidine (93.0 & 151.9 m/z), Arginine (116.0 & 130.0 m/z) 그리고 Lysine (84.0 & 130.0 m/z)은 일차 선형성을 나타냈다. 모두 상관관계 결정계수 (r2)가 0.999 이상으로 매우 좋은 선형성을 나타냈다.
표 3은 최종 분석 조건을 이용한 FAA의 전구 이온 및 생성 이온의 표준 물질 상관관계 결정계수 (r2), 방법검출한계 그리고 방법검출한계 저농도의 재차분석에 의한 정밀도를 나타냈다. 정밀도는 최저농도 표준 물질의 반복 분석에 따른 농도차를 퍼센트로 나타낸 것이며, 방법검출한계는 본 연구에서 제시한 LC-MSMS 분석 조건을 이용하여, 분석 가능한 최저 농도 표준시료를 7번 반복 분석한 후, 분석 표준편차에 3.14 (pi)를 곱한 값이다. 결과, 매우 높은 상관관계 결정계수와 함께 방법검출한계는 최저 0.031 ng/m3 (Histidine)에서 최고 0.928 ng/m3 (Glutamic acid)까지 나타났다. Cystine의 정밀도는 Quantifier 151.9 m/z에서, Methionine의 Quantifier 104.0 m/z에서 최고 25.9 %까지 나타났다. 방법검출한계 농도는 본 연구의 대기 시료를 포집 및 추출 용량을 고려한 대기 중 농도로 환산하여 나타낸 것이다. Methionine의 Quantifier 132.9 m/z에서는 0.725%로 분석되어, 상대적으로 매우 낮은 RPD를 나타냈다. 이에, 앞서 설명한 모든 분석 조건, 표준 물질 상관성 분석, 방법검출한계 그리고 정밀도 등을 고려하여, 대기 중 분진 내 FAA에 대한 분석 조건을 최종 설정하였다.
3. 2 LC-MSMS를 이용한 AA 고농도 사례 분석
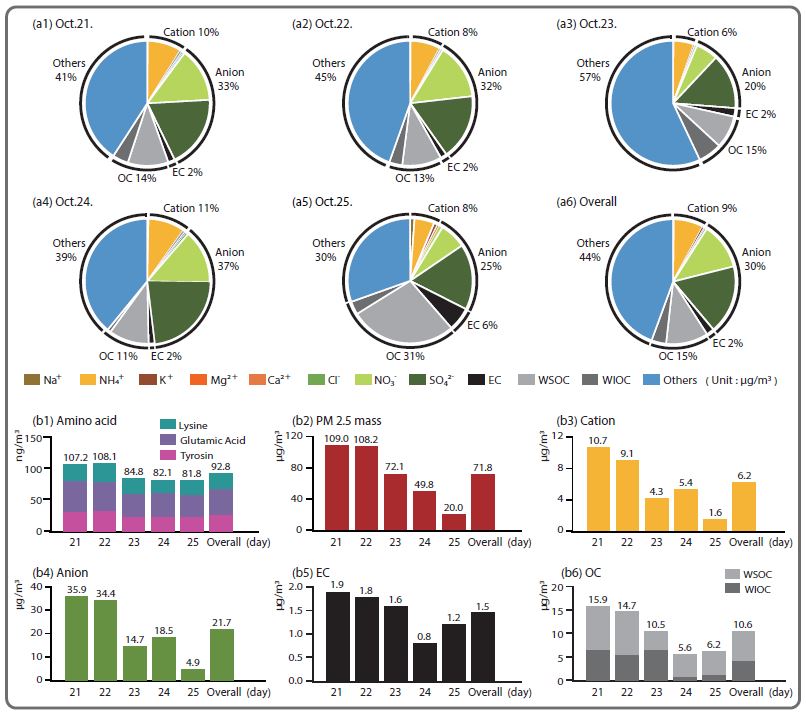
2015년 10월 21일부터 5일간 포집된 분진을 추출하여, LC-MSMS에 의해 FAA 중 Tyrosine, Glutamic acid 그리고 Lysine의 3 성분에 대해서 아미노산을 정량, 정성 분석하였다. 향후 3 성분 이외에 추가 FAA 성분에 대해 추가 분석할 예정이다. 표 4에 나타내듯이 아미노산 분석 결과, 3 성분에 대한 아미노산 누적 총 평균농도는 91.60 ng/m3로 분석되었다. Tyrosine 농도는 32.68에서 23.90 ng/m3 사이에서, 평균 27.33 ng/m3로 분석되었으며, Glutamic acid 평균 39.81 ng/m3, Lysine 24.46 ng/m3으로 나타났다. Glutamic acid 경우 0.27 nmol/m3의 농도로 환산할 수 있으며, 이는 Wedyan and Preston(2008)의 남대서양 해상 대기 중 Glutamic acid 농도보다 5배 높게 나타났다. 또한, 전체적으로 해양 대기 중 농도의 최소 10배 이상 매우 높게 나타났다 (Park et al., 2015; Mandalakis et al., 2011). 시계열 농도를 살펴보면, 21일과 22일에 모두 최고 농도로 분석되었고, 이후 농도가 다소 낮아졌다.
FAA의 고농도 원인을 자세히 분석하고자, 유입 공기의 흐름을 분석하기 위해 NOAA의 HYSPLIT model (Draxler and Rolph, 2015)을 사용하여 역궤적 분석 (backtrajectory analysis) 결과와 Moderate Resolution Imaging Spectroradiometer (MODIS) 인공위성 관측자료로 분석된 에어로솔 광학두께 (Aerosol Optical Depth, AOD)결과를 그림 3에 나타내었다. 본 연구에서 사용된 MODIS AOD 자료는 36개의 광학채널로 구성된 MODIS 센서의 L1B 자료로부터 0.66, 0.86, 0.47, 0.55, 1.24, 1.64, 2.12 μm의 총 7개 채널 값이 사용되며, 후처리 및 알고리즘 적용을 통하여 산출된 Collection 6, Level 2 자료 (코드명: Terra MOD04_3K, Aqua MYD04_ 3K)이다. MODIS AOD 자료는 대기 칼럼 내 존재하는 분진에 대한 상대적인 양을 나타내므로, 역궤적 분석 결과와 함께 고농도 분진 지역에 대한 시공간적 분진의 분포정보를 제시한다. 또한, 우리나라 환경부 400여 대기 측정소에서 측정된 PM10 질량 농도를 원 넓이로 지도상에 나타냈다. 결과, 10월 21일 우리나라 전국에 있는 거의 모든 측정소에서 대기환경 기준인 100 μg/m3이 넘는 매우 높은 PM10 농도가 관측되었다. 서해안을 중심으로 거의 대부분의 측정소에서 21일 22일 양일에 150 μg/m3이 넘게 측정되었다. 이후 23일에 서해 남LatitudeLatitude부 지역에서 일부 지속적으로 높은 농도를 유지하다가 24일 이후 전국적으로 농도가 감소하였다. MODIS AOD 및 역궤적 분석 결과, 21일과 22일에 매우 강한 중국 발 스모그가 관측되었다. 이에 중국에서 서해상을 거쳐 유입된 기류의 영향으로 인해 FAA를 포함한 PM10의 고농도가 우리나라 전역에 영향을 미쳤다. 아미노산 고농도는, 중국에서 발생된 NH3와 같은 1차 질소 성분이 장거리 이동과 함께 노화 (aging)에 따른 영향으로, 이에 관한 추가 연구를 진행 예정이다.
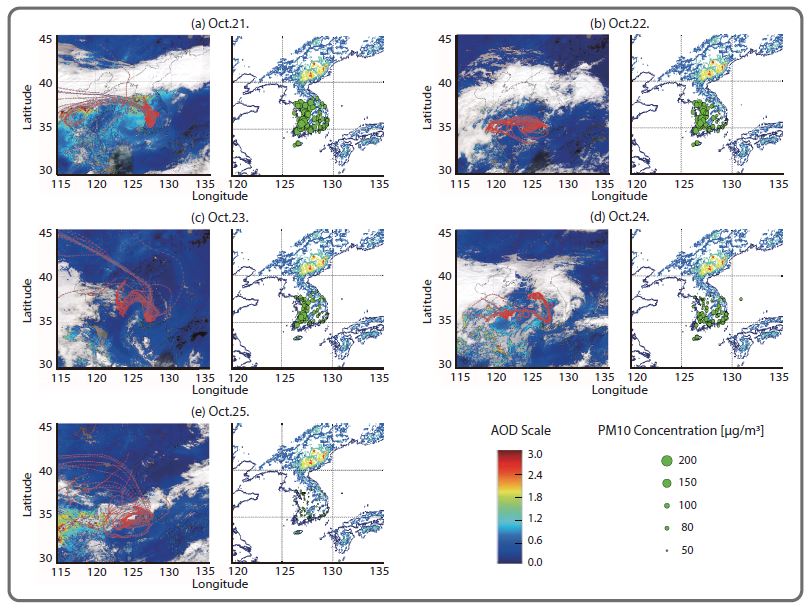
MODIS colored by AOD (color bar: AOD level) with three days of HYSPLIT backward trajectories and PM10 concentrations (PM network) measured by the Ministry of Environment between October 21 and 25 in 2015 (during the China Oriented Smog Period).
측정소에서 포집된 시료의 중량 분석법으로 분석한 일별 PM2.5 질량농도 및 분석 성분을 그림 4에 나타냈다. 이에, PM2.5 질량농도의 경우 21일과 22일 모두 대기환경 기준 50 μg/m3 넘게 나타났으며, 이후 감소하기 시작하여 25일 20 μg/m3으로 최소값을 나타냈다. 관측 기간 동안 OC 농도는 5.6 μg/m3에서부터 15.9 μg/m3까지 나타났고, 평균 10.6 μg/m3으로 측정되었다. 이는 2014년 서울 불광동 지역에서 약 2주간 관측한 OC 평균의 3배가 넘는 농도이고 (Park et al., 2014), 전국 6곳 국립환경과학원 집중측정소 (Lee et al., 2015)에서 관측한 평균 (3.95 μg/m3)에 비해 2.5배 높게 나타났다. EC 농도는 1.9에서 0.8 μg/m3까지의 범위를 나타내었고, 평균은 1.5 μg/m3으로 분석되었다. WSOC는 평균 2.69±1.41 μg/m3으로 OC의 약 77.3%로 나타났고, OC와 EC 농도의 비율은 평균 7.04로 분석되어 국내 타지역에 비해 높게 나타났다 (Jeong et al., 2011; Park et al., 2007). 또한 수용성 이온성분을 보면 음이온, 양이온 모두 21일과 22일에 최대값을 나타내어, PM2.5 중 분석된 FAA 등 수용성 이차 성분이 상대적으로 높은 농도로 나타났다. 그림 4에 나타낸 기타 (others)는 organic matter (OM) 중 분석되지 않은 산소 및 수소를 포함한 유기 결합 성분, 중금속 산화 성분이 존재한다. 이는 앞서 설명한 바와 같이 중국에서 서해상을 거쳐 유입된 기류의 영향에 의해 노화현상에 따른 이차 성분이 증가했으며, 특히 아미노산과 같은 질소 함유 유기성분이 급격히 증가했다. 향후, OC 내 FAA 등의 질소 유기 성분이 중국에서 유입된 스모그 등에 대한 지표물질로 역할을 할 수 있다.
4. 요약 및 결론
본 연구에서 LC-MSMS를 이용하여, FAA 중 Glutamic acid, Histidine, Arginine, Tyrosine, Cystine, Valine, Methionine, Phenylalanine, Lysine의 최적 LC-MSMS 질량 분석 조건인 FV, 전구이온, CE 그리고 생성이온을 나타냈다. 결과, Glutamic acid는 80 V FV에 의한 148.1 m/z 전구이온, 4 및 8 V CE에 의한 130 및 102 m/z의 생성이온을 나타냈다. Tyrosine의 FV, 전구이온, CE 그리고 생성이온은 80 V, 182.1 m/z, 4 및 8 V에 의한 164.9 및 135.9 m/z을 나타냈다. 본 조건을 이용한 국내 중국발 스모그 유입 시, 분진 FAA 내 존재하는 Lysine, Glutamine Acid, Tyrosine은 평균 27.33 ng/m3, 39.81 ng/m3, 24.46 ng/m3로 매우 높게 나타났다. 이는 OC 내의 FAA 등의 질소 유기 성분이 중국에서 유입된 스모그 내 존재하는 유기 성분 중 지표성분으로 존재할 수 있다.
Acknowledgments
이 논문은 2016년도 정부 (미래창조과학부)의 재원 (NRF-2014M3C8A5028593)으로 한국연구재단-사회문제해결을 위한 시민연구사업의 지원을 받아 수행된 연구입니다. 본 연구 결과를 위해 기기 분석에 애쓰신 목포대학교 환경공학과 대기분자연구실 모든 연구원님께 깊은 감사드립니다.
References
-
Aznar, M., E. Canellas, and C. Nerin, (2009), Quantitative determination of 22 primary aromatic amines by cation-exchange solid-phase extraction and liquid chromatographyemass spectrometry, Journal of Chromatography A, 1216(27), p5176-5181.
[https://doi.org/10.1016/j.chroma.2009.04.096]

-
Bae, M.S., S.S. Park, and Y.J. Kim, (2013), Characteristics of carbonaceous aerosols measured at Gosan- Based on analysis of thermal distribution by carbon analyzer and organic compounds by GCMS, Journal of Korean Society for Atmospheric Environment, 29(6), p722-733, (in Korean with English abstract).
[https://doi.org/10.5572/kosae.2013.29.6.722]

-
Chan, M.N., M.Y. Choi, N.L. Ng, and C.K. Chan, (2005), Hygroscopicity of water-soluble organic compounds in atmospheric aerosols: amino acids and biomass burning derived organic species, Environmental Science & Technology, 39(6), p1555-1562.
[https://doi.org/10.1021/es049584l]

- Draxler, R.R., and G.D. Rolph, (2015), HYSPLIT (HYbrid Single- Particle Lagrangian Integrated Trajectory) Model access via NOAA ARL READY Website, (http://www.arl.noaa.gov/HYSPLIT.php) NOAA Air Resources Laboratory, College Park, MD.
-
Filippo, P.D., D. Pomata, C. Riccardi, F. Buiarelli, V. Gallo, and A. Quaranta, (2014), Free and combined amino acids in size-segregated atmospheric aerosol samples, Atmospheric Environment, 98(2014), p179-189.
[https://doi.org/10.1016/j.atmosenv.2014.08.069]

-
Jeong, J.U., J.H. Kim, S.S. Park, K.J. Moon, and S.J. Lee, (2011), Study on characterization of hydrophilic and hydrophobic fractions of water-soluble organic carbon with a XAD resin, Journal of Korean Society for Atmospheric Environment, 27(3), p337-346, (in Korean with English abstract).
[https://doi.org/10.5572/kosae.2011.27.3.337]

-
Kristensson, A., T. Rosenorn, and M. Bilde, (2010), Cloud droplet activation of amino acid aerosol particles, The Journal of Physical Chemistry A, 114(1), p379-386.
[https://doi.org/10.1021/jp9055329]

-
Mandalakis, M., M. Apostolaki, T. Tziaras, P. Polymenakou, and E.G. Stephanou, (2011), Free and combined amino acids in marine background atmospheric aerosols over the Eastern Mediterranean, Atmospheric Environment, 45(4), p1003-1009.
[https://doi.org/10.1016/j.atmosenv.2010.10.046]

- Park, D.J., I.H. Cho, and M.S. Bae, (2015), Determination of Amino Acids on Wintertime PM2.5 using HPLCFLD, Journal of Korean Society for Atmospheric Environment, 31(5), p482-492, (in Korean with English abstract).
-
Park, D.J., J.Y. Ahn, H.J. Shin, and M.S. Bae, (2014), Characteristics of PM2.5 Carbonaceous Aerosol using PILSTOC and GC/MS-TD in Seoul, Journal of Korean Society for Atmospheric Environment, 30(5), p461-476, (in Korean with English abstract).
[https://doi.org/10.5572/kosae.2014.30.5.461]

-
Park, S.S., J.Y. Hur, S.Y. Cho, S.J. Kim, and Y.J. Kim, (2007), Characteristics of organic carbon species in atmospheric aerosol particles at a Gwangju area during summer and winter, Journal of Korean Society for Atmospheric Environment, 23(6), p675-688, (in Korean with English abstract).
[https://doi.org/10.5572/kosae.2007.23.6.675]

-
Poschl, U., (2005), Atmospheric aerosols: composition, transformation, climate and health effects, Angewandte Chemie International Edition, 44(46), p7520-7540.
[https://doi.org/10.1002/anie.200501122]

-
Rosenstock, B., and M. Simon, (2003), Consumption of dissolved amino acids and carbohydrates by limnetic bacterioplankton according to molecular weight fractions and proportions bound to humic matter, Microbial Ecology, 45(4), p433-443.
[https://doi.org/10.1007/s00248-003-3001-8]

-
Scalabrin, E., R. Zangrando, E. Barbaro, N.M. Kehrwald, J. Gabrieli, and C. Barbante, (2012), Amino acids in Arctic aerosols, Atmospheric Chemistry and Physics, 12(21), p10453-10463.
[https://doi.org/10.5194/acp-12-10453-2012]

-
Wedyan, M.A., and M.R. Preston, (2008), The coupling of surface seawater organic nitrogen and the marine aerosol as inferred from enantiomer-specific amino acid analysis, Atmospheric Environment, 42(37), p8698-8705.
[https://doi.org/10.1016/j.atmosenv.2008.04.038]

-
Zhang, Q., and C. Anastasio, (2001), Chemistry of fog waters in California’s Central Valley, 3: concentrations and speciation of organic and inorganic nitrogen, Atmospheric Environment, 35(32), p5629-5643.
[https://doi.org/10.1016/s1352-2310(01)00337-5]

-
Zhang, Q., and C. Anastasio, (2003), Free and combined amino compounds in atmospheric fine particles (PM2.5) and fog waters from Northern California, Atmospheric Environment, 37(16), p2247-2258.
[https://doi.org/10.1016/s1352-2310(03)00127-4]

-
Zhang, Q., C. Anastasio, M. Jimenez-Cruz, (2002), Water-soluble organic nitrogen in atmospheric fine particles (PM2.5) from northern California, Journal of Geophysical Research-Atmospheres, 107(D11), p4112.
[https://doi.org/10.1029/2001jd000870]