흡착관과 캐니스터를 이용한 대기 중 휘발성유기화합물 측정방법의 비교 평가
Copyright © 2016 Korean Society for Atmospheric Environment
Abstract
This study was carried out to evaluate the performance of two sampling methods, i.e., adsorbent tubes and canisters, for the measurement of ambient volatile organic compounds (VOCs). A total of 24 target VOCs were selected from a list of 48 priority hazardous air pollutants (HAPs) in Korea. The two sampling methods were investigated with a wide range of performance criteria such as repeatability, linearity, and lower detection limits. In addition, mean relative errors (MRE) and mean duplicate precisions (MDP) were estimated by inter-lab comparison studies for duplicate field samples. Precisions for the two methods appeared to be well comparable with the performance criteria recommended by USEPA TO-15 and TO-17 for canister and adsorbent methods, respectively. Correlations and variations between the VOCs concentrations determined by the two methods were generally good in most cases. However, MREs and MDPs for individual VOCs appeared to be widely ranged, depending on each VOC. This implies that the two methods have its own advantages and disadvantages in determining a variety of VOCs in ambient air, and neither of which has absolute superiority. Finally, 9 of 24 VOCs were found to be difficult to determine by either methods due to their unstability in a canister, and lack of appropriate standard materials. Thus, it is suggested that development of measurement methods for such unstable VOCs is an urgent task from a viewpoint of HAPs management.
Keywords:
VOCs, BTEX, Canister, Adsorbent tube, Inter-lab comparison, QC/QA, GC/MSD1. 서 론
일반적으로 휘발성유기화합물 (volatile organic compounds, 이하 VOCs)이란 상온·상압에서 대기 중에 증기상으로 배출되는 유기화합물질을 통칭한다. 우리나라 「대기환경보전법」 제2조 제10에서는 ‘석유화학제품·유기용제 그 밖의 물질로서 환경부장관이 관계 중앙행정기관의 장과 협의하여 고시하는 것’으로 정의하고 있으며, 「휘발성유기화합물 규제제품 및 물질」 (환경부고시 제2012-130호, 2012.7.27)에 따라 아세트알데히드, 벤젠, 휘발유 등 37개 물질 및 제품을 규제대상으로 하고 있다. VOCs는 다양한 배출원에서 배출되는데 환경부 추산자료에 의하면 국내의 경우 유기용제사용분야가 전체 배출량의 62.1%를 차지하여 가장 큰 배출원이 되고 있으며, 다음으로 생산공정 등에서 18.3%, 도로·비도로 이동오염원에서 9.6%를 차지하는 것으로 알려져 있다 (Ministry of Environment, 2015).
VOCs의 환경학적 중요성은 일반적으로 두 가지 측면으로 요약할 수 있다. 첫째는 방향족 탄화수소나 할로겐화 탄화수소류와 같이 그 자체로 인체에 직접적으로 유해한 보건학적 측면과, 둘째는 올레핀계 탄화수소와 같이 그 자체로는 인체에 대한 직접적인 유해성은 크지 않으나 대기 중에서 질소산화물의 광분해반응에 관여하여 이차적으로 오존과 알데히드류와 같은 산화성 물질의 생성을 유발하는 소위 광화학 스모그의 전구물질로서의 역할을 들 수 있다 (Field et al., 1992).
이들 VOCs는 그 종류와 발생원이 복잡·다양할 뿐만 아니라 측정분석방법에 내재된 어려움으로 인하여 아황산가스나 먼지와 같은 다른 일반적인 대기오염물질에 비해 여러 가지 측면에서 적절한 관리가 힘든 항목으로 인식되어 왔다. 환경대기 중 존재하는 VOCs의 채취법은 크게 나누어 현장에서 시료의 채취와 분석을 동시에 병행하는 On-line 측정법 (Son et al., 2009; Badol et al., 2004)과 캐니스터 (canister)와 같은 적정용기를 사용하여 VOCs를 함유한 공기를 직접 채취하는 방법 (USEPA, 1999a; Na et al., 1998), 그리고 흡착제와 같은 매체 (media)를 사용하는 방법으로 구분할 수 있다 (Baek et al., 1999; USEPA 1999b; Woolfenden, 1997). 이처럼 여러 종류의 채취방법에서 적합한 방법을 선택하기 위해서는 실험목적과 용도, 분석대상물질의 성상, 습도와 기온, 채취대상물의 농도 범위 등과 같은 측정 장소의 환경 등을 특별히 고려해야 한다.
On-line 측정법은 도입부에 일정 형태의 저온응축장치를 갖춘 GC를 사용함으로써 공기를 직접 채취하여 채취현장에서 바로 분석하는 방법으로 비교적 최근에 개발된 방법이다. 이 방법은 시료의 저장이 필요 없으며 채취 즉시 분석이 가능하다는 장점이 있으나 채취현장에 GC와 같은 분석기계와 저온응축단계의 설정 시 사용되는 액체냉매 등을 구비해야 한다는 단점으로 인해 다양한 종류의 실험에 광범위하게 적용되지 못하고 사용범위가 제한되어 있는 실정이며 흔히 이동측정차량을 이용한 현장조사에서 많이 이용된다 (Son et al., 2009).
캐니스터와 같은 적정용기를 이용하여 채취매체의 사용없이 공기를 직접 채취하는 방법은 VOCs의 채취에 있어서 표준적인 방법으로 인식되고 있으며 현재는 미국 EPA의 환경오염공정시험법인 TO-14에서 일반 환경 대기 중 VOCs의 분석방법으로 사용되고 있다 (USEPA 1999a). 캐니스터 방법은 채취대상물에 대한 용기의 안정성이 가장 중요한 문제로 작용한다. 특히 채취대상물이 산화물, 질화물, 황화물을 함유했거나 극성물질일 경우에는 용기내부의 표면과 반응함으로써 artifact 생성과 상당한 시료손실이 야기될 수 있다. 따라서 캐니스터 방법은 일반적으로 비극성 물질을 대상으로 사용되며 미국 EPA의 TO-14에서도 주로 비극성 VOCs들을 적용 대상으로 권장하고 있다 (USEPA 1999a).
채취매체를 이용하여 환경대기 중 VOCs를 채취하는 방법에는 일반적으로 흡수액을 이용하는 임핀저법과 입상흡착제를 이용하는 흡착관 채취법으로 분류할 수 있다. 특정 유도시약을 함유한 흡수액을 이용하는 임핀저법은 주로 유기용매로 된 흡수액을 사용하는 관계로 시료의 증발 손실률이 크며 사용하기가 까다로워 포름알데히드나 아세트알데히드 등과 같은 저분자 카르보닐계 화합물들에 그 사용이 제한되어 왔다 (Hwang et al., 1998). 반면에 방향족과 같은 VOCs에 대해서는 상대적으로 분석의 감도를 높일 수 있고 사용범위가 다양한 흡착제를 이용하는 흡착관 채취법이 보다 많이 이용되고 있다. 최근에는 포름알데히드나 아세트알데히드 등의 카르보닐계 화합물의 경우에도 임핀저법의 사용 대신 특정유도시약을 코팅시킨 흡착제를 이용하는 경향이 두드러지고 있다 (Seo and Baek, 2011).
일반적으로 흡착관 채취방법은 유리나 스테인리스 스틸로 만들어진 관에 입상흡착제를 충전시킨 흡착튜브를 이용하며 이러한 형태의 채취법은 다시 펌프를 이용하여 공기를 흡입시켜 VOCs를 흡착제에 흡착시키는 능동식 방법과 오염물질의 농도구배에 따른 확산성을 이용하는 수동식 방법으로 구분된다. 수동식 방법은 주로 작업장 환경과 같은 특정 환경에서 사용되어 왔으며 경비가 저렴하고 사용하기 쉽다는 장점은 있으나 채취대상물의 흡착속도에 따른 부정확성이 단점으로 지적되고 있다 (Baek and Moon, 2004). 따라서 환경대기 측정에서는 상대적으로 농도 단위를 비교적 쉽게 산출할 수 있는 능동식 방법이 많이 이용되고 있다 (Woolfenden, 1997). 그러나 흡착관법은 반복 분석이 불가능하거나 사용하는 흡착제에 따라 파과 (break-through)발생유무를 점검해야 하는 등 나름대로의 단점도 없지 않다 (Baek and Moon, 2004). 이와 같이 VOCs 시료 채취방법은 현재까지는 어느 방법을 택하더라도 그 자체로 완벽하지는 않으며 방법마다 상호보완적인 장·단점을 가지고 있다. 이는 시료 채취방법에 따라 VOCs 측정 결과는 서로 다르게 나타날 수가 있다는 점을 시사한다. 따라서 일반적으로 환경대기 중에 저 농도로 존재하는 VOCs 측정에 있어서 분석정확도 및 정도관리의 평가는 매우 중요한 의미를 갖는다.
이러한 관점에서 본 연구에서는 환경 대기 중 VOCs 농도 측정을 위하여 현재 가장 많이 이용되고 있는 방법 중의 하나인 흡착제 방법과 캐니스터 방법을 실제 시료를 대상으로 여러 측면에서 비교 평가하고자 하였다. 이를 위하여 한 실험실 내의 분석정도관리뿐만 아니라 서로 다른 두 실험실 간의 분석정확도를 표준시료와 실제시료를 대상으로 각각 평가하였다. 연구대상물질은 일차적으로 환경보건학적 중요성이 큰 C6-C10영역의 주요 방향족화합물을 선정하였으며, 연구의 주된 내용은 크게 나누어 (i) 캐니스터/저온응축/GC/MS 방법의 성능평가, (ii) 흡착/열탈착/GC/MS 방법의 성능평가, (iii) 동시에 같은 장소에서 중복 채취된 VOCs 시료에 대한 실험실 간의 분석정확도 비교의 세 부분으로 구성된다. 마지막으로 본 연구에서는 아직 국내에서 시료 채취 및 분석방법이 확립되지 못한 일부 VOCs에 대한 측정가능성을 평가하여 그 문제점을 분석하고자 하였다. 결과적으로 본 연구에서 파악된 VOCs 측정방법에 내재된 문제점 및 측정 결과의 정확성에 대한 정량적인 정보는 향후 VOCs 자료의 이용과 해석에 있어서 뿐만 아니라, 이와 유사한 실험을 계획하고 있거나 진행 중인 타 연구자들에게도 유익한 정보를 제공해 줄 것으로 사료된다.
2. 재료 및 방법
2. 1 VOC 측정대상물질
본 연구에서는 환경부 지정 48종의 우선관리대상물질 중 환경학적 관심사가 높은 24개 물질을 측정대상물질 (target VOCs)로 선정하였다. 우선관리대상물질 48종과 특정대기유해물질 (hazardous air pollutants, 이하 HAPs) 포함 여부 및 연구대상물질 24종의 상세한 내용은 표 1에 나타내었다.
2. 2 캐니스터 방법에 의한 VOCs 측정
시료 채취에 사용될 캐니스터는 사전에 주입구에 소량의 물을 주입하고, 전용 세척장치에 연결한 다음 가열 진공배기 및 고순도 질소로 내부를 세척하였다. 캐니스터는 사용 전에 진공여부를 게이지로 확인하였으며, 캐니스터에 고순도 질소를 주입 후 24시간 후 내부 오염 여부를 확인하였다. 오염이 없는 상태가 확인된 캐니스터는 밀봉 후 다음 시료 채취 전까지 보관하였다.
현장 시료 채취는 캐니스터를 이용하여 3시간 채취하였다. 이때 캐니스터 내부의 압력은 -30 inchHg에서 -5 inchHg까지 변동하였다. 대기 시료 채취에는 오리피스와 질량유량조절기가 장착된 수동식 시료 채취장치 (XonTech. Inc., USA)를 사용하였다. 채취장치 입구에는 5 μm의 스테인리스 필터를 사용하여 공기가 걸러진 후 오리피스를 통하여 캐니스터로 공기 시료가 주입되게 하였다. 시료채취구는 사용 전에 연결부위와 내부를 고순도 질소가스로 세척하고, 유속을 30 mL/min로 조절하였다. 필터나 오리피스의 막힘으로 인하여 유속의 변화가 일어날 경우에는 즉시 유속이 교정된 채취기로 교체하여 시료를 채취하였다.
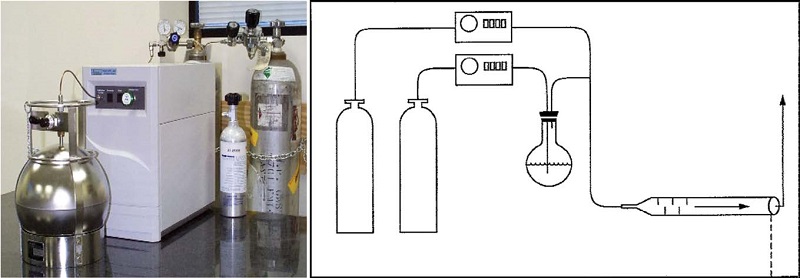
현재 캐니스터 용 VOCs 표준물질은 미국 Restek사에서 TO-15 (USEPA, 1999c)의 HAPs 표준물질로 상품화되어 있으나 본 연구의 대상물질 목록과 일치하지는 않는다. 따라서 본 연구에서는 VOCs 표준물질은 한국표준과학연구원에서 중량법으로 제조하여 사용하였다. 극성 VOCs의 경우에는 안정성이 확인되어 있지 않으므로 GC-FID의 상대 감응도를 이용하여 안정도를 주기적으로 확인하면서 표준시료를 제작하였다. 저 농도 (ppb 수준)의 표준시료는 그림 1과 같은 희석장치를 사용하여 제조하였다. 희석장치는 표준가스실린더와 제로가스 실린더를 유량조절장치를 통하여 매니폴더로 연결시키고 희석비율을 적절히 조절하면서 혼합된 표준가스의 농도를 조절하도록 구성되어 있다. 이때 제로가스는 캐니스터 내에 적절한 상대습도를 유지하기 위하여 수분공급장치 (humidifier)를 거치도록 하였다.
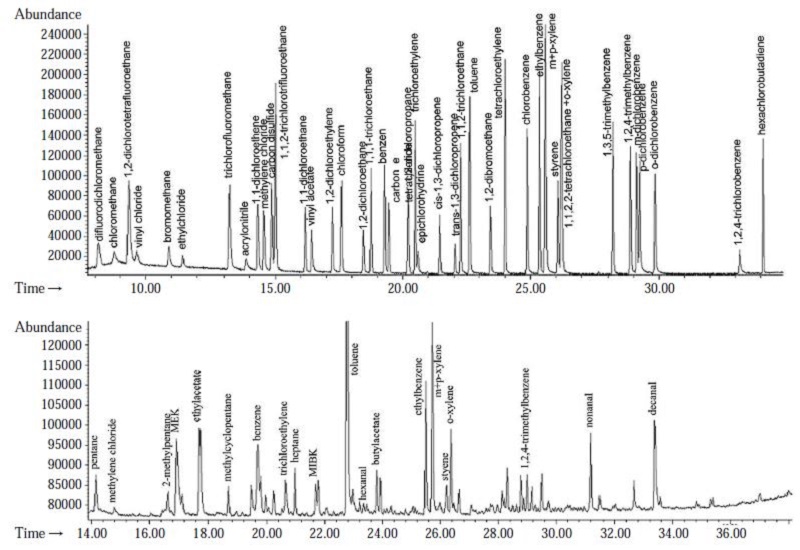
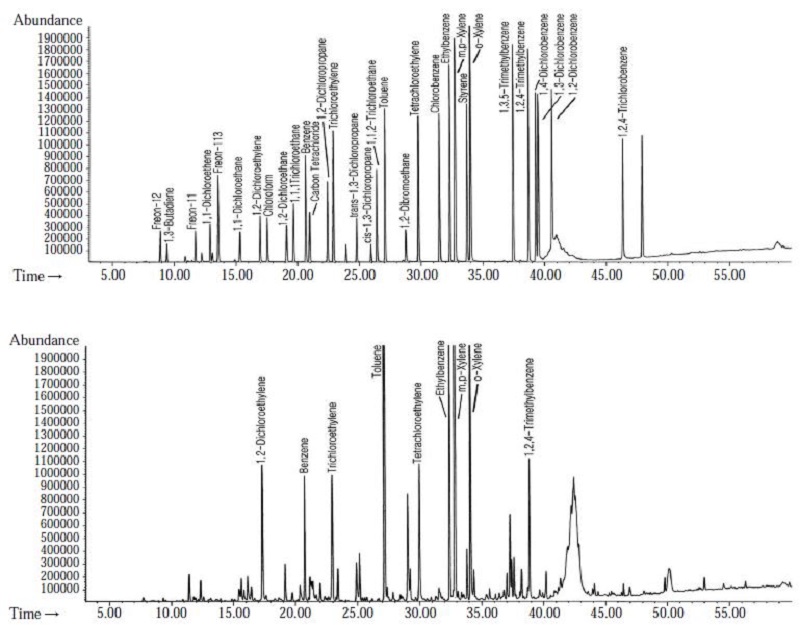
캐니스터 방법에 의한 VOCs 시료분석은 미국 EPA의 TO-15에 명시된 저온농축 GC/MS 방법으로 수행하였으며 GC/MS 분석조건은 표 2와 같다. 이와 같은 조건에서 분석한 표준시료와 실제 대기환경 시료에 대한 크로마토그램의 일례를 그림 2에 나타내었다.
2. 3 흡착관법에 의한 VOCs 측정
VOCs 시료 채취용 매체로는 다양한 종류의 유기물질에 대해 우수한 흡·탈착능을 가지고 있는 Carbotrap 400 mg을 스테인레스 스틸 흡착관 (1/4″×9 cm, Perkin Elmer, UK)에 충전하여 사용하였다. 이때 Carbotrap 흡착제 전단에 Carbotrap보다는 약한 흡착제인 Carbotrap-C 100 mg을 이중으로 충전하여 비교적 휘발성이 낮은 C10 이상의 고분자 유기물질이 Carbotrap에 흡착되어 탈착회수율이 저하되는 현상을 방지하였다. 본 연구에서 사용한 흡착관은 이미 국내·외에서 많이 사용되어 그 성능이 검증된 방법으로서 특히 독성 VOCs의 측정에 매우 보편적으로 이용되고 있다 (Baek and Moon, 2004; Baek et al., 1999; USEPA, 1997b).
흡착관의 전처리 과정 (cleaning 혹은 conditioning)이란 흡착제로 충전된 흡착관을 시료 채취에 사용하기 전에 불순물을 제거하는 과정을 의미한다. 본 연구에서는 흡착관 자동 전처리 장치인 TC-20 (Thermal Con-ditioner, Markers Inc., UK)을 이용하여 고순도 헬륨가스가 분당 80 mL/min으로 흐르는 조건 하에서 여러 단계 (250℃, 300℃, 350℃에서 각 1시간씩)로 전처리 과정을 수행하였다. 모든 흡착관은 전처리 후 1/4 인치 swagelok 타입의 마개와 PTFE 패럴로 막고 다시 이중 밀봉을 위해 septum이 달린 마개가 있는 50 mL 바이알에 넣어서 실온에서 보관하였다.
캐니스터 방법과의 비교를 위한 현장시료의 채취에는 자동연속시료채취장치인 STS25 (Perkin Elmer, UK)를 사용하였으며, 약 50 mL/min의 유량으로 흡착관 1개당 3시간 동안 시료를 채취하도록 계획하였다. 시료 채취 시 흡착관을 통과하는 유량은 전자식 초미량 유량계 (Ultraflow Electronic Calibrator, SKC Inc., USA)를 사용하여 현장에서 직접 측정하였다. 채취된 공기량의 산출은 시료 채취 전·후의 유량 측정치를 각각 3회 이상 실시한 후 평균하여 실제 현장시료의 농도 결정 시에 적용하였다. 전·후 유량에 대한 상대표준편차는 2% 이내의 높은 재현성을 보여 펌프의 흡인유량은 시료 채취기간 동안 거의 변화가 없었다.
흡착관을 이용한 VOCs의 정량·정성 분석에 사용된 기체상 표준혼합물질은 41종의 VOCs가 포함된 Restek사의 TO-14A용 표준혼합시료 (공칭 1 ppm)를 사용하였다. VOCs의 농도 정량을 위하여 자체 제작한 표준시료 함침 장치를 이용하여 표준혼합가스를 흡착관에 함침 받아 서로 다른 농도 수준의 표준시료를 마련하였다 (Baek and Moon, 2004). 표준시료의 제작 시에는 먼저 dummy 흡착관을 통하여 유량을 적정 범위 (대략 30 mL/min 범위)로 조정하여 안정화시킨 후, 3-way valve를 이용하여 기체의 흐름을 표준흡착관으로 전환시킨 후 통과시간을 조절하여 흡착되는 표준시료의 양을 조절하였다. 표준혼합가스가 흡착되는 동안 연결관 벽에 흡착이나 침적으로 인한 손실이 생기지 않도록 가스가 흐르는 동안 리본히터를 이용하여 연결관을 40℃ 이상이 되도록 유지하였다.
표준시료 및 현장시료에 함유된 VOCs의 분석에는 자동열탈착장치 (ATD-400, Perkin Elmer, UK)가 GC칼럼 (Rtx-1, 0.32 mm×105 m×1.50 μm)으로 직접 연결된 GC/MS (HP 6890/5973)시스템을 사용하였다. 분석에 사용된 ATD-400과 GC/MS의 운전조건은 표 3에 나타내었다. 위와 같은 조건에서 분석된 표준 시료와 실제 현장시료에 대한 크로마토그램에 대한 일례는 그림 3에 나타내었다.
3. 결과 및 고찰
3. 1 캐니스터 방법의 성능평가
캐니스터 방법에 의한 측정정도관리 결과는 표 4에 나타내었으며 그 결과를 요약하면 다음과 같다. 상대표준편차 (relative standard deviation, 이하 RSD)로 표현한 분석재현성은 1~10 ppb 농도수준에서는 평균 2% 수준이었으나 0.1~1 ppb 수준에서는 약 4% 수준으로 나타났다. 저 농도 수준의 자료에 대한 신뢰성을 검증하기 위해 각 분석대상물질의 방법검출한계 (method detection limits, 이하 MDL)는 아래와 같이 추정하였다 (USEPA, 1990).
방법검출한계 (MDL)=t(n-1, 0.01)×S.D.
여기서 t(n-1, 0.01)는 자유도 n-1, 1% 유의수준에서의 student-t 값이며 n은 반복분석횟수를 의미한다. 캐니스터 방법의 MDL은 전 항목이 0.05 ppb 이하로 나타났으며 이를 근거로 실제 정량한계는 대략 0.1 ppb 수준으로 추정하였다. 또한 검량선의 상관계수는 모두 0.98 이상으로 나타났다.
3. 2 흡착관 방법의 성능평가
캐니스터 방법과 함께 VOCs 측정에 사용된 흡착관/열탈착/GC/MS 방법의 전반적인 성능을 평가하기 위하여 재현성, 시료의 검출저한계 및 실제 현장에서의 중복 시료 채취를 통한 중복재현성을 평가하였다. 분석방법의 재현성은 표준혼합시료의 감응계수 (response factor)에 대한 RSD로 평가하였으며 그 결과는 표 5에 요약하였다. 부피농도로 추정된 MDL값은 질량기준의 MDL값을 기준으로 실제시료에 대한 공기채취량 평균치인 15 L를 채취한 것으로 가정하여 환산하였다. 검출한계를 추정한 결과 대부분의 VOCs에 대하여 캐니스터 방법과 유사한 0.01~0.10 ppb의 범위로 나타났다. 농도 환산과정에서 분자량이 미치는 영향으로 인해 방향족 탄화수소 보다 유기염소계 물질의 검출한계가 상대적으로 높게 나타나고 있다.
일반적으로 미국EPA의 TO-17 (흡착-열탈착에 의한 VOC 공정시험법)에 의하면 시료 채취과정의 타당성을 검토하기 위하여 동일한 지점에서 동일한 조건으로 시료를 채취하여 동일한 방법으로 분석된 두 시료는 이론적으로 동일한 결과를 나타내어야 한다고 언급하고 있다. 이때 두 시료 간의 일치성을 중복재현성 (duplicate precision)이라 정의한다. 즉, 중복재현성=(|X1-X2|/X)×100으로 정의되며, 여기서 X1은 첫 번째 시료의 측정치, X2는 두 번째 시료의 측정치, X는 두 시료의 평균값을 나타낸다. 본 연구에서 VOCs 개별물질에 대한 중복재현성을 평가한 결과도 표 5에 나타내었다. 전반적으로 benzene, toluene, trichloroethylene 등과 같이 환경적으로 중요한 독성 물질들은 30% 이내의 양호한 결과를 보이고 있다. 참고로 미국 EPA 시험법에 따르면 중복재현성은 30% 이내 수준을 유지하도록 권고하고 있다 (USEPA, 1999b).
3. 3 캐니스터법과 흡착관법의 VOC 측정 결과 비교
본 연구에서는 캐니스터 방법과 흡착관법을 비교 평가하기 위하여 동일한 시간대에 동일한 장소에서 시료를 채취하여 두 시료를 서로 독립적으로 분석하여 그 결과를 비교하였다. 비교 평가를 위하여 2006년 봄철에 시화반월지역에서 얻어진 총 53쌍의 환경대기 (ambient air) 시료를 대상으로 하였으며, 그 결과는 표 6에 요약하였다. 또한, 이들 두 방법으로 얻어진 주요 VOCs에 대한 상관분석을 수행한 결과는 그림 4에 나타내었다. 그림에는 검출빈도가 높고 비교적 농도가 높게 나온 물질들을 대상으로 나타내었으며, 측정 결과 중앙값이 검출한계 이하로 나올 정도의 낮은 수준의 물질들은 비교 대상에서 제외하였다. 상관분석 결과 benzene, toluene, ethylbenzene, xylenes (이하 BTEX) 및 trichloroethylene 등은 대체로 양호한 상관성 (약 0.7에서 0.9 이상의 상관계수)을 확인할 수 있었다. 그러나 이들 물질들보다 휘발성이 강한 methylene chloride는 상관계수가 0.5 정도로 떨어지는 결과를 보였다. 기존의 연구에서도 흡착관법의 경우 휘발성이 강한 물질들의 측정 불확도는 상대적으로 커진다고 보고된 바가 있다 (Baek and Moon, 2004).
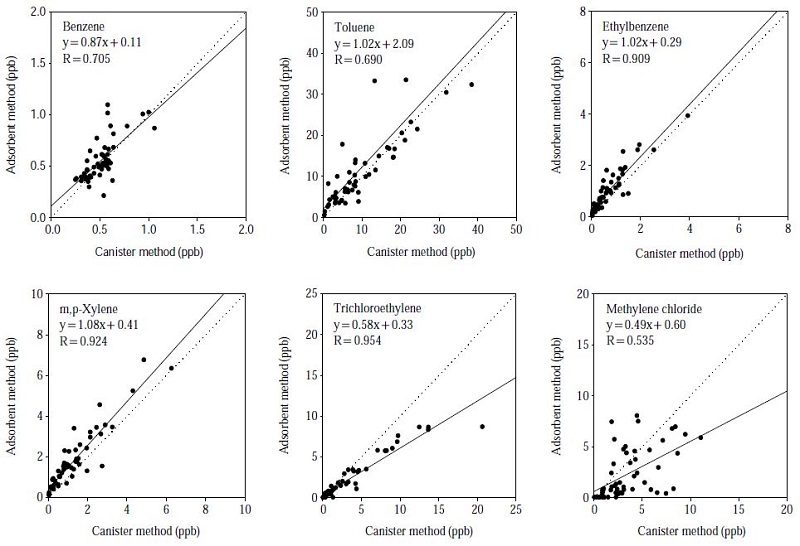
Correlations between the VOCs measurement concentrations determined by canister and adsorbent sampling methods.
그러나 두 방법 간의 상대적인 정확성을 평가하는 데는 반드시 상관성만을 고려하여 평가할 수는 없다. 그 이유는 정확성은 근접하는 정도로 평가할 수 있으므로 상관성이 나쁘더라도 두 측정값이 어느 정도 근접하는가에 따라 방법의 성능을 평가하여야 하기 때문이다. 이러한 측면에서 두 측정 결과에 대하여 시계열성을 고려한 변동양상 (경향)을 비교하였으며, 그 결과는 그림 5에 나타내었다. 그림에서 볼 수 있듯이 두 방법 간의 시계열 변동 양상은 매우 유사한 경향을 보이고 있다. 간혹 일부 고농도 시료에 대하여 (예를 들면 toluene이나 styrene의 경우) 흡착관법의 농도를 캐니스터 시료가 대응하지 못하는 문제점이 있으나 전체적으로는 농도가 상승하고 감소하는 경향은 유사한 것으로 나타났다. 특히 주요 독성 VOCs 중의 하나인 trichloroethylene은 두 방법 사이에 매우 일치하는 결과를 보였으며, benzene과 함께 향후 대기환경기준을 설정할 경우 비용-효과 및 시료취급의 용이성 측면에서 캐니스터 방법보다 상대적으로 유리한 흡착관 방법으로 측정하여도 큰 문제가 없을 것으로 판단된다. 그러나 methylene chloride의 경우 휘발성이 강한 물질이어서 흡착관법으로 측정할 경우 파과 혹은 열탈착 시에 발생하는 불확실 요인이 다른 물질보다는 상대적으로 큰 것으로 보인다. 이 점은 흡착제 선정을 적절히 하면 어느 정도 개선할 수 있을 것으로 사료된다. 1,2,4-trimethylebenzene의 경우 캐니스터 시료와 흡착관 시료 사이에 비교적 차이가 큰 것을 알 수 있는데, 전체적인 농도 수준이 1.0 ppb 이하로서 매우 낮은 농도에서 분석결과의 불확도가 증가함에 따른 영향으로 볼 수 있다.
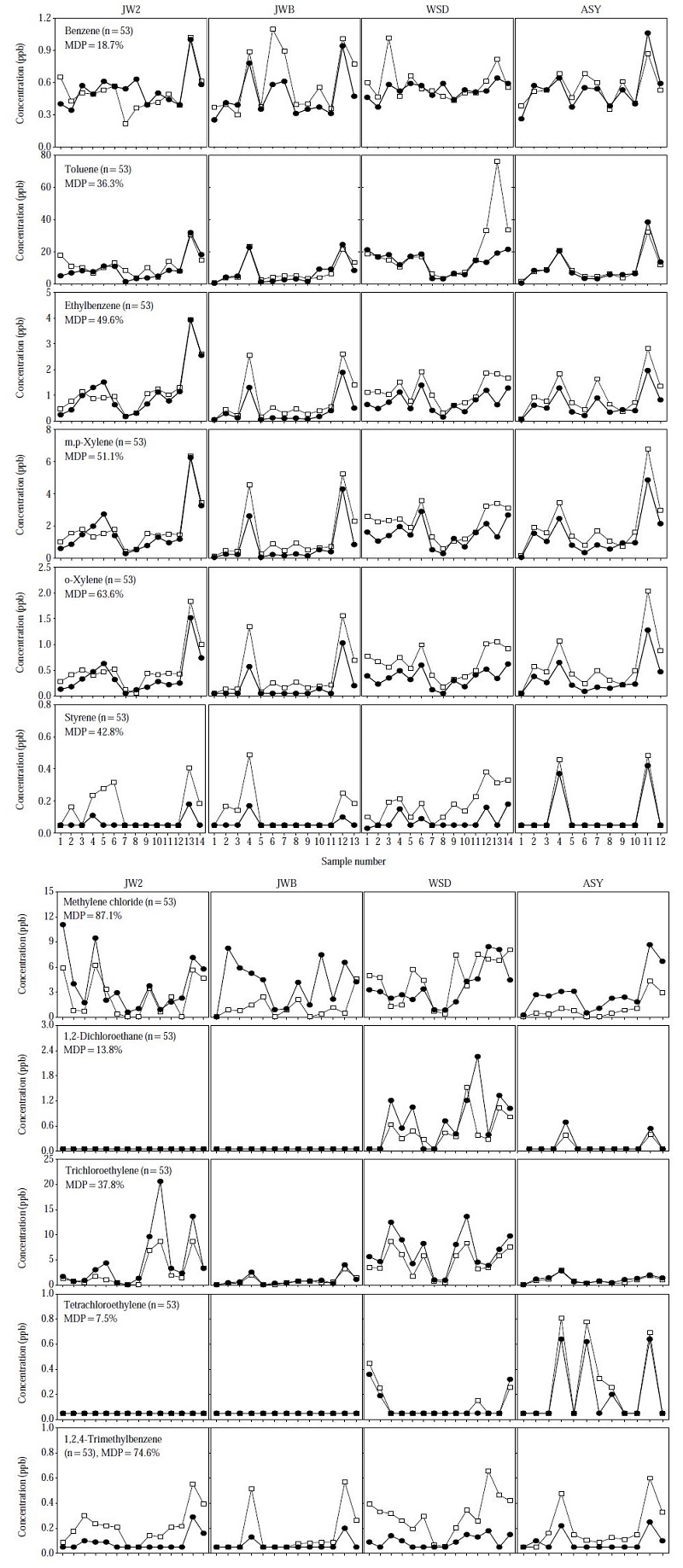
Comparison of VOCs concentrations determined by adsorbent tubes (white dots) and canister (black dots) sampling: JW2 (Jungwang-2-dong), JWB (Jungwang-bon-dong), WSD (Wonsi-dong), ASY (Ansan-Yeok).
이상과 같은 비교분석 결과를 종합하여, 두 표본집단에 대하여 각종 통계적 유의성 검정을 하였으며, 그 결과를 표 7에 요약하였다. 평균중복재현성 (mean duplicate precision, 이하 MDP), 평균상대정확도 (mean relative error, 이하 MRE), 평균에 대한 모수검정법 (t-test 및 paired t-test), 그리고 중앙값에 대한 비모수검정법 (Wilcoxson rank sum test, 이하 WRST) 등 매우 다양한 방법으로 두 방법의 일치성을 평가한 결과, 환경대기 기준이 마련된 벤젠의 경우 20% 수준의 상대오차를 보이고 있어 매우 양호한 결과를 얻을 수 있었다. 그러나 toluene, ethylbenzene, xylenes, styrene 등과 같은 물질들은 어느 방법을 기준으로 보는가에 따라 상대오차가 큰 편차를 보이고 있으며 중복재현성 역시 물질에 따라 큰 편차를 보이고 있다. 이는 두 방법의 구조적인 차이점에서 기인하는 현상으로서 아직은 어느 방법이 더 정확한 가에 대한 명확한 판단기준은 없다. 특히 toluene, ethylbenzene, xylenes 등은 대기환경 중에서 검출빈도도 높고 농도도 높게 나타나 비교적 측정이 쉬운 물질로 알려졌는데 벤젠에 비하여 상대오차가 크게 나타난 점은 예상치 못한 결과이다. 주어진 결과만을 근거로 볼 때 이러한 상대오차 유발의 주된 요인은 그림 5에 나타낸 원시동 (WSD) 지점의 12번과 13번 시료의 영향일 것으로 추정된다. 그러나 VOCs의 경우 아직 제 3자 기관의 표준참조물질 (standard refrerence materials, 이하 SRM)이 공급되지 않는 상황에서 현재로서는 과연 어느 방법이 오차를 유발하였는지를 단정하기는 어렵다.

Statistical summary of comparison studies for VOCs data determined by canister and adsorbent tube methods.
표 7에 수록된 통계적 검정방법 중 t-test는 두 표본의 산술평균의 차이에 대한 검정법이며, paired t-test는 각 대응시료 간의 차이의 산술평균이 제로와 같은가에 대한 검정법이므로 비록 유의적인 결과가 얻어졌다고 하더라도 궁극적으로는 두 방법의 일치성을 보장하는 지표가 되지는 않는다. WRST 역시 대표치로 산술평균이 아닌 중앙값을 사용했다는 점 이외에는 그 검정결과의 해석은 t-test의 결과와 크게 다르지 않다. 그럼에도 불구하고 서로 다른 두 집단 자료의 유사성을 비교 평가하기 위해서는 이와 같은 다양한 방법을 통해서 종합적으로 검토할 필요가 있으며 표 7에 나타낸 수치들 하나하나에 절대적인 의미를 부여할 이유는 없다고 판단된다. 따라서 향후 VOCs 측정 자료의 해석에 있어서 어떤 방법으로 시료가 채취되었는가를 명시하는 것은 매우 중요한 사안일 것으로 사료되며 두 자료를 혼용하여 사용할 때는 반드시 본 연구와 같은 비교실험을 수행한 결과를 근거로 전반적인 불확도에 대한 정보를 제공하는 것이 바람직하다고 사료된다.
3. 4 우선관리대상 VOCs에 대한 측정가능성 평가
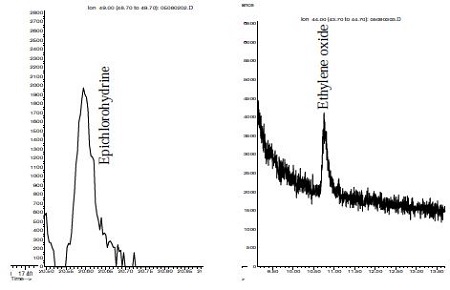
본 연구에서는 표 1에 나타낸 24종의 측정대상 VOCs에 대하여 환경대기시료에 대하여 캐니스터 혹은 흡착관법으로의 측정가능성을 평가하였다. 이들 물질 중 측정 가능한 성분과 불가능한 성분은 아래와 같이 분류하여 다음과 같은 4가지 부류로 구분하였다. 첫째, 상업용 가스상 표준물질이 있으며 캐니스터 및 흡착관으로 측정이 가능한 물질은 1,3-butadiene, acrylonitrile, vinyl chloride, dicholomethane, vinyl acetate, carbon disulfide, benzene, chloroform, styrene, 1,2- dichloroethane, carbon tetrachloride, ethylbenzene, trichloroethylene, tetrachloroethylene 등 총 14종이었다. 둘째, 가스상 표준물질이 공급되지 않아 자체 제작하여 캐니스터 방법으로 측정을 시도하였으나 안정도와 검출 감도 등에 문제가 있어 정성 및 정량 분석이 어려운 물질은 epichlorohydrine, ethylene oxide, propylene oxide, nitrobenzene 등 4종으로 나타났다. 이들 물질들은 그림 6에 예시한 바와 같이 특성이온 크로마토그램이 매우 불안하게 나타남을 알 수 있다. 셋째, phenol, aniline, acrylamide, dimethyl sulfate, phosgene 등 5종은 휘발성, 흡착성, 수용성 등으로 인해 가스상 표준시료 제조 자체가 어려운 물질로서 별도의 방법이 개발되어야 할 것으로 사료된다. 마지막으로 acrolein은 GC/MS로 분석이 어려운 물질이었으나 HPLC 방법으로는 충분히 가능한 물질이므로 카보닐 시료와 같이 취급하면 측정상 어려움은 없을 것으로 판단된다.
한편, 미국 EPA의 TO-15 방법에 의하면 약 90여종의 HAPs를 캐니스터 방법으로 측정 가능하다고 문서화되어 있다 (USEPA, 1999c). 그러나 Kelly and Holden (1995)의 연구에 의하면 aniline, epichlorohydrin, phenol, phosgen 등은 캐니스터 내에서의 안정성 문제로 분석이 사실상 어려운 물질로 조사된 바 있다. 이는 본 연구의 결과와 대체로 맥락을 같이 한다고 볼 수 있다. 따라서 이들 물질에 대한 측정방법을 개발하는 것은 향후 HAPs 관리 측면에서 매우 시급하고 중요한 과제라고 사료된다.
4. 결 론
본 연구에서는 VOCs 시료 채취에 사용되는 캐니스터 방법과 흡착관법을 비교 평가하기 위하여 각 방법의 성능을 실험실 내에서 평가한 후, 동일한 시간대에 동일한 장소에서 채취된 53쌍의 시료를 서로 다른 실험실에서 독립적으로 분석하여 그 결과를 비교하였다.
비교 평가에 포함된 VOCs 물질은 검출빈도가 높고 비교적 농도가 높게 나온 물질들을 대상으로 하였으며, 상관분석 결과 두 방법 간에 대체로 양호한 상관성 (0.7에서 0.9 이상)을 확인할 수 있었다. 그러나 휘발성이 강한 다이클로로메탄은 다른 VOCs에 비해서는 상관성이 떨어지는 결과를 보였다. 두 방법 간의 시계열 변동 양상 역시 매우 유사한 경향을 보였으며, 주요 독성 VOCs 중의 대표적인 물질인 벤젠은 두 방법의 측정 결과가 20% 이내에서 양호하게 근접하는 것으로 나타났다. 그러나 toluene, ethylbenzene, xylenes, styrene 등과 같은 물질들은 어느 방법을 기준으로 보는가에 따라 상대오차가 큰 편차를 보이고 있으며 중복재현성 역시 물질에 따라 큰 편차를 보이고 있다. 따라서 향후 VOCs 측정 자료의 해석에 있어서 어떤 방법으로 시료가 채취되었는가를 명시하는 것은 매우 중요한 사안이며, 특히 두 자료를 혼용하여 사용할 때는 전반적인 불확도에 대한 정보를 제공하는 것이 필요하다고 사료 된다.
환경부 우선관리 HAPs 목록에 포함된 주요 VOCs에 대하여 환경대기 시료를 대상으로 캐니스터 혹은 흡착관법으로의 측정가능성을 평가한 결과, BTEX를 포함하는 14종의 VOCs는 두 방법 모두 측정 가능한 것으로 평가되었다. 그러나 epichlorohydrine, ethylene oxide, propylene oxide, nitrobenzene, phenol, aniline, acrylamide, dimethyl sulfate, phosgene 등 9종은 표준가스 공급 및 안정성 문제 등으로 현재로서는 정확한 측정 결과를 얻기가 어려운 항목으로 평가되었다. 따라서 이들 물질에 대한 측정기술개발은 대기공정시험기준 마련의 차원에서 시급한 과제라고 할 수 있다.
Acknowledgments
본 연구는 국립환경과학원의 2005년 ‘시화반월지역 유해대기오염물질 조사연구’의 일부로 수행되었습 니다.
References
-
Badol, C., A. Borbon, N. Locoge, T. Leonardis, and J.C. Galloo, (2004), An automated monitoring system for VOC ozone precursors in ambient air: development, implementation and data analysis, Analytical and Bioanalytical Chemistry, 378(7), p1815-1824.
[https://doi.org/10.1007/s00216-003-2474-0]

- Baek, S.O., and Y.H. Moon, (2004), Evaluation of adsorbent sampling methods for volatile organic compounds in indoor band outdoor air, Journal of Korean Society for Atmospheric Environment, 17(6), p496-513, (in Korean with English abstract).
- Baek, S.O., S.M. Hwang, S.K. Park, S.J. Jeon, B.J. Kim, and G.S. Heo, (1999), Evaluation of methodology for the measurement of VOCs in the Air by adsorbent sampling and thermal desorption with GC analysis, Journal of Korean Society for Atmospheric Environment, 15(2), p121-138, (in Korean with English abstract).
-
Field, R., M. Goldstone, J. Lester, and R. Perry, (1992), The sources and behaviour of tropospheric anthropogenic volatile hydrocarbons, Atmospheric Environment, 26A, p2983-2996.
[https://doi.org/10.1016/0960-1686(92)90290-2]

- Hwang, Y.J., S.G. Park, and S.O. Baek, (1998), Comparison of chromatropic acid method and DNPH-HPLC method for the measurement of formaldehyde in the air, Journal of Korean Society for Atmospheric Environment, 14(5), p121-138, (in Korean with English abstract).
-
Kelly, T.J., and M.W. Holden, (1995), Applicability of canister for sample storage in the determination of hazardous air pollutants, Atmospheric Environment, 29(19), p2595-2608.
[https://doi.org/10.1016/1352-2310(95)00192-2]

- Ministry of Environment (MoE), (2015), White Paper of Environment, p609, (in Korean).
- Na, K.S., Y.P. Kim, K.C. Moon, S.O. Baek, S.M. Hwang, S.R. Kim, K. Fung, K.B. Leem, and H.Y. Park, (1998), Comparison of sampling and analysis methods fo volatile organic compounds in ambient air, Journal of Korean Society for Atmospheric Environment, 14(5), p507-518, (in Korean with English abstract).
-
Seo, Y.K., and S.O. Baek, (2011), Characterization of carbonyl compounds in the ambient air of an industrial city in Korea, Sensors, 11, p949-963.
[https://doi.org/10.3390/s110100949]

-
Son, E.S., Y.K. Seo, D.H. Lee, M.D. Lee, J.S. Han, and S.O. Baek, (2009), A study on the performance optimization of a continuous monitoring method for hazardous VOCs in the ambient atmosphere, Journal of Korean Society for Atmospheric Environment, 25(6), p523-538, (in Korean with English abstract).
[https://doi.org/10.5572/KOSAE.2009.25.6.523]

- USEP, (1990), Definition and procedure for the determination of the method detection limit, Code of Federal Regulations, Part 136, Appendix B, p537.
- USEPA, (1999a), Compendium of Methods TO-14A, Determination of volatile organic compounds in ambient air using specially prepared canisters with subsequent analysis by gas chromatography, 2nd Ed, EPA/625/R-96/010b.
- USEPA, (1999b), Compendium of method TO-17, Determination of volatile organic compounds in ambient air using active sampling onto sorbent tubes, 2nd Ed, EPA/625/R-96/010b.
- USEPA, (1999c), Compendium of Methods TO-15, Determination of volatile organic compounds (VOCs) in air collected in specially-prepared canisters and analyzed by gas chromatography/mass spectrometry (GC/MS), 2nd Ed, EPA/625/R-96/010b.
-
Woolfenden, E., (1997), Monitoring VOCs in air using sorbent tubes followed by thermal desorption-capillary GC analysis, Journal of Air and Waste Management Association, 47, p20-36.
[https://doi.org/10.1080/10473289.1997.10464411]