불산 누출 사고 시 불산에 노출된 식물잎을 이용한 대기 중 불화수소 농도 추정
Copyright © 2016 Korean Society for Atmospheric Environment
Abstract
The leaves of three plant species, such as soybean, raspberry, and kudzu, exposed to hydrogen fluoride was collected in an area surrounding an emission source where the release accident occurred. The ultrasonic-assisted extraction and analysis of fluoride by ion chromatography was carried out. The mean concentration of fluoride in the leaves of three plant species exposed to hydrogen fluoride was 5,409±1,198 mg F/kg dry wt and 788±339 mg F/kg dry wt, respectively. The mean fluoride concentration in ambient air were estimated to be 2.36±0.65 mg/m3 (2.89±0.79 ppm) and 0.35±0.15 mg/m3 (0.43±0.19 ppm) in exposed and unexposed sites, respectively. It seems likely that the passive monitoring using plant leaves could identify with respect to plant risk by fluoride in atmosphere.
Keywords:
Hydrogen fluoride, Airborne fluoride, Release accident, Plant leaves, Passive monitoring1. 서 론
불소는 자연적 또는 인위적인 (man-made) 활동에 의해 환경에 존재하는 주요 오염물질 중 하나이다. 불소의 자연적인 배출원은 풍화, 무기염류의 용해, 화산활동 및 강우의 순환을 통한 배출 등이다 (Brindha and Elango, 2011). 가스 및 입자 형태의 불소는 알루미늄 제련소 및 인산비료 공장 등을 비롯한 많은 배출원에서 대기 중으로 배출된다 (Weinstein and Davison, 2004; NAS, 1971). 배출된 가스 형태의 불소는 잎의 기공을 통해 흡수되고, 입자 형태의 불소는 잎의 표면에 부착된다.
대기 중에 존재하는 불소는 환경에 미치는 영향이 상당히 큰 오염물질 중 하나로 일반적인 대기오염물질과 비교하여 상당히 독성이 큰 물질이다. 따라서 대기 중으로 아주 적은 양이 누출되더라도 식물 등 주변 환경에 미치는 영향은 크게 나타날 수 있다 (Weinstein et al., 1998). 일반적으로 대부분의 식물종에는 불소가 1~10 μg F/g dry wt의 범위로 존재하지만, 불소가 높은 농도로 존재할 경우, 생리학 및 생화학적 반응에 중요한 역할을 하는 다양한 무기염류의 구성비를 변화시켜 식물종에 영향을 미친다 (Weinstein and Davison, 2004). 최근에는 불소 자체의 독성뿐만 아니라 환경계로의 누출로 인한 인간 및 주변 환경에 미치는 영향이 크다고 알려져 있기 때문에 물, 토양 및 식물 등 다매체에서의 불소 오염에 대해 관심이 높아져 많은 연구가 이루어지고 있다 (Brougham et al., 2013; Saini et al., 2013; Koblar et al., 2011; Rey-Asensio and Carballeira, 2007; Mezghani et al., 2005; Vike, 2005; Notcutt and Davies, 2001).
구체적으로 알루미늄 제련소에서는 알루미늄 제련을 위한 합성 빙정석(Na3AlF6)을 제조하는 데 불산을 사용하며, 이러한 빙정석은 제련공정에서 전해질로 이용하고 있다 (Vike, 1999). 따라서, 다양한 식물종을 이용하여 알루미늄 제련소와 같이 대규모 사업장의 산업공정에서 대기 중으로 배출되는 대기 중 불소를 모니터링 한 많은 연구결과가 보고되고 있다. 알루미늄 제련소 주위에 서식하고 있는 Hypnum cupressiforme Hedw. 및 Scleropodium purum (Hedw.) Limpr와 같은 이끼류에서의 불소 수준을 조사하였으며, 배출원으로부터의 이격거리가 불소 농도에 큰 영향을 미치는 것으로 나타났다 (Real et al., 2003). 한편, 알루미늄 제련소를 기준으로 주풍향의 방향에 위치하고 있는 식물 (옥수수잎과 꽃)에서의 불소 농도 (159~1,392 mg/kg)는 배경 농도 (6.0~8.0 mg/kg)보다 상당히 높은 것으로 나타났다 (Koblar et al., 2011). 알루미늄 제련소의 운전정지 후 풀, 낙엽성 식물, 상록수 및 지의류와 같은 식물에서의 불소 농도를 풍상 방향 (38 mg F/kg)과 풍하 방향 (2,387.2 mg F/kg)에서 조사하였다. 또한, 풍하 방향에서 채취한 모든 시료에서의 평균 불소 농도는 36주 후까지 감소하는 경향을 나타내었다 (Brougham et al., 2013).
이와 같이 대표적인 불소 배출원인 알루미늄 제련소를 중심으로 한 주변에서 채취한 다양한 식물종에서의 불소 농도는 큰 차이가 나타났다. 이러한 결과로부터 식물에 축적된 불소 농도는 배출원으로부터의 이격거리 및 바람 방향과 상관성이 높은 것으로 나타났다. 그러나 온도 및 강우량과 같은 기상요소는 불화수소 생산공장 주위에 서식하는 풀에서 측정한 불소 농도에 영향을 미치지 않는 것으로 나타났다 (Franzaring et al., 2007). 높이, 수령, 잎의 거칠기 및 형태, 대기오염물질에 대한 내성과 같은 식물의 특성은 불소를 포함한 대기오염물질의 축적에 중요한 역할을 한다 (Mezghani et al., 2005).
한편, 우리나라에서도 불산의 취급과정에서 누출 사고가 빈번하게 발생하여 주변 환경에 큰 피해를 유발하였고, 불산 누출에 따른 인간을 비롯한 식물, 토양, 물 등 환경에 미치는 영향에 대한 연구가 이루어지고 있으나, 그 측정자료는 일부 지역에 한정되어 있어 다양한 지역 및 상황에 따른 측정자료가 아직 부족한 실정이다 (Kim et al., 2015; Kwon et al., 2015; Koh et al., 2014; Gu et al., 2013; Kim et al., 2013).
본 연구에서는 불산 누출 사고 후 피해를 입은 식물잎을 채취하여 식물잎에 피해를 입힌 불소의 농도를 초음파 (ultrasound) 추출법과 이온크로마토그래피 (ion chromatography)법을 이용하여 초음파 파워에 따른 추출량의 변화, 초음파 추출시간의 결정 및 초음파 추출을 포함한 추출방법에 대해 검토하고, 식물잎에 축적된 불소 농도를 산출하여 대기 중 불화수소 농도를 추정함으로써 불산 누출 시의 대기오염 정도에 대한 기초적인 자료를 제공하고자 한다.
2. 실험 방법
2. 1 실험 재료
그림 1과 같이 불산 누출에 의해 직접 피해를 입은 콩과 덩굴식물잎 (Soybean), 산딸기잎 (Raspberry), 칡덩굴잎 (Kudzu vine)은 불산 누출 사고가 발생한 사업장의 누출 지점에서 풍하 방향으로 5~20 m 이격된 지점에서 채취하였으며, 불산에 직접 노출되지 않은 칡덩굴잎 및 깻잎 (Perilla)은 풍상 방향으로 배출원에서 약 500 m 이격된 거리에서 채취하였다. 모든 시료는 누출 사고 발생 후 1일 이내에 채취하였다. 불산 누출 사고 (약 2분간 무수불산 3.6~7.2 kg이 누출된 것으로 추정됨)가 발생한 이 사업장은 반도체, 태양광 셀, LED 등의 생산과 관련된 화학소재를 생산하고 있는 사업장으로 공정상 불산을 이용하고 있기 때문에 이 지역 대기 중 불소의 주요 배출원이라고 할 수 있다.
채취한 식물잎은 표면에 존재하는 먼지 등 오염물을 제거하기 위해 증류수로 가볍게 세척한 후 70℃의 건조기에서 24시간 동안 건조시켰다. 건조한 식물잎은 막자 사발을 이용하여 곱게 분쇄한 후 채 (20 mesh aperture sieves)로 걸러 추출용 시료로 하였다.
2. 2 추출 방법
다양한 식물잎으로부터 원하는 성분을 높은 효율로 추출하기 위한 초음파 추출방법은 오래전부터 보고되고 있다 (Vinatoru, 2001; Fred Schurig and Sole, 1967; Ovadia and Skauen, 1965; Thompson and Sutherland, 1955). 본 연구에서 초음파를 이용한 추출은 초음파 반응조 (frequency: 40 kHz, input power: 500 W, 20 L, SD-D300H, Sungdong, Korea)를 이용하여 수행하였다. 초음파 조사에 의해 유도된 캐비테이션 효과가 최대화되는 지점을 선정하여 추출반응기를 위치시키기 위해 초음파 반응조 내에 알루미늄 호일을 수직으로 넣어 초음파를 조사한 후 위치별 손상 부위 및 개수를 파악하였다. 즉, 알루미늄 호일의 손상부위가 심한 반응조 내 위치에 추출용기를 위치시켜 추출을 수행하였다. 추출은 250 mL 추출용 유리용기에 분쇄한 식물잎 0.5 g과 초순수 100 mL를 넣어 초음파 추출을 수행하였으며, 추출 시 밀폐상태를 유지하였다. 단순 혼합에 의한 추출은 진탕기 (SWB-03, Jeio Tech, Korea)를 이용하여 20℃에서 200 rpm의 속도로 3시간 동안 수행하였다. 가열에 의한 추출은 전기가열기 (a heavy-duty electric hotplate, MS-300HS, Misung, Korea)를 이용하여 60℃에서 3시간 동안 수행하였다.
2. 3 분석 방법
불소 (F-) 분석을 위해 추출용액을 185-mm 5A 여지 (Advantec Toyo, Japan)를 이용하여 여과한 후, 이온크로마토그래프 분석을 위해 Dionex OnGuard II RP cartridge (Thermo Scientific, USA)를 이용하여 전처리하였다. 전처리 과정은 먼저 카트리지를 15 mL의 메탄올 (for HPLC, ≥99.9%, Sigma-Aldrich)로 활성화시키고 20 mL의 초순수로 세척한 후 추출한 시료를 카트리지에 주입하였다. 식물잎에서 추출한 불소량을 정량하기 위해 전기전도도 검출기와 AS14 컬럼 (4×250 mm, Dionex IonPacTM)이 장착된 이온크로마토그래프 (DX-120, Dionex)를 사용하였다. 용리액은 1.0 mM NaHCO3 (ACS reagent, ≥99.7%, Sigma-Aldrich)와 3.5 mM Na2CO3 (ACS reagent, ≥99.5%, Sigma-Aldrich)를 제조하여 사용하였다. 불소를 정량하기 위한 검량선은 이온크로마토그래프용 불소 표준물질 (1,000 mg F-/L±4 mg F-/L, Fluka)을 이용하여 0 mg/L~10 mg/L까지 5단계의 검량선용 표준용액을 제조하여 작성하였으며, 이 농도범위에서 검량선의 선형성 (r=0.9964)은 우수한 것으로 나타났다.
이 분석방법의 검출한계 (limit of detection, LOD) 및 정량한계 (limit of quantification, LOQ)는 식 (1)을 이용하여 산정하였다 (ACS, 1980).
| (1) |
여기서, Cblk는 평균 공시험 (blank) 값, σ는 공시험 값의 표준편차이다. 이번 연구의 분석조건에서 얻은 공시험 값은 0.164±0.004 mg이며, 계산한 검출한계 및 정량한계는 각각 0.176 mg 및 0.203 mg이다.
3. 결과 및 고찰
3. 1 초음파 추출
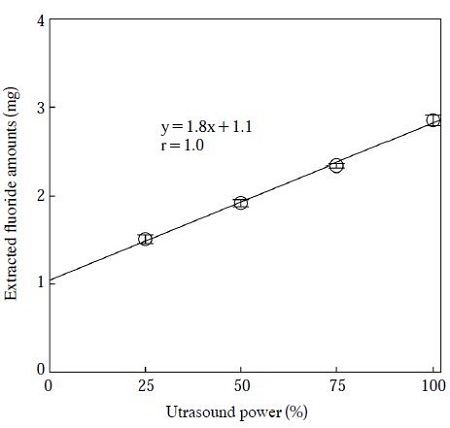
초음파 추출에서 초음파 파워에 의한 추출량 변화를 알아보기 위해 초음파 입력 파워에 따른 불소 추출량의 변화를 나타내었다. 초음파의 입력 파워가 100%일 때 500 W이며, 25%~100%의 입력파워로 초음파를 조사하였고, 추출시간은 60분이다. 그림 2와 같이 초음파 파워의 증가에 비례하여 추출된 불소량도 선형적으로 증가하는 것으로 나타났다. 이 결과로부터 본 초음파 조사 조건 하에서 추출을 위해 사용한 추출용기 내부로 초음파 파워가 잘 유입되는 것으로 생각된다.
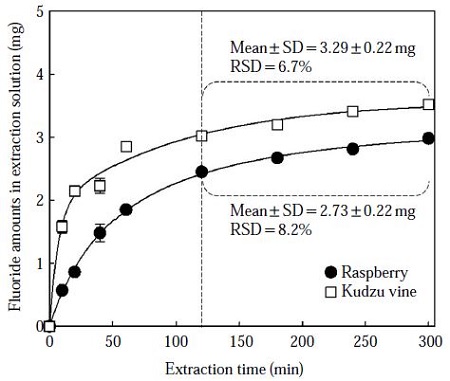
초음파 추출시간에 따라 추출된 불소량의 변화를 그림 3에 나타내었다. 사용된 식물잎은 산딸기잎과 칡덩굴잎으로 100%의 초음파 파워 (500 W)를 이용하여 추출하였다. 결과를 보면, 추출된 불소량은 추출 초기에 급격하게 증가하였으며, 약 60분 이후부터는 추출시간의 증가에 따라 추출량도 서서히 증가하였다. 그러나 산딸기잎과 칡덩굴잎 시료를 120분~300분 추출한 후 얻어진 불소량은 각각 2.73±0.22 mg F와 3.29±0.22 mg F이며, 추출량의 증가율은 이전보다 상당히 완만해졌다. 그리고 이때의 상대표준편차 (Relative standard deviation, RSD)는 각각 8.2%와 6.7%로 변화가 적은 것으로 나타났다. 이 결과로부터, 동일한 조건에서 초음파 조사에 의해 식물잎으로부터 불소를 추출할 경우, 120분 이후부터는 추출시간에 의한 영향이 적을 것으로 생각된다.
3. 2 초음파 조사 유무에 따른 추출량 비교
혼합, 가열, 초음파 및 초음파+가열 방법에 의해 불산에 노출된 식물잎 중 건조 분쇄한 0.5 g의 칡덩굴잎으로부터 추출한 불소량을 표 1에 나타내었다. 초음파 조사에 의한 추출량은 3.55 mg F로 다른 방법에 의해 얻어진 추출량 (2.95~3.41 mg F)보다 많은 것으로 나타났다. 특히, 초음파 조사에 의한 추출량은 혼합에 의한 추출량보다 약 17% 많은 것으로 나타났다. 수용액에 초음파를 조사하면 단열 압축 버블 (adiabatic compressed bubbles)이 격렬하게 붕괴되면서 높은 온도와 압력 및 충격파 (shock wave)와 같은 물리적 효과를 가져온다 (Yim et al., 2002; Suslick, 1990; Suslick et al., 1986). 따라서 초음파 조사에 의한 물리적 효과는 식물잎으로부터 불소를 추출하는 데 중요한 역할을 한다. 그러나 가열을 동반한 초음파 조사의 경우 추출량이 약간 감소하는 것으로 나타나 초음파+가열에 의한 식물잎으로부터의 불소 추출은 효과적이지 않은 것으로 생각된다. 한편 초음파 조사에 의한 추출용액의 혼합효과는 추출과정에 긍정적인 요인으로 작용하였다.
3. 3 식물잎에 축적된 불소 농도
불산 누출 사고에 직접 노출된 식물잎과 노출되지 않은 식물잎에 축적된 불소 농도를 그림 4에 나타내었다. 불산에 직접 노출된 콩과 덩굴잎, 산딸기잎 및 칡덩굴잎의 평균 불소 농도는 5,409 (±1,198) mg F/kg dry wt이었으며, 가장 높은 농도를 나타낸 칡덩굴잎은 6,478 mg F/kg dry wt이었다. 불산에 직접 노출되지 않은 칡덩굴잎과 깻잎의 불소 농도는 각각 1,028과 548 mg F/kg dry wt이었으나, 불산 누출 사고에 의해 직접적으로 불산에 노출되지 않았을지라도 이 불소 농도는 상대적으로 높은 수준으로 생각된다. 이러한 결과는 본 조사지역에 위치한 사업장의 공정 중에서 불산을 사용하기 때문에 주변 환경에 지속적으로 영향을 미친 것으로 생각된다.
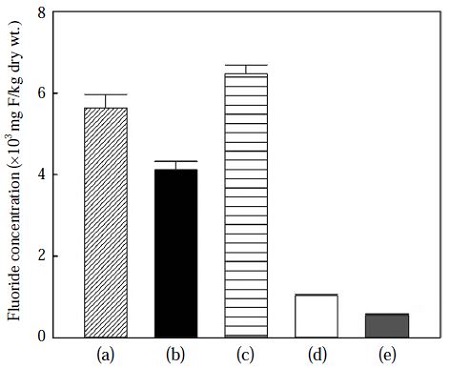
Concentration of fluoride in plant leaves exposed (a ~ c) or unexposed (d, e) to hydrogen fluoride. (a) soybean, (b) raspberry, (c) kudzu vine, (d) kudzu vine, (e) perilla.
기존에 다양한 식물종을 이용하여 알루미늄 제련소와 같이 대규모 사업장의 산업공정에서 대기 중으로 배출되는 대기 중 불소를 모니터링 한 많은 연구결과를 보면, 알루미늄 제련소 주위에 서식하고 있는 Hypnum cupressiforme Hedw. 및 Scleropodium purum (Hedw.) Limpr와 같은 이끼류에서의 불소 수준을 조사하였으며, 불소 농도는 <10 μg F/g~154 μg F/g이었다 (Real et al., 2003). 알루미늄 제련소 주위에 서식하고 있는 풀에서 측정한 평균 불소 농도는 4.32~912.22 μg/g이었으며, 불소의 배출원이 명확하지 않은 지역에서의 배경 농도는 약 5~15 μg/g으로 조사되었다 (Rey-Asensio and Carballeira, 2007). 이와 같이 대표적인 불소 배출원인 알루미늄 제련소를 중심으로 한 주변에서 채취한 다양한 식물종에서의 불소 농도는 큰 차이가 나타났다 (Franzaring et al., 2007). 본 연구결과와 같이 불산 누출 사고에 직접 노출된 식물잎에 누적된 불소의 농도는 상당히 높아 단기간에 식물잎에 직접적으로 피해를 줄 수 있었다고 생각된다.
3. 4 대기 중 불화수소 (HF) 농도의 추정
식물잎에 누적된 불소량을 기초로 불화수소에 누출되었을 때의 대기 중 농도를 식 (2)를 이용하여 추정하였다 (Horntvedt, 1997).
| (2) |
여기서, HFair는 대기 중 불화수소 농도 (mg/m3), ΔFplant는 식물에 축적된 불소 농도 (mg F/kg dry wt.), t는 노출시간 (days) 그리고 K는 식물종에 따른 축적계수 (m3/mg/day)이다. K값은 온도, 빛, 풍속과 같은 다양한 기상조건과 기공의 열림과 닫힘, 잎의 면적 등 잎의 특성 때문에 개별 식물종별로 산정하는 것은 상당히 곤란하다고 알려져 있다 (Stern, 1977).
본 연구에서 사용한 식물잎은 단시간에 불화수소에 노출된 후 1일 후에 바로 채취한 시료이기 때문에 강우 등에 의해 씻겨 없어지는 (wash off) 영향은 고려하지 않았다. 식 (1)에서 축적계수는 식물종에 따라 다양하게 제시되고 있으나, 본 연구와 동일한 식물종이 없을 경우에는 잎의 특성을 고려하여 유사한 축적계수 값을 적용하였다. 즉, 콩과 덩굴식물과 칡덩굴은 콩과 (Leguminosae) 또는 콩속 (Glycine)의 2.23 m3/mg/day (Vike, 2005), 깻잎은 페릴라 (Perilla)속의 2.23 m3/mg/day (Vike, 2005; Tanaka et al., 1997) 값을 취했으며, 산딸기의 경우는 산딸기속 (Rubus)으로 제안된 축적계수가 없기 때문에 유사한 관목인 오이속 (Cucumis)의 축적계수인 2.50 m3/mg/day 값 (Paris et al., 2011; Vike, 2005; Kortekamp and Zyprian, 1999)을 적용하여 보고된 축적계수 중 가장 큰 값을 취함으로써 과대평가되지 않도록 하였다.
이 값을 이용하여 계산한 대기 중 불화수소 농도를 표 2에 나타내었다. 불화수소에 대한 노출 여부에 따른 식물잎을 이용하여 추정한 대기 중 불화수소 농도를 보면, 불화수소에 노출된 지점 부근에서의 대기 중 평균 불화수소 농도는 2.36±0.65 mg/m3 (2.89±0.79 ppm)이며, 직접 노출되지 않은 지점 부근에서는 0.35±0.15 mg/m3 (0.43±0.19 ppm)이었다. 배출원으로부터의 이격거리를 기준으로 식물잎에 축적된 농도와 대기 중 불화수소 농도와의 관계는 배출원에서 약 16 km까지 매우 높은 상관관계를 나타내고 있는 것으로 보고되었다 (Mezghani et al., 2005).

Concentration of fluoride in plant leaves exposed or unexposed to hydrogen fluoride and estimated hydrogen fluoride in atmosphere.
미국의 일반 대기환경에서 조사된 불소 농도는 0.05~1.89 μg/m3이며 (Thompson et al., 1971), 영국의 도시와 비도시에서 측정한 월평균 농도는 0.1~11 μg/m3 (Coleman et al., 2005)로 나타났으며, 중국 베이징에서 측정된 대기 중 에어로졸에 포함된 불소 농도는 0.08~1.61 μg/m3으로 나타났다. 한편, 우리나라에서 발생한 구미 불산 누출 사고의 경우, 총 불산 누출량은 8~12톤 (8시간 동안 누출)으로 추정되며, 사고 주변 1 km까지 모든 식물이 고사하였다. 이 경우 추정한 대기 중 불화수소 농도는 500 m 이하의 이격거리에서는 산술평균 3.1 ppm (0.4~14.7 ppm) (Gu et al., 2013)으로 본 연구결과와 비교해 보면, 유사한 농도값을 나타내었다.
불산은 강한 자극성 때문에 인체에 심각한 위해를 미칠 수 있다. 실제로 일반성인 남성이 0.5 ppm의 불산에 1시간 동안 노출된 경우, 매우 경미하거나 중간 정도의 상부 호흡기 자극이 나타났지만, 1.9 ppm의 불산에 1시간 동안 노출된 경우에는 하부 호흡기 자극 증상이 나타났으며, 4.2~4.5 ppm의 불산에 1시간 동안 노출된 경우에는 심각한 상부 호흡기 자극과 비강 내 염증반응이 나타났다 (ATSDR, 2003). 한편 우리나라 고용노동부 산업안전보건법 (제39조 제2항 및 제42조, 시행규칙 제81조의2)에서는 화학물질 노출기준으로 시간가중평균치 (TLV-TWA) 0.5 ppm, 천정값 허용농도(Ceiling) 3 ppm을 규정하고 있다 (MOEL, 2012). 본 연구결과는 짧은 누출시간이지만 고용노동부의 천정값 허용농도에 근접한 농도를 보이고 있는 것으로 나타나 사람이 직접 노출되었을 경우 피해 영향이 크게 나타날 가능성이 높았다.
이 연구결과는 불산 누출이 아주 짧은 시간에 이루어져 주변 식물종에 대한 피해 상황이 크지 않아 다양한 식물잎을 거리별 채취하여 수행하는 데 한계가 있었으며, 대기 중 불화수소 농도 추정 시 사용된 축적계수가 식물종의 유사성에 따라 적용되었기 때문에 다소 과대/과소평가 되었을 수도 있다. 그러나 장래 식물에 대한 유해성 (phytotoxic) 영향 평가의 일환으로 패시브 (passive) 생물모니터링을 위한 생물지표의 활용 측면에서 의미 있는 기초자료가 될 것으로 생각된다.
4. 결 론
본 연구에서는 불산 누출 사고 후 피해를 입은 식물잎을 이용하여 식물잎에 축적된 불소 농도를 정량하고, 대기 중 불화수소 농도를 추정하였다. 불산에 직접 노출된 콩과 덩굴잎, 산딸기잎 및 칡덩굴잎에 누적된 평균 불소 농도는 보면, 직접적으로 불산에 노출되지 않았을지라도 상대적으로 높은 수준의 농도가 나타나 지속적으로 대기 중 불화수소에 영향을 받은 것으로 나타났다. 한편, 불산에 직접 노출된 지점 부근에서의 대기 중 평균 불화수소 농도는 기존에 보고된 일반적인 대기 중 불화수소 농도 (수 ppb)보다 상당히 높은 것으로 나타났다. 따라서 불산 누출 사고가 발생할 경우 주변 지역의 생태계 및 인체에 미치는 영향이 상당히 클 것으로 추정할 수 있다.
추후 다양한 식물종, 토양, 물 등 다매체 시료를 이용하여 배출원 이격거리 및 기상상황 (풍향, 풍속, 강우량) 등과 같은 다양한 환경조건에서 불소 농도를 정량함으로써 환경계에 대한 유해성 영향 평가에 패시브 (passive) 모니터링을 활용할 수 있는 가능성을 연구하고자 한다.
References
- Agency for Toxic Substances and Disease Registry (ATSDR), (2003), Toxicological Profile for Fluorides, Hydrogen Fluoride and Fluorines, Agency for Toxic Substances and Disease Registry Press, Atlanta, p190.
-
American Chemical Society (ACS) Committee on Environment Improvement, (1980), Guidelines for data acquisition and data quality evaluation in environmental chemistry, Analytical Chemistry, 52, p2242-2249.
[https://doi.org/10.1021/ac50064a004]

-
Brougham, K.M., S.R. Roberts, A.W. Davison, and G.R. Port, (2013), The impact of aluminium smelter shut-down on the concentration of fluoride in vegetation and soils, Environmental Pollution, 178, p89-96.
[https://doi.org/10.1016/j.envpol.2013.03.007]

- Coleman, C., R. Mascarenhas, and P. Rumsby, (2005), A review of the toxicity and environmental behaviour of hydrogen fluoride in air, UK Environment Agency, Bristol, p14.
-
Franzaring, J., A. Klumpp, and A. Fangmeier, (2007), Active biomonitoring of airborne fluoride near an HF producing factory using standardised grass cultures, Atmospheric Environment, 41, p4828-4840.
[https://doi.org/10.1016/j.atmosenv.2007.02.010]

-
Fred Schurig, W., and P. Sole, (1967), Alcoholic extraction of oilseed with the aid of ultrasonics, Journal of the American Oil Chemists’ Society, 44, p585-591.
[https://doi.org/10.1007/BF02901256]

-
Gu, S., I. Choi, W. Kim, O. Sun, S. Kim, and Y. Lee, (2013), Study on the distribution of fluorides in plants and the estimation of ambient concentration of hydrogen fluoride around the area of the accidental release of hydrogen fluoride in Gumi, Journal of Environmental Health Sciences, 39, p346-353, (in Korean with English abstract).
[https://doi.org/10.5668/JEHS.2013.39.4.346]

-
Horntvedt, R., (1997), Accumulation of airborne fluorides in forest trees and vegetation, European Journal of Plant Pathology, 27, p73-82.
[https://doi.org/10.1111/j.1439-0329.1997.tb01358.x]

-
Kim, D., J. Lee, E. Kwon, H.A. Lee, H.O. Yoon, and S. Lee, (2015), Potential environmental influences in soil by accidental fluorine (F) leakage using leaching test, Journal of Korean Society Environmental Engineering, 37, p234-239, (in Korean with English abstract).
[https://doi.org/10.4491/KSEE.2015.37.4.234]

-
Kim, Y.J., S.H. Park, and K.S. Choi, (2013), Acute Ocular Manifestations after an accidental hydrofluoric acid release, Journal of Korean Opthalmology Society, 54, p1663-1668, (in Korean with English abstract).
[https://doi.org/10.3341/jkos.2013.54.11.1663]

-
Koblar, A., G. Tavčar, and M. Ponikvar-Svet, (2011), Effects of airborne fluoride on soil and vegetation, Journal of Fluorine Chemistry, 132, p755-759.
[https://doi.org/10.1016/j.jfluchem.2011.05.022]

-
Koh, D., J. Kim, and K. Choi, (2014), Defining area of damage of 2012 hydrofluoric acid spill accident in Gumi, Korea, Journal of Environmental Health Sciences, 40, p27-37, (in Korean with English abstract).
[https://doi.org/10.5668/JEHS.2014.40.1.27]

-
Kortekamp, A., and E. Zyprian, (1999), Leaf hairs as a basic protective barrier against downy mildew of grape, Journal of Phytopathology, 147, p453-459.
[https://doi.org/10.1111/j.1439-0434.1999.tb03850.x]

-
Kwon, E., H.A. Lee, D. Kim, J. Lee, S. Lee, and H.O. Yoon, (2015), Geochemical investigation of fluoride migration in the soil affected by an accidental hydrofluoric acid leakage, Journal of Soil Groundwater Environment, 20, p65-73, (in Korean with English abstract).
[https://doi.org/10.7857/JSGE.2015.20.3.065]

- Mezghani, I., N. Elloumi, F.B. Abdallah, M. Chaieb, and M. Boukhris, (2005), Fluoride accumulation by vegetation in the vicinity of a phosphate fertilizer plant in Tunisia, Fluoride, 38, p69-75.
- Ministry of Employment and Labor (MOEL), (2012), Exposure standard of chemicals and physical parameters, Notification of the Ministry of Employment and Labor, p39-42.
- National Academy of Sciences (NAS), (1971), Biologic Effects of Air Pollutants: Fluorides. National Academy of Sciences, Washington, D.C, p295.
-
Notcutt, G., and F. Davies, (2001), Environmental accumulation of airborne fluorides in Romania, Environmental Geochemistry and Health, 23, p43-51.
[https://doi.org/10.1023/A:1011062115049]

-
Ovadia, M.E., and D.M. Skauen, (1965), Effect of ultrasonic waves on the extraction of alkaloids, Journal of Pharmaceutical Sciences, 54, p1013-1016.
[https://doi.org/10.1002/jps.2600540713]

-
Paris, H.S., J. Janick, and M.C. Daunay, (2011), Medieval herbal iconography and lexicography of Cucumis (cucumber and melon, Cucurbitaceae) in the Occident, Annals of Botany, 108, p1300-1458.
[https://doi.org/10.1093/aob/mcr182]

-
Real, C., J.R. Aboal, J.A. Fernández, and A. Carballeira, (2003), The use of native mosses to monitor fluorine levelsand associated temporal variations - in the vicinity of an aluminium smelter, Atmospheric Environment, 37, p3091-3102.
[https://doi.org/10.1016/S1352-2310(03)00294-2]

-
Rey-Asensio, A., and A. Carballeira, (2007), Lolium perenne as a biomonitor of atmospheric levels of fluoride, Environmental International, 33, p583-588.
[https://doi.org/10.1016/j.envint.2006.10.004]

-
Saini, P., S. Khan, M. Baunthiyal, and V. Sharma, (2013), Mapping of fluoride endemic area and assessment of F-1 accumulation in soil and vegetation, Environmental Monitoring and Assessment, 185, p2001-2008.
[https://doi.org/10.1007/s10661-012-2683-0]

- Stern, A.C., (1977), Air pollution, 3rd, Vol II, The effects of air pollution, Academic Press, New York, p205-207.
-
Suslick, K.S., D.A. Hammerton, and R.E. Cline, (1986), Sonochemical hot spot, Journal of the American Chemical Society, 108, p5641-5642.
[https://doi.org/10.1021/ja00278a055]

-
Suslick, K.S., (1990), Sonochemistry, Science, 247, p1439-1445.
[https://doi.org/10.1126/science.247.4949.1439]

- Tanaka, K., H.-C. Yu, and Y.S. Kim, (1997), Cultivation of Perilla, Perilla, CRC Press, Boca Raton, p9-17.
-
Thompson, D., and D.G. Sutherland, (1955), Ultrasonic insonation effect on liquid-solid extraction, Industrial & Engineering Chemistry Research, 47, p1167-1169.
[https://doi.org/10.1021/ie50546a022]

-
Thompson, S.J., T.B. McMullen, and G.B. Morqan, (1971), Fluoride concentration in the ambient air, Journal of the Air Pollution Control Association, 21, p484-487.
[https://doi.org/10.1080/00022470.1971.10469558]

-
Vike, E., (1999), Air-pollutant dispersal patterns and vegetation damage in the vicinity of three aluminium smelters in Norway, Science of the Total Environment, 236, p75-90.
[https://doi.org/10.1016/S0048-9697(99)00268-5]

-
Vike, E., (2005), Uptake, deposition and wash off of fluoride and aluminium in plant foliage in the vicinity of an aluminium smelter in Norway, Water Air Soil Pollution, 160, p145-159.
[https://doi.org/10.1007/s11270-005-3862-1]

-
Vinatoru, M., (2001), An overview of the ultrasonically assisted extraction of bioactive principles from herbs, Ultrasonics Sonochemistry, 8, p303-313.
[https://doi.org/10.1016/S1350-4177(01)00071-2]

- Weinstein, L.H., A.W. Davison, and U. Arndt, (1998), Fluoride, in Recognition of Air Pollution Injury to Vegetation: A Pictorial Atlas, Edited by R.B. Flagler, Air and Waste Management Association, Pittsburgh, PA.
-
Weinstein, L.H., and A.W. Davison, (2004), Fluorides in Environment: Effects on Plants and Animals, CABI Publishing, Wallingford, Oxon.
[https://doi.org/10.1079/9780851996837.0000]

-
Yim, B., Y. Nagata, and Y. Maeda, (2002), Sonolytic Degradation of Phthalic Acid Esters in Aqueous Solutions. Acceleration of Hydrolysis by Sonochemical Action, Journal of Physical Chemistry A, 106, p104-107.
[https://doi.org/10.1021/jp011896c]