저농도 이산화탄소 포집용 활성탄소섬유 흡착제의 질소작용기 함침연구
Copyright © 2016 Korean Society for Atmospheric Environment
Abstract
Activated carbon fibers (ACFs) for CO2 adsorption were prepared from polyacrylonitrile (PAN) fiber through the systematic processes such as oxidation, activation and amination with the focus on the formation of nitration functional groups. Textural analysis of test samples revealed the decrease of specific surface area and pore volume by chemical activation including amination. The ratio of micropores to the total volume was 0.85 to 0.91, which was high enough with the pore size of 1.57 to 1.77 nm. Nitrogen compounds such as imine, pyridine and pyrrole presenting favorable interforces to CO2 molecules were formed throughout the whole preparation steps. The aminated ACF adsorbent showed the enhanced adsorption capacity, 0.40 mmol/g for low-level CO2 flow (3000 ppm) at room temperature. Selectivity of CO2 against dry air (O2 & N2) also increased from 1.00 to 4.66 by amination.
Keywords:
Carbon dioxide, Adsorption, Activated carbon fiber, Amine functionality1. 서 론
이산화탄소는 실내공기질의 환기상태를 점검하는 간접적인 지표물질로서 실내공기질 관리법 등에 의해 지정되어 관리하고 있다. 실내공기질이 악화된 경우에는 이산화탄소의 농도는 기준치의 최고 10배 이상의 농도를 나타내기도 한다 (Lee et al., 2012; Cho et al., 2011).
이산화탄소를 제어하는 방법에는 흡수법, 막분리법, 흡착법 등이 있지만, 실내환경을 고려할 경우에는 흡착법이 가장 적합한 방법이다. 흡착공정에서 사용되는 흡착제는 제올라이트, 건식 아민, 활성탄, 활성탄소섬유 등이 있으나, 흡착제 중에서도 세공이 잘 발달되어 매우 유용한 흡착제로써 활성탄이 활용되고 있다. 그러나 활성탄소섬유의 기계적 및 열적 안정성, 균일한 세공분포, 존재하는 세공의 크기, 높은 비표면적과 세공부피, 가공하기 쉬운 장점 때문에 활성탄소섬유가 활성탄에 비해 이산화탄소 흡착에 적합할 것으로 판단된다 (Li et al., 2015; Bikshapathi et al., 2011; Moon et al., 2005).
상업용 활성탄소섬유를 이산화탄소 포집으로 사용하기 위하여 KOH나 NaOH 혹은 수증기로 활성화시켜 미세공을 발달시키는 연구가 종종 진행되기도 하였다 (Meng and Park, 2012; Lee and Jo, 2009). 그러나, 상업용 활성탄소섬유를 이용하여 미세공을 발달시키는 경우에는 알칼리성 질소관능기가 거의 존재하지 않기 때문에 저농도 이산화탄소 포집에는 적합하지 않을 것으로 판단된다. 그러므로 이전 연구에서는 활성탄소섬유의 전구물질로 질소함량이 높은 PAN (polyacrylonitrile) 섬유를 선택하여 고온에서 활성화시킴으로써 이산화탄소에 대한 흡착능을 향상시키고자 하였으며, 부분적으로 포집능 증가효과를 얻었다 (Hwang et al., 2015).
따라서 본 연구에서는 PAN 섬유에 존재하는 염기성 질소작용기를 최대한 유지시킴으로서 흡착제의 표면에 형성되는 활성점을 증가시켰던 이전 연구결과를 토대로 시험제조한 활성탄소섬유에 고온에서 암모니아가스를 흘려줌으로써 아민기를 비롯한 질소관능기를 표면에 추가적으로 함침하였다. 이러한 질소관능기가 약산성의 이산화탄소 분자 포집에 미치는 효용성을 상대적으로 저농도 분위기에서의 흡착실험을 통하여 규명하고자 하였다.
2. 실험 방법
2. 1 활성탄소섬유 제조
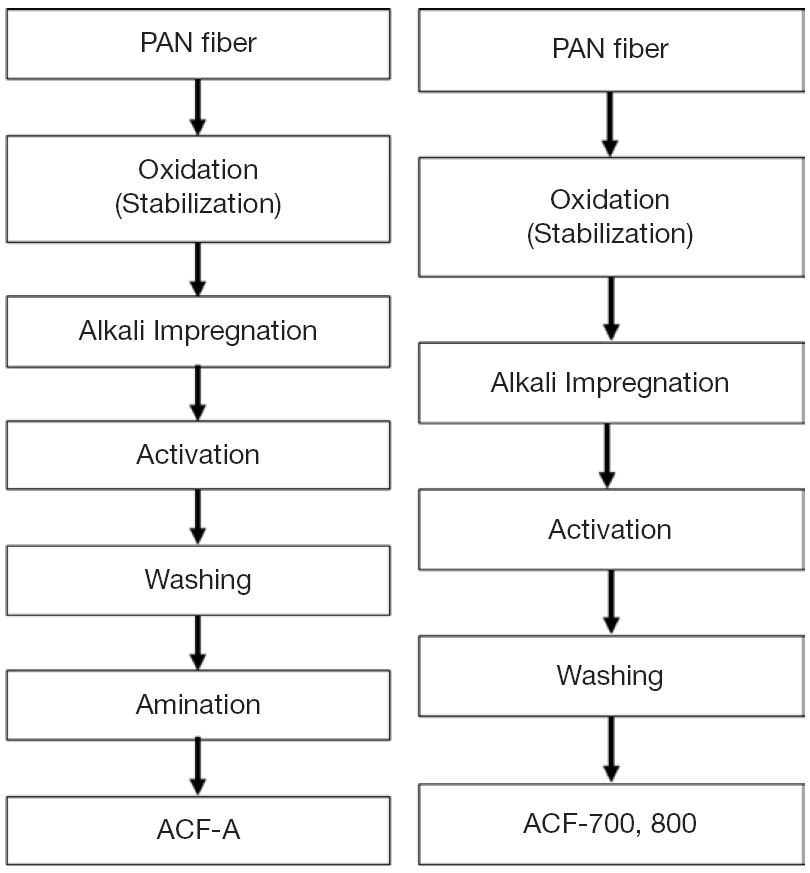
활성탄소섬유의 전구물질은 PAN 섬유를 사용하였으며, 시험용 활성탄소섬유는 그림 1과 같이 산화 (안정화), 활성화, 세척단계를 거쳐 최종적으로 활성탄소섬유를 제조하였다. 안정화는 일반적으로 공기 중에서 200~300℃의 온도로 PAN 섬유를 표면 열처리시켜주는 단계이며, 이때, 고리화 (cyclization), 산화 (oxidation), 탈수소화 (dehydrogenation)가 일어나기 때문에 PAN 섬유의 사슬형 구조가 사다리 구조로 바뀌게 되며, 섬유의 열적 안정성과 융점이 증가하게 된다 (Shin et al., 2014). 본 연구에서는 공기가 원활하게 공급될 수 있는 순환형 온풍 챔버를 230℃에 깨끗이 세척한 PAN 섬유 다발을 산화시켰으며, 이전 연구결과를 통하여 이러한 산화과정이 열적 안정성을 증가시키는 것으로 판단하였다 (Hwang et al., 2015). 본 연구에서는 산화시킨 섬유 (OXI-PAN)에 알칼리 성분 (K)을 함침시켜 활성화 효과를 증대시키고자 하였다. 즉, OXI-PAN은 다시 불활성 분위기 (N2)에서 고온 (700℃, 800℃)으로 각각 열처리하였다. 활성화된 섬유의 표면에 남아있는 불순물과 잔존해 있는 칼륨성분을 제거하기 위하여 뜨거운 증류수로 pH 7에 도달할 때까지 교반하면서 세척한 후, 건조하여 활성탄소섬유 흡착제 (ACF)를 완성하였다.
2. 2 표면 개질
제조한 활성탄소섬유의 표면에 질소관능기를 증가시키기 위하여 암모니아 가스를 사용하여 표면화학처리 (amination)를 다음과 같이 실시하였다. 즉, 활성화시킨 탄소섬유 (ACF)를 질소분위기의 고온 전기로에 방치한 후, 최고 600℃까지 온도를 상승시켜 주며, 암모니아 가스를 공급하였다. 암모니아 분위기를 1시간 동안 유지하여 시료 표면에 충분한 양의 질소관능기가 형성되도록 유도하였으며, 다시 질소분위기로 환원하여 상온까지 식혀주었다. 본 연구에서 준비한 각각의 활성탄소섬유 흡착제 시료는 표 1과 같이 명명하였다.
2. 3 활성탄소섬유 특성분석
본 연구에서 준비한 흡착제 시료들의 표면에 형성된 화학 관능기들은 X선 광전자 분광분석기 (XPS, X-ray photoelectron spectroscopy, K-Alpha, Thermo scientific. INC, USA)를 이용하여 관찰하였다. 비표면적 및 세공의 특성은 비표면적 측정기 (BET, Belsorb-mini, BEL, Japan)로 측정하였다. 각 시료의 세공의 부피는 중세공과 미세공으로 구분하여 고찰함으로써 이산화탄소 흡착에 유효한 미세공을 중점적으로 고찰하였다.
2. 4 저농도 이산화탄소 흡착 실험
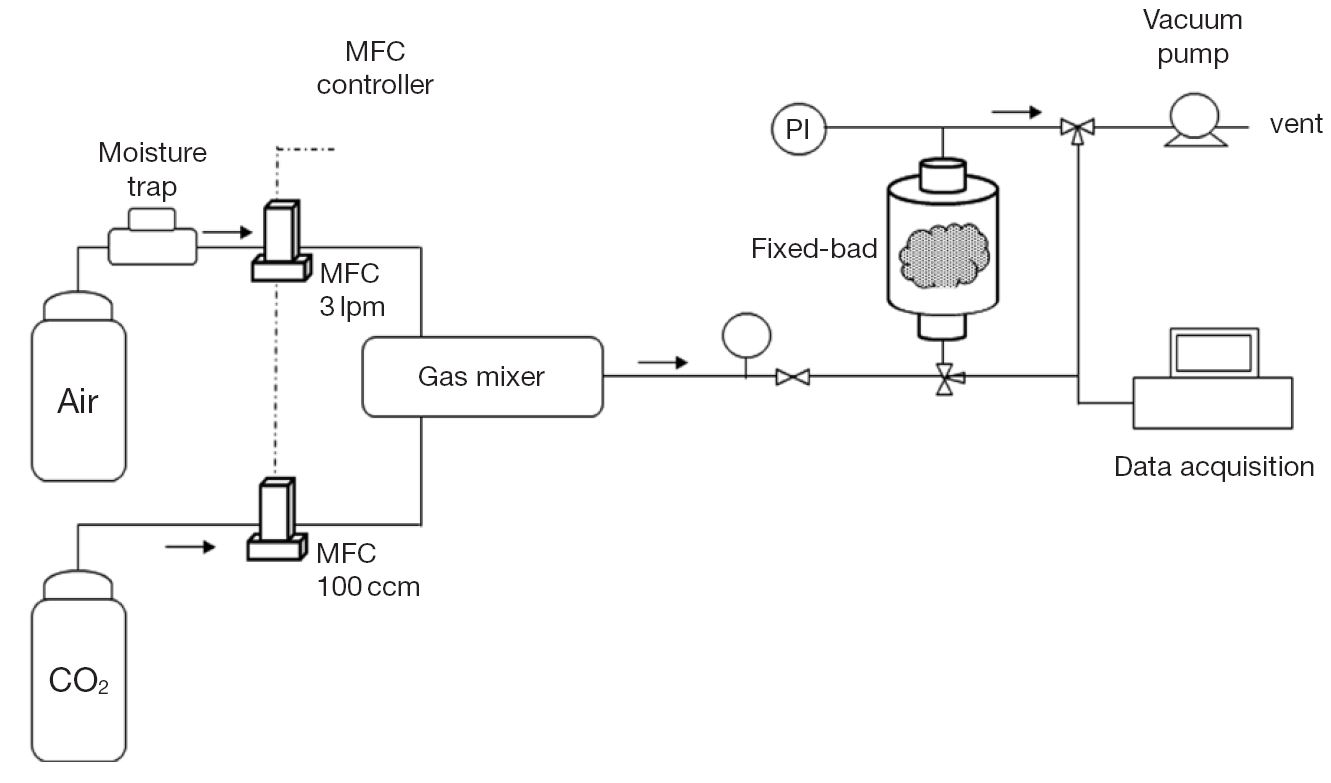
이산화탄소 흐름에 대한 흡착실험은 그림 2와 같은 장치로 구성하여 실시하였으며, 고순도 이산화탄소 가스를 실린더 공기로 희석하여 시험농도를 3000 ppm으로 설정하였다. 흡착반응기는 스테인리스 소재의 원통형 고정층 반응기 (2.5 cm×15 cm)로 제작하여 활성탄소섬유 시료를 각각 2~3 g 채웠다. 반응기로부터 유출되는 이산화탄소의 농도를 비분산적외선 센서 (CO2 engine K30, Esense air, USA)를 이용하여 실시간으로 측정하면서 구해지는 농도변화량에 대한 파과곡선을 통해 식 (1)로부터 이산화탄소 흡착량을 산출하였다.
| (1) |
여기서, qe는 이산화탄소 흡착량 (mmol/g)을 의미하며, Q는 이산화탄소를 함유한 기체의 유량 (cm3/s), C0는 반응기 입구에서의 이산화탄소 농도, Ci는 반응기 출구에서의 이산화탄소 농도, m은 반응기에 투입한 흡착제의 무게 (g), 그리고 t는 포화흡착 때까지의 반응시간을 나타낸다.
한편, 흡착제의 흡착선택도는 식 (2)에서와 같이 정의하여 산출해보았다.
| (2) |
이때, t는 흡착이 포화되는 시간과 t0는 초기시간을 의미하며, 는 t0에서의 이산화탄소 농도 (mmol/g), 그리고 Ct는 t시간에서의 이산화탄소 농도를 나타낸다.
3. 결과 및 고찰
본 연구에서는 질소함량이 높은 PAN 소재를 이용하여 활성탄소섬유를 시험제조하고, 칼륨과 암모니아를 적용하여 물리화학적으로 섬유의 표면을 개질하였다. 이러한 과정을 거친 ACF 시료 표면에는 질소관능기의 양이 크게 증가하였으며, 구조적인 개선을 이루어 이산화탄소 포집능이 향상된 것을 관찰할 수 있었다.
3. 1 활성탄소섬유의 표면화학 특성
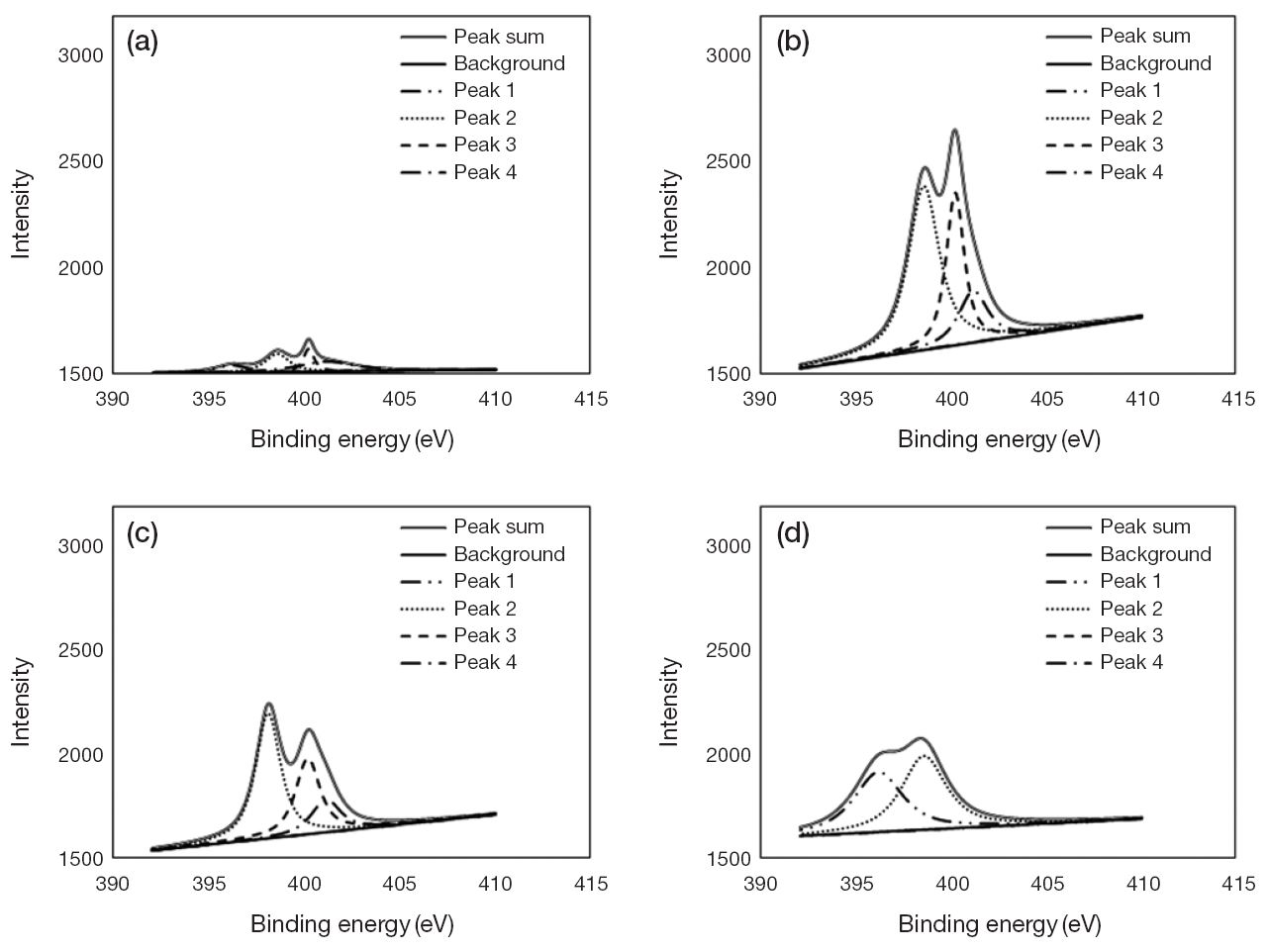
제조한 활성탄소섬유의 표면에 형성되어 있는 질소관능기를 고찰하기 위해 XPS로 관찰하였다. 그림 3은 XPS 분석 결과로 질소의 최외곽 전자를 중심으로 에너지 준위를 살펴봄으로써 화합물의 종류를 구분하고 있다. 표 2에는 피크면적으로 나타나는 각 관능기가 갖는 상대적인 전자에너지의 정량값을 요약하였다. 섬유상 표면에서 관찰되는 질소관능기 (imine, pyridine, pyrrole)는 비전자공유쌍을 가지고 있는 루이스 염기로서, 루이스 산의 구조인 이산화탄소를 산-염기 결합으로 유도하여 보다 적극적으로 흡착할 수 있으며, 궁극적으로 저농도 혼합가스 중의 이산화탄소를 선택적으로 포집하는 데 유리할 수 있다 (Lim et al., 2012). 그림 3에서 볼 수 있듯이 상업용 기성품인 ACF-C의 표면에는 peak sum으로 표기되는 질소관능기가 적은 양으로 골고루 관찰되었다. 초기 시작물질인 PAN 소재에 함유되어 있는 탄소와 질소의 삼중결합 형태가 안정화과정에서 이중결합 형태의 질소화합물들로 전환되었을 것으로 추측되었으며, 아민화 처리가 적용되지 않았던 ACF-700과 ACF-800 시료 역시 초기 PAN 섬유에 존재하는 니트릴기 (C≡N)가 이중결합으로 전환되면서 질소헤테로고리를 형성하기 때문에 각각 고온의 활성화과정을 통해 표면에 방향족 구조를 가지는 Pyridine (peak 2)과 Pyrrole (peak 3)이 상당량 생성된 것을 확인할 수 있었다 (Adelodun et al., 2014).
아민화가 적용된 시료 (ACF-A)는 암모니아가 고온에서 분해되면서 PAN의 환형구조의 질소화합물들이 구조변경되어 Imine 형태 (peak 1)로 전환되는 데 참여하는 것으로 추정된다. 동시에 기존의 Pyridine은 부분적으로 유지되고 있음을 확인하였다 (그림 3(d)). 그러나 Pyrrole은 600℃의 온도에서 충분한 반응시간을 통하여 HCN이나 N2로 분해되어 소멸하는 것으로 판단된다 (Shen and Fan, 2013). Imine과 Pyridine은 sp2 혼성궤도를 가지고 있어 s분율이 높기 때문에 다른 작용기에 비해 염기성이 높다. 따라서 이산화탄소에 대한 화학적 상호인력이 강해지므로 궁극적으로는 흡착량이 높게 나타날 것이라고 판단되었다 (Maroto-Valer et al., 2005).
3. 2 활성탄소섬유의 세공 구조
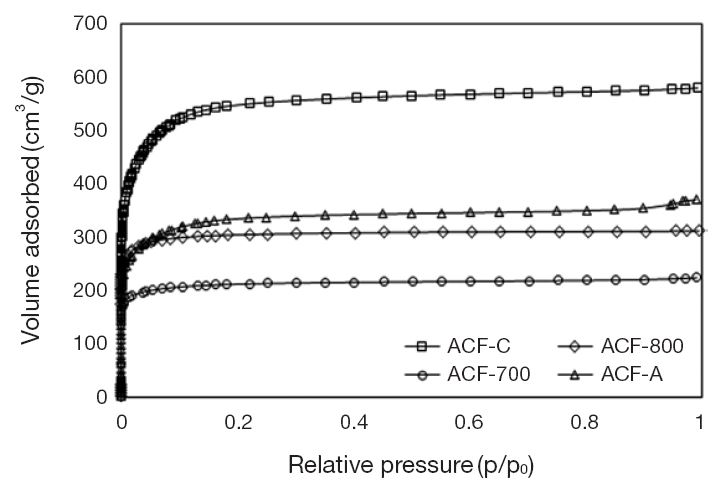
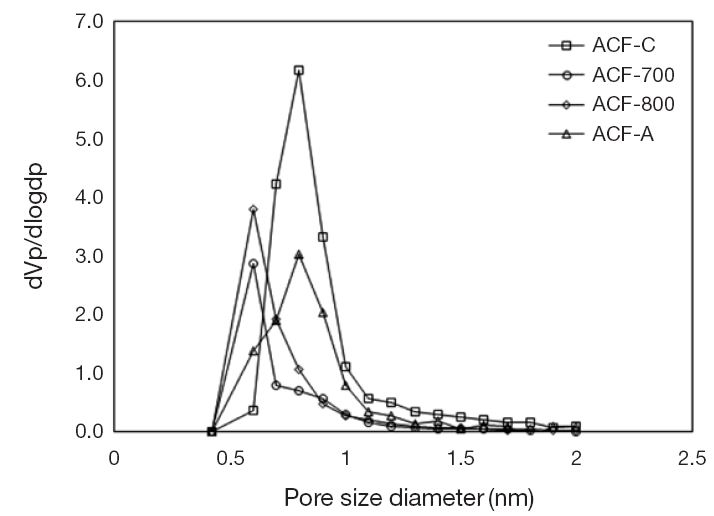
제조한 활성탄소섬유의 세공 구조를 관찰하기 위해 BET 기기에서 시험시료 에 질소가스를 주입하면서 흡착등온선을 도출하였다. 그림 4에서 볼 수 있듯이 활성탄소섬유는 아민화 과정 후에 오히려 질소 흡착량이 증가하는 것으로 미루어 비표면적과 세공부피가 증가하였음을 알 수 있었다. 일반적으로 상업용 ACF-C는 탄화과정을 거친 후, 활성화시켰기 때문에 물리적으로 가장 넓은 비표면적과 높은 세공부피를 가지고 있음을 알 수 있다. 또한 ACF-700과 ACF-800의 활성화 여부는 비표면적과 세공의 발달 정도를 통하여 간접적으로 판단하였다.
세공의 크기를 비롯한 구조적 특성은 표 3에 요약하였으며, 그림 5에 각 시료의 미세공 분포를 비교하였다. 활성탄소섬유 (ACF-700과 ACF-800)에 형성되어 있는 미세공의 평균 직경은 1.662 nm와 1.573 nm이었으나, ACF-A는 1.773 nm로 측정되었다. 따라서 활성탄소섬유의 미세공은 아민화과정 후에 약간 확대되는 것으로 나타났다. 동시에 비표면적과 세공부피까지 증가하는 것으로 확인되었다. 아민화시킨 시료의 비표면적과 세공부피가 증가하는 이유는 암모니아가 높은 온도 (600℃)에서 반응성이 매우 높은 NH2, NH, H 등의 라디칼 형태로 분해되면서 탄소 원자와의 반응이 진행되면서 가스화되어 유출되기 때문인 것으로 판단된다 (Swietlik et al., 2014). 그러나 세공부피의 증가는 미세공뿐만 아니라 중세공도 증가시킴으로써 미세공의 상대적인 비율이 감소하는 것을 확인하였다. 따라서 활성탄소섬유의 비표면적과 세공부피가 증가할수록 흡착가능한 흡착점을 증가시키는 결과를 가져올 수 있기 때문에 이산화탄소의 흡착량은 증가시킬 것이라고 판단되었으며, 저농도 이산화탄소에 대한 선택도를 증가시킬 것이라고 예상하였다.
3. 3 저농도 이산화탄소에 대한 흡착량 평가
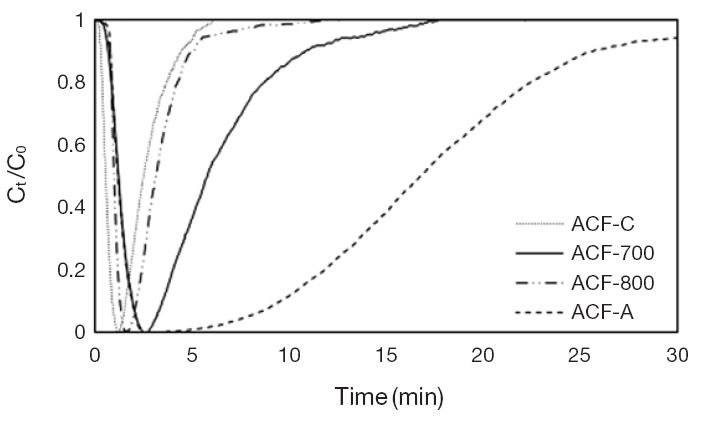
동일한 조건에 대하여 준비한 시료들의 이산화탄소 흡착량을 시험한 결과, 그림 6에 도시한 형태의 파과곡선들을 보여주었으며, 각각의 절대 흡착량은 표 4에 요약한 바와 같다. 0.3% 수준의 낮은 농도 범위의 이산화탄소 분위기를 설정하여 본 연구에서 제조한 활성탄소 섬유의 CO2 흡착량과 희석기체인 공기에 대한 선택도를 산출해보았다.
비표면적이 2,127 m2/g으로서 월등하게 높은 상업용 활성탄소섬유 (ACF-C)나 아민화 처리가 없는 시료 (ACF-700, ACF-800)에 비하여 활성화 후 암모니아를 주입하여 아민기를 표면에 형성시킨 시료 (ACF-A)가 0.40 mmol/g으로 가장 높은 흡착량을 나타냈다. 이는 이전의 연구에서 얻어진 순수 이산화탄소 흐름에 대하여 얻었던 최대 흡착능인 3.59 mmol/g보다는 낮은 양이지만 같은 농도흐름에서의 여타 흡착제들인 합성 제올라이트 (13X)나 활성탄 (coal based activated carbon pellet)에서 발견되었던 0.044 mmol/g이나 0.016 mmol/g 보다는 높은 양이다 (Hwang et al., 2015; Adelodun et al., 2014b; Lee and Jo, 2009).
일반적으로 흡착제의 비표면적이나 미세공의 부피가 클 경우, 가스흡착능이 높지만 저농도 가스흐름에 대하여는 흡착제의 표면 활성점과 대상 가스 (피흡착물)의 상호 인력에 크게 의존하면서 선별적인 접촉 및 부착현상이 일어나는 것으로 판단된다 (Plaza et al., 2007). 그림 6의 흡착파과곡선에서 볼 수 있듯이 활성화 시료 (ACF-700, ACF-800)의 파과시간 (tb)은 약 3분으로 측정되었고, 15분 이후에는 더 이상 흡착이 일어나지 않는 포화상태에 도달하는 것을 확인하였다. 반면에 암모니아 처리를 거친 시료 (ACF-A)는 파과시간이 5분 이상으로 증가하였으며, 포화되는 시간도 연장되었다. 이는 표면에 존재하는 질소관능기 (Imine)가 암모니아에 의한 아민화과정을 거치면서 많이 형성되고, 이산화탄소 포집에 유리한 알칼리성 활성점이 증가함으로써 이산화탄소 분자들을 선택적으로 유도할 수 있는 조건이 조성되었기 때문이다 (Adeldun et al., 2014b; Maroto-Valer et al., 2005).
한편, 저농도 이산화탄소 흐름에 대한 흡착 선택도는 식 (2)를 통해 산출했으며, 표 4에 요약하였다. 즉, 흡착 반응기로 가스 흐름이 유입되어 흡착이 진행되는 시간동안 공급되는 이산화탄소의 총량 대비 포집된 양의 이송가스인 공기에 대한 상대적인 몰비율을 본 연구에서는 선택도로 정의하였다 (Wu et al., 2010). 이러한 정의에 따라 계산해보면 PAN으로부터 시험제조한 흡착제 (ACF-700, ACF-800)의 선택도는 각각 1과 0.56으로 나타났지만, 아민화시킨 후 (ACF-A)에는 4.66으로 증가하였다. 상업용 시료 (ACF-C)의 경우, 선택도가 0.09로 매우 낮게 나타나는 바, 이는 0.896 cm3/g이라는 높은 세공 부피에도 불구하고, 대부분의 세공 내부 표면이 이송가스인 공기 (산소 및 질소)에 의해 조기에 포화됨으로써 상대적으로 CO2가 흡착될 수 있는 면적이 제한될 수 밖에 없을 것으로 추측한다. 특히 본 연구에서는 CO2 단일 성분에 대한 절대 선택도를 고찰한 것으로서 세공의 면적이나 부피 및 활성점 등을 함께 고려하면 아민화과정의 효용성이 보다 차별화되게 나타날 수도 있다. 즉 전체적으로 선택도가 5 이하의 낮은 값을 가진 이유는 초기 농도를 낮은 농도 (3000 ppm-CO2)로 시작하여 시험하였고, 혼합가스 중에서 다른 가스와의 비율이 아닌 이산화탄소에 대한 정량적 비율을 선택도로 선정하여 산출하였기 때문인 것으로 판단된다 (Wu et al., 2010).
4. 결 론
시민이 밀집되어 있는 다중이용 실내공간에서 발견되는 3000 ppm 수준의 저농도 이산화탄소 분위기에 적합한 건식포집체로서 PAN 기원 활성탄소섬유를 시험제조하였다. 섬유흡착제의 표면에 염기성 활성점을 확보하기 위하여 암모니아를 이용한 건식 아민화처리를 적용함으로써 이산화탄소에 대한 선택적 흡착능을 향상시키고자 하였다. PAN 섬유는 높은 질소함량을 가지고 있기 때문에 활성화 과정을 거치면서 Pyridine과 Pyrrole이 생성되고, 아민화 과정에 의해 Imine도 형성되는 것으로 XPS 분석결과 밝혀졌다. 이러한 질소 작용기들은 이산화탄소와의 산-알카리 인력을 적극적으로 유도함으로써 선택도 높은 흡착능을 확보할 수 있었다.
아민화가 진행되는 동안 암모니아의 분해에 의한 라디칼이 생성되고, 다시 섬유의 탄소골격이 가스화되면서 결함구조로 변화되고, 비표면적은 836 m2/g에서 1,293 m2/g, 세공부피는 0.347 cm3/g에서 0.573 cm3/g로 증가시키는 것으로 나타났다. 특히 아민화 처리는 일반 상업용 ACF의 흡착량을 이산화탄소 흡착량을 0.05 mmol/g에서 0.40 mmol/g까지 증가시켰으며, 선택도 또한 0.56에서 4.66까지 크게 향상되었다.
Acknowledgments
본 연구는 한국연구재단 이공분야기초연구사업의 지원으로 수행된 연구입니다 (NRF-2015R1D1A1A01060182).
References
-
Adelodun, A.A., Y.H. Lim, and Y.M. Jo, (2014a), Stabilization of potassium-doped activated carbon by amination for improved CO2 selective capture, J. Anal. Appl. Pyrolysis, 108, p151-159.
[https://doi.org/10.1016/j.jaap.2014.05.005]

-
Adelodun, A.A., Y.H. Lim, and Y.M. Jo, (2014b), Surface oxidation of activated carbon pellets by hydrogen peroxide for preparation of CO2 adsorbent, J. Indust. Eng. Chem, 20, p2130-2137.
[https://doi.org/10.1016/j.jiec.2013.09.042]

-
Bikshapathi, M., N. Verma, R.K. Singh, H.C. Joshi, and A. Srivastava, (2011), Preparation of activated carbon fibers from cost effective commercial textile grade acrylic fibers, Carbon letter, 12, p44-47.
[https://doi.org/10.5714/CL.2011.12.1.044]

-
Cho, Y.M., D.S. Park, S.B. Kwon, J.Y. Lee, and Y.H. Hwang, (2011), Study on the removal of carbon dioxide in the subway cabin using zeolite type carbon dioxide adsorbent, J. Korean Soc. Railw, 14(1),), p1-5.
[https://doi.org/10.7782/JKSR.2011.14.1.1]

-
Hwang, S.H., H.S. Park, D.W. Kim, and Y.M. Jo, (2015), Preparation of activated carbon fiber adsorbent for enhancement of CO2 capture capacity, J. Korean Soc. Atmos. Environ, 31(6),), p538-547.
[https://doi.org/10.5572/KOSAE.2015.31.6.538]

- Lee, J.Y., D.S. Park, Y.M. Cho, S.P. Kwon, Y.H. Hwang, H.J. Song, and S.B. Lee, (2012), A study on the low concentration carbon dioxide adsorbent and optimal condition, J. Korean Oil. Chem. Soc, 29, p1-12.
-
Lee, K.M., and Y.M. Jo, (2009), Ambient adsorption of low-level carbon dioxide by metal treated activated carbon, J. Korean Soc. Atmos. Environ, 25(4),), p316-324.
[https://doi.org/10.5572/KOSAE.2009.25.4.316]

-
Li, J., H.L. Dickon, P. Song, C. Kong, Y. Song, and P. Yang, (2015), Preparation and characterization of highsurface-area activated carbon fibers from silkworm cocoon waste for congo red adsorption, Biomass. Bioenerg., 75, p189-200.
[https://doi.org/10.1016/j.biombioe.2015.02.002]

- Lim, H.H., Y.H. Lim, and Y.M. Jo, (2012), Characterization of AC-based adsorbents for CO2 capture, J. Korean Soc. Indoor Env, 9(1),), p9-18.
-
Maroto-Valer, M.M., Z. Tang, and Y. Zhang, (2005), CO2 capture by activated and impregnated anthracites, Fuel Process. Technol, 86, p1487-1502.
[https://doi.org/10.1016/j.fuproc.2005.01.003]

-
Meng, L.Y., and S.J. Park, (2012), MgO-templated porous carbon-based CO2 adsorbents produced by KOH activation, Mater. Chem. Phys, 137, p91-96.
[https://doi.org/10.1016/j.matchemphys.2012.08.043]

- Moon, S.Y., D.Y. Han, B.H. Lee, and Y.S. Lim, (2005), Preparation and characterization of OXI-PAN based carbon fibers activated by hydroxides, J. Korea Ceramic Soc, 42(7),), p469-474.
-
Plaza, M.G., C. Pevida, A. Arenillas, F. Rubiera, and J.J. Pis, (2007), CO2 capture by adsorption with nitrogen enriched carbons, Fuel, 86, p2204-2212.
[https://doi.org/10.1016/j.fuel.2007.06.001]

-
Shen, W., and W. Fan, (2013), Nitrogen-containing porous carbons: synthesis and application, J. Mater. Chem. A, 1, p999-1013.
[https://doi.org/10.1039/C2TA00028H]

-
Shin, H.K., M.R. Park, P.H. Kang, H.S. Choi, and S.J. Park, (2014), Preparation and characterization of polyacrylontrile-based carbon fibers produced by electron beam irradiation pretreatment, J. Ind. Eng. Chem, 20, p3789-3792.
[https://doi.org/10.1016/j.jiec.2013.12.080]

-
Swietlik, U., B. Grzyb, K. Torchala, G. Gryglewicz, and J. Machnikowski, (2014), High temperature ammonia treatment of pitch particulates and fibers for nitrogen enriched microporous carbons, Fuel Process. Technol, 119, p211-217.
[https://doi.org/10.1016/j.fuproc.2013.11.009]

-
Wu, H., R.S. Reali, D.A. Smith, M.C. Trachgtenberg, and J. Li, (2010), Highly selective CO2 capture by a flexible micropore metal-organic framework material, Chem. Eur. J, 16, p13951-13954.
[https://doi.org/10.1002/chem.201002683]