이산화탄소 포집능 향상을 위한 활성탄소 섬유 흡착제 제조
Copyright © 2015 Korean Society for Atmospheric Environment
Abstract
Test activated carbon fiber (ACF) was prepared from Polyacrylonirile (PAN) through oxidation and chemical activation. Immersion of ACF precursors in the aqueous KOH solution enhanced the surface structure, as examined by BET pore analysis. Specific surface area increased greatly from less than 70m2/g to 1226m2/g with 4 M KOH, and total pore volume also rose up to 0.483 cm3/g. In particular, it was found that micropores favorable for CO2 molecule capture occupied more than 95%. Maximum CO2 adsorption capacity was 3.59 mmol/g at 298 K. Low depth of pores in the present ACF may facilitate the molecules’ desorption for its regeneration.
Keywords:
Activated carbon fiber, CO2 adsorption, KOH, Textural analysis1. 서 론
연소공정의 배출가스나 실내공기중에 존재하는 이산화탄소 포집을 위한 다양한 연소 후 포집기술 중에서는 아민계 흡수공정이 있으며, 아민계 흡수공정에서 가장 많이 이용되고 있는 흡수제로는 Monoethanol amine (MEA)가 있다. 그러나 MEA를 사용한 흡수공정은 용매의 성능저하 및 설비의 부식, 용매의 회수, 높은 에너지 소비 등과 같은 문제가 있다. 이러한 문제를 해결하기 위한 대체 방법으로 건식흡착이 가능성이 있다 (Shakerian et al., 2015; Leung et al., 2014; Caglayan and Aksoylu, 2013).
흡착공정에서 사용되는 흡착제의 종류는 제올라이트, 건식 아민, 활성탄, 활성탄소섬유가 있다. 흡착제 중에서도 세공이 잘 발달되어 있어 매우 유용한 흡착제로써 활성탄이 활용되고 있지만, 활성탄소섬유의 기계적 및 열적 안정성, 균일한 세공크기, 높은 비표면적과 가공하기 쉬운 장점을 고려해 볼 경우, 활성탄소섬유가 활성탄에 비해 이산화탄소 흡착에 적합하다 (Xiaojun et al., 2014; Ramesh et al., 2013; Meng and Park, 2012; Castello et al., 2001).
활성탄소섬유를 이용한 이산화탄소 흡착은 그 가능성을 보여주고 있으며, 2 nm 이하의 미세공이 차지하는 비율에 따라 이산화탄소 분자에 대한 흡착량 차이가 분명하였으며, 그 중요성을 강조하였다 (Lee and Park, 2013; Park and Kim, 2001).
활성탄소섬유의 제조는 일반적으로 두 가지의 활성화법으로 제조할 수 있다. 하나는 이산화탄소, 수증기와 같은 산화성 가스를 이용한 물리적 활성화법이다. 여기서 활성화 공정은 산화성 가스가 전구물질의 탄소와 반응하여 기공을 형성하는 구조를 만드는 것이다. 다른 하나는 KOH, NaOH, ZnCl2와 같은 화학적 활성화제에 함침시킨 다음 열분해시켜 주는 방법이 있다. 이 방법은 열분해 후에 활성화제를 제거해야 된다. 물리적 활성화는 두 단계로 수행되며, 1단계는 산소와 수소를 제거하기 위해 불활성분위기에서 500~1000°C로 열 분해시켜준다. 2단계는 같은 온도나 더 높은 온도에서 산화성 가스로 열 분해시켜준다. 반면에 화학적 활성화는 활성화제를 이용하여 1단계와 2단계가 동시에 한 단계로 수행되며, 물리적 활성화보다 낮은 활성화온도와 높은 수율, 표면적, 그리고 잘 발달된 미세공을 얻을 수 있는 장점이 있다 (Sait and Derya, 2015; Unai et al., 2014; Bouchelta et al., 2008; Castello et al., 2001).
따라서 본 연구에서는 Polyacrylonirile (PAN)을 반응성이 높은 활성화제로 KOH를 사용하여 화학적인 방법으로 활성화시킴으로써 섬유의 표면 및 세공구조를 개선하고, 다양한 농도의 이산화탄소 흐름에 적용하여 각각의 흡착능을 비교, 평가해보고자 하였다.
2. 실험 방법
2. 1 활성탄소섬유 제조
활성탄소섬유 제조를 위한 전구물질로는 일반적으로 잘 알려진 PAN을 사용하였으며, 공기가 원활하게 공급될 수 있는 순환 챔버형 오븐에서 약 3시간 동안 1차 산화시켰다. 이때 내부 온도는 잠재적 산화 최대온도인 230°C로 고정시켰다.
활성탄소섬유의 구조 형성에 영향을 주는 요소를 고찰하기 위해 다양한 농도의 KOH 수용액을 준비하여 산화시킨 섬유 시료 (OXI-PAN)를 3시간 동안 함침시켜 칼륨 성분이 섬유 내부에 함침되도록 하였다. 칼륨이 함침된 산화섬유 (OXI-PAN)는 상온에서 건조하여 800°C의 불활성 분위기 전기로에서 표면구조에 대하여 활성화를 시도하였다. 열처리 시킨 후, 탄소섬유 표면에 남아있는 불순물과 잔존해있는 칼륨성분을 제거하기 위하여 뜨거운 증류수로 pH 7에 도달할 때까지 교반하면서 세척해주었다. 시험제조한 시료는 표 1과 같이 각각 명명하였다.
2. 2 활성탄소섬유의 특성분석
시험제조한 활성탄소섬유 시료에 대하여 가스분자 흡착과 관련된 주요 물성인 비표면적과 미세공의 분포 및 이산화탄소의 흡착능을 중점적으로 고찰하였다. 질소등온흡착 원리를 응용한 표면분석기 (BET, Belsorb-mini, BEL, Japan)를 이용하여 섬유시료의 비표면적 (SBET), 세공의 부피 (VT), 세공의 크기 등을 관찰하였다. 또한, X선 회절분석기 (XRD, X-ray diffraction, D8 advance, Beuker Co, Germany)는 탄소섬유의 활성화 과정에서 발생하는 화학적 결정구조 변화를 고찰함으로써 반응메카니즘을 확인하는데 사용되었다. 활성탄소섬유 시료의 표면상태나 섬유 가닥의 입경 등을 고찰하기 위하여 전자주사현미경 (SEM, Scanning Electron Microscope, Streoscan 440, Leica Cambridge, UK)을 이용하였다. 열중량분석기 (TGA, Thermogravimetric anal-ysis, TGA Q5000 IR, TA instruments, UK)로는 온도에 따른 무게 변화를 통해 PAN에 대한 산화과정의 효용성을 고찰하였다. 원소분석 (EA, Elemental analysis, Flash EA1112, Thermo Scientific. Inc, USA)을 통하여 원료섬유 및 활성화시킨 섬유흡착제의 탄소, 질소, 수소의 함량을 측정하였다. 이러한 구성원소의 함량 변화를 통해 섬유의 활성화과정에서의 화학구조 변화를 고찰하였다.
2. 3 이산화탄소 흡착능 측정
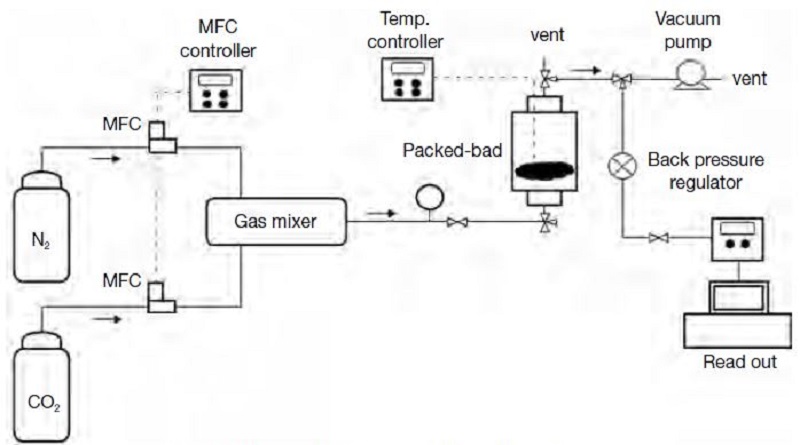
준비한 흡착제 시료의 잠재적인 최대흡착량은 BET 장치에서 순수 이산화탄소 가스를 주입하여 상온을 유지하면서 상대압력별로 측정하였다. 산업현장의 연소공정에서 발생할 수 있는 배기가스 중 이산화탄소 약 10% 내외이기 때문에 흡착실험용 이산화탄소의 농도는 10%로 제조하여 실험하였다 (Hong et al., 2013). 이때 실험장치는 그림 1과 같이 구성하였으며, 고순도의 실린더 이산화탄소 가스를 희석하여 시험농도를 유지하였다. 흡착 반응기는 스테인리스 소재로 원통형 (2.5 cm×15 cm)으로 활성탄소섬유 시료를 4~5 g 넣었으며, 유입 및 유출되는 농도를 측정하여 흡착량을 산출하였다.
3. 결과 및 고찰
본 연구에서는 기존의 활성탄소섬유를 화학처리함으로써 이산화탄소에 대한 흡착능을 향상시키고자 하는 범위에서 벗어나 활성탄소섬유의 원료물질인 PAN을 1차 산화시킨 후, 고온 활성화 단계 이전에 화학적으로 전처리함으로써 활성화를 촉진시키고자 하는 실험을 실시하였다. 이와 같은 수산화칼륨 함침반응은 PAN에 포함되어 있는 질소 작용기의 재배열을 촉진함으로써 최종 ACF의 표면구조 발달에 긍정적인 영향을 줄 수 있을 것으로 기대하였다.
3. 1 활성탄소섬유 흡착제의 제조
활성탄소섬유의 제조는 크게 산화 (안정화), 활성화, 세척으로 구분할 수 있다. 먼저, PAN을 산화시키는 단계는 nitrile기의 삼중결합이 해체되면서 질소 헤테로 고리를 형성하게 된다. 즉, 그림 2(a)에서 볼 수 있듯이 질소 주위에 수소와 산소가 좌우에 결합된 구조의 육각형 고리가 연결된 형태를 띠고 있다. 이러한 고리형태의 분자구조는 사다리 모양의 구조체를 형성하여 PAN의 강도를 증가시켜 준다. 이러한 산화처리는 유기성 PAN을 고온의 활성화 단계에서 섬유가 용융되는 것을 방지할 수 있다 (Yusof and Ismail, 2012). 사다리형태의 분자구조를 가지기 위해서는 175~230°C의 온도로 열처리를 수행해야 고리형태가 사다리형태로 변하며, nitrile기는 인접해있는 또 다른 nitrile기와 접촉하면서 삼중결합이 이중결합으로 바뀌게 되며, 그림 2 (a)와 같은 형태를 가지게 된다 (Paiva et al., 2003). 만일 산화시키는 온도가 너무 낮으면 사다리 구조를 형성하는 반응이 느리며, 완전한 산화가 일어나지 않는다. 따라서 본 연구에서는 반응이 일어날 수 있는 잠재적 온도 범위에서 가장 높은 온도인 230°C로 설정하여 산화시켰다 (Chen and Harrison, 2002).
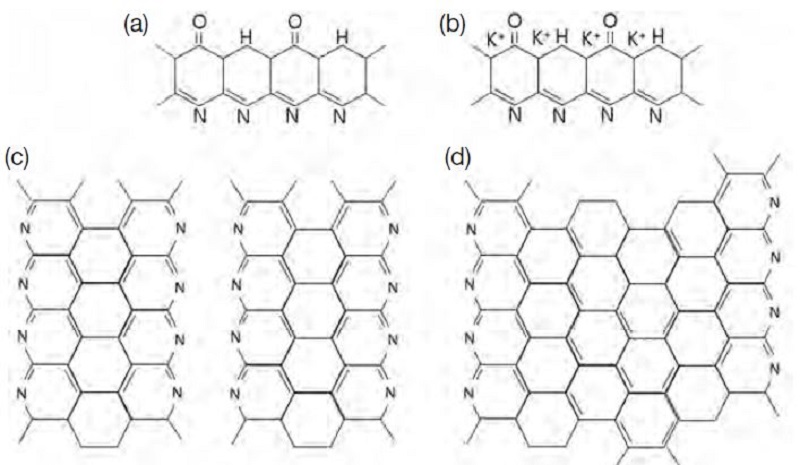
Structural conversion of ACFs during activation. (a) OXI-PAN, (b) impregnated OXI-PAN, (c) dehydrogenation during activation, (d) completed ACF.
산화시킨 PAN 섬유 (OXI-PAN)는 고온에서의 활성화를 실시하기 전에 다양한 농도의 KOH 수용액을 준비하여 3시간 동안 함침시켜 칼륨 성분이 섬유 내부에 함침되도록 하였다. 함침이 진행됨에 따라 ACF가 담지되어 있는 수용액의 색이 노란색으로 변하고, 계속 반응이 일어나면서 갈색으로 변하는 것이 관찰되었다. 더 이상 수용액의 색이 변하지 않고, 갈색을 유지하는 3시간을 최적의 반응시간이라고 판단하였다. 이러한 수용액의 색상 변화는 용해된 KOH가 섬유 내부로 함침되면서 발생하는 부산물이 수용액상에 용해되어 발생하는 것으로 판단된다. 수용액 상에서 용해된 칼륨이온은 섬유와 반응하여 결합한 형태로 존재하지 않고, 그림 2(b)와 같이 섬유 표면에 삽입 (intercalation)되어 고온의 반응조건이 형성되면 섬유 표면의 탄소와 반응하여 기공을 형성시키는 것으로 판단된다 (Yoon et al., 2004).
고온 활성화 공정에서 400~600°C에 도달하면 탈수소화 및 탈산소화가 진행되며, 이때 수소와 산소가 이탈하여 그림 2(c)와 같이 육각고리 형태의 구조가 서로 인접하는 모습을 가지게 된다. 온도가 더 상승하여 600°C 이상이 되면 탈질화가 일어나면서 그림 2(d)의 형태로 되는 것으로 알려져 있다 (Yusof and Ismail, 2012; Huang, 2009). 이러한 화학적 구조변화는 탄소, 질소, 수소의 함량을 측정함으로써 간접적으로 확인할 수 있었다. 즉, 산화가 진행된 시료 (OXI-PAN)는 표 2에서 볼 수 있듯이 탄소 61.66%, 질소 21.39%, 그리고 수소 4.26%로 나타났다. 이후, 800°C에서 활성화시킨 ACF는 탄소, 질소, 수소가 각각 75.98%, 12.99%, 0.71 %로 측정되었다. 활성화 과정을 거치면서 탄소의 함량은 상대적으로 증가하였지만, 질소와 수소는 탈수소화 및 탈질화 현상이 발생하여 오히려 감소하였다 (Lee et al., 2010). 질소와 수소가 감소하면서 산화된 섬유는 사다리형태의 구조에서 벌집형태의 구조로 바뀌게 되어 그림 2(d)의 형태로 되었다고 판단된다. 따라서 본 연구에서는 칼륨성분의 함침 후, 800°C의 질소 분위기에서 활성화하였다. 활성화 과정을 거친 섬유는 뜨거운 증류수로 pH 7까지 세척하여 잔존하는 불순물을 제거하고 건조시켰다.
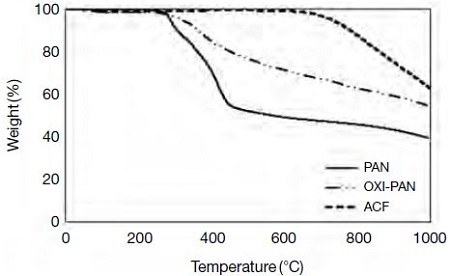
ACF의 구조적인 변화에 따른 열적 특성을 고찰하기 위해 TGA를 이용하여 온도에 따른 섬유의 무게변화를 측정하였다. 그림 3에서 볼 수 있듯이 PAN과 OXI-PAN, 활성탄소섬유는 온도가 증가함에 따라 무게감소가 발생하기 시작하였다. PAN은 300°C 부근에서 무게가 급격하게 감소하였으며, OXI-PAN도 300°C 부근에서 무게가 점차 감소하기 시작하였다. 활성탄소섬유는 상대적으로 안정하여 700°C를 넘어서면서 질량손실이 시작되었다. PAN의 용융온도는 322°C로 알려져 있으며, 서서히 가열하여 300°C에 도달하면 섬유가 용융하기 시작하면서 무게가 급격히 감소하였다. 또한 OXI-PAN은 PAN과 마찬가지로 300°C 부근에서 무게가 감소하긴 하지만 PAN보다 적게 감소하는 이유는 산화로 인하여 PAN의 구조가 상대적으로 강한 헤테로고리로 구성된 사다리 구조로 개질되었기 때문이다. 또한 활성탄소섬유는 그림 2(c) 나 (d)에서 보듯이 이미 800°C에서 활성화 공정을 거치면서 방향족 및 헤테로고리의 형성이 증가되어 좀 더 열에 대해 안정적인 형태를 유지함으로써 외부 가열에 의한 600°C 이상까지 분위기에서도 안정된 구조를 유지하는 것으로 판단된다.
그림 4는 OXI-PAN과 활성탄소섬유 (4KACF)를 SEM을 통하여 관찰한 결과이다. OXI-PAN 시료 섬유의 직경은 9~11 μm로 관찰되었다. 활성탄소섬유는 800°C의 고온처리를 거쳤음에도 불구하고 외형상의 원통형 섬유모양이 그대로 유지되고 있음을 확인하였다. 그러나 활성탄소섬유는 활성화 과정에서 발생하는 표면화학 반응으로부터 탄소를 비롯한 일부 성분이 이탈하면서 결함구조 (defect structure)가 형성되어 OXI-PAN과 달리 표면이 거칠게 변하는 것으로 보였다. 동시에 섬유의 표면에 미세한 공극이 생성되고, 구조적 결함도 발견되었다. 이러한 이유로 섬유상 흡착제의 표면적 및 세공의 부피가 증가한 것으로 판단된다.
3. 2 활성탄소섬유의 구조적 특성
시료 활성탄소섬유의 표면적과 세공을 비롯한 구조분석은 기체의 압력 (P)을 포화증기압 (P0)으로 나눈 상대압력 (P/P0)이 0.0~0.05, 0.05~0.3, 0.3~0.9의 범위에서 각각 질소 흡착량을 산출함으로써 미세공 (micropore), 중세공 (mesopore), 거대세공 (macropore)의 부피를 구분하여 고찰할 수 있다. 일반적으로 미세공은 2 nm 이하의 세공분포를 의미하며, 2 nm~50 nm 범위의 세공을 중세공, 그 이상을 거대세공으로 분류한다 (Diez et al., 2015; Lee and Park, 2013).
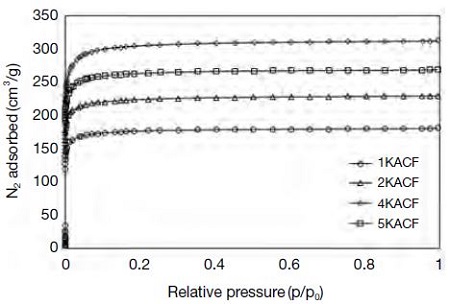
그림 5의 질소 흡착등온선은 모든 시료가 IUPAC에서 정의하고 있는 Type I의 흡착형태에 해당하였으며, 저압에서의 흡착량이 큰 것으로 미루어 보아 미세공이 많이 존재하고 있음을 알 수 있었다. 이러한 형태의 흡착등온선은 아주 미세한 세공으로 구성되어 있기 때문에 낮은 압력 분위기에서도 흡착된 분자들에 의해 세공이 채워지는 미세공 채움현상 (micropore filling)이 일어나며, 매우 가느다란 세공구조를 가지는 고체물질에 대한 물리흡착과정에서 발견된다.
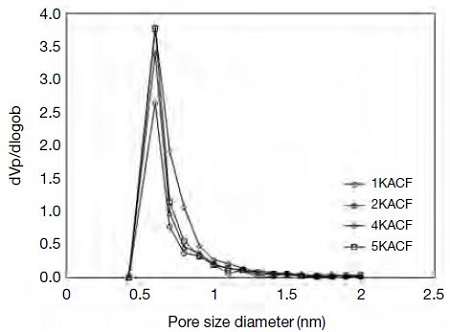
동시에 0.05 이상의 상대압력 하에서는 질소흡착량 변화가 거의 없는 것으로 미루어 보아 중세공은 매우 적을 것으로 판단된다 (Diez et al., 2015; Nan et al., 2015; Park and Kim, 2001). 즉, 그림 6에서도 관찰되듯이 실제 미세공 부분에 대한 세공분포도를 확인해보면, ACF 표면에 형성되어 있는 대부분의 세공이 1 nm 이하로 분포하고 있음을 알 수 있다. 알칼리 전처리한 시료들의 세공직경은 KOH 수용액의 농도가 증가함에 따라 조금씩 감소하는 것으로 나타났다. 표 3에 요약한 바와 같이 시험제조한 활성탄소섬유의 세공의 직경은 1.562~1.577 nm로 측정되었으며, 2 nm 이하 미세공의 직경은 0.7 nm로 나타났다.
한편, 비표면적은 4 mole의 KOH로 활성화시킨 시료 (4KACF)가 1,226 m2/g으로 가장 높게 나타났으며, 95% 이상의 미세공 분포를 확인할 수 있다. 따라서 세공의 크기분포와 비표면적, 세공부피량 등을 동시에 고려하였을 때, 4KACF가 가장 잘 발달된 세공구조를 갖추고 있음을 알 수 있었다.
활성탄소섬유의 세공을 형성시키는 활성화의 화학적 메카니즘은 식 (1)~(3)과 같이 예상할 수 있다. 섬유의 다공성을 증가시키기 위해 수증기나 이산화탄소를 이용하여 섬유의 탄소와 반응시켜 세공을 형성시킬 수 있다 (Rambabu et al., 2013). 섬유의 골격을 구성하고 있는 탄소는 수증기와 반응하여 일산화탄소와 수소를 생성하거나 이산화탄소와 반응하여 일산화탄소를 생성하면서 세공을 형성한다.
본 연구에서는 반응성이 높은 KOH를 이용하여 섬유 내 탄소와의 반응을 유도하여 결함구조를 구성함으로써 세공의 형성을 촉진시키고자 하였다. 따라서 KOH의 농도가 증가할수록 섬유 내부로 함침될 수 있는 칼륨의 양이 증가하게 되고, 동시에 탄소와의 반응이 증가할 수 있다. 그러나 과도한 양의 수산화칼륨은 미세공을 채우면서 막힘현상을 유발할 수 있는 바, 활성탄소섬유의 표면공극률을 감소시키는 결과를 낳는다.
| (1) |
| (2) |
| (2) |
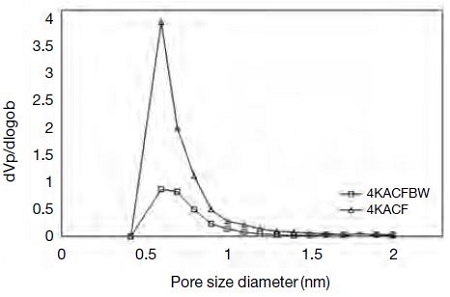
또한 시료섬유의 세척효과를 관찰하기 위하여 표면구조적으로 가장 우수한 4KACF 흡착제를 증류수로 세척하기 전의 시료에 대하여 표면적과 세공을 관찰하였다. 표 4에 비교한 결과를 보듯이 세척하지 않은 활성탄소섬유는 비표면적과 세공의 부피가 387 m2/g과 0.160 cm3/g으로 측정되어 매우 낮은 수준을 나타내었다. 이는 KOH 수용액에 함침시킨 후, 고온에서 활성화를 진행하는 동안에 KOH와 섬유의 탄소 및 산소 구조가 서로 반응하면서 형성되는 부생성물이 표면세공을 폐색 (clogging)시키는 것으로 추정되었다. 그러나 뜨거운 증류수에 시료를 담그어 세척액의 pH가 8.5 이상에서 7까지 낮아질 때까지 반복적으로 세척해냄으로써 알칼리 성분을 비롯한 이물질을 제거해낼 경우, 그림 7에서 보는 바와 같이 세공의 분포 차이가 뚜렷하였다.
3. 3 활성화 과정의 표면화학 반응
활성탄소섬유의 표면구조 변화는 활성화제로 사용하는 KOH의 농도와 밀접한 관계가 있다. 활성탄소섬유를 제조하는 과정에서 일어나는 일련의 반응들은 식 (4)~(8)와 같이 요약해볼 수 있다. 식 (4)~(6)은 KOH와 섬유 표면의 화학성분간의 반응으로서 KOH와 섬유의 골격을 이루고 있는 탄소와 반응이 시작되면서 K2CO3를 형성한다. 이후, 식 (7)~(8)과 같은 부수적인 경로를 통하여 K2CO3는 다시 K2O와 CO 또는 CO2로 분해되고, 생성되는 K2O가 다시 섬유의 탄소와 반응하는 것으로 추정하고 있다. 따라서 섬유의 표면 탄소층과 알칼리 화합물의 칼륨이 상호 반응함으로써 탄소가 이탈하며, 제거된 탄소의 위치에 세공이 형성된다 (Hsiao et al., 2011; Pinero et al., 2005; Rodenas et al., 2003).
| (4) |
| (5) |
| (6) |
| (7) |
| (8) |
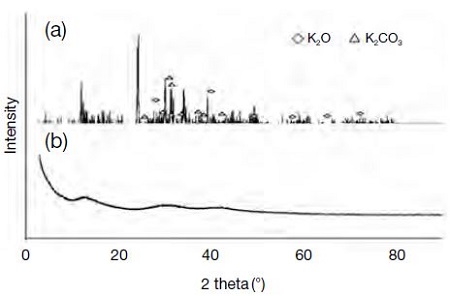
본 연구에서는 식 (4)~(8)의 반응을 확인하기 위하여 활성화를 거치면서 발생하는 화학적 변화를 XRD 분석을 실시하였다. 그림 8은 활성화 실시 후, 세척 단계를 거치지 않은 활성탄소섬유를 XRD로 고찰한 결과이다.
KOH 담지 및 활성화가 진행되면 식 (4)~(8)의 반응이 동시에 일어나며, 최종적으로 K2CO3, K2O, K 등이 형성되어 시료 표면에 잔존하게 된다. 그러나 고온에서의 활성화가 진행되는 동안 증기상의 칼륨은 반응기 외부로 배출된다. 이는 칼륨의 끊는점이 762°C이기 때문에 활성화 온도인 800°C에서 가스 상태로 배출되는 것으로 판단된다 (Tseng et al., 2008). 따라서 K2CO3와 K2O만이 섬유 표면에 남아있으며, XRD 분석을 통해 이러한 반응을 확인하였다. 이러한 칼륨화합물은 물에 대한 용해도가 높은 수용성이기 때문에 뜨거운 물에서 쉽게 용해되어 고체상 활성탄소섬유로부터 제거할 수 있다.
3. 4 이산화탄소 흡착능 고찰
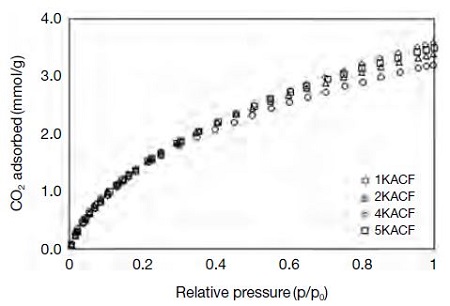
시험제조한 활성탄소섬유의 이산화탄소 흡착량을 흡착압력에 따라 측정하여 그림 9에 나타내었으며, 각 시료의 최대 흡착능을 표 5에 요약하였다. 이산화탄소 흡착량은 1KACF, 2KACF, 4KACF, 5KACF 순으로 각각 3.20 mmol/g, 3.39 mmol/g, 3.59 mmol/g, 3.50 mmol/g으로 측정되었다. 따라서 KOH의 농도에 따라서 비표면적과 세공 분포의 변화가 일어나고, 그에 따른 흡착점의 증가로 이산화탄소의 흡착량이 증가하는 것을 알 수 있다 (Heidari et al., 2014; Caglayan and Aksoylu, 2013; Lee and Park, 2013).
그러나 5M KOH로 제조한 활성탄소섬유 (5KACF)는 오히려 감소하였다. 이러한 감소는 이산화탄소 흡착량이 비표면적과 세공의 부피가 증가하는 4KACF까지 증가하지만, 비표면적과 세공의 부피가 감소되는 5KACF에서는 감소하였음을 확인하였다. 따라서 이산화탄소의 흡착량은 비표면적과 세공의 부피가 가장 높은 4KACF에서 가장 높게 측정되었고, 이에 따라 4M KOH 수용액상에 침적하여 제조한 활성탄소섬유가 이산화탄소 흡착에 가장 적합할 것으로 판단된다. 가장 낮은 흡착량을 가지는 1KACF와 가장 높은 흡착량을 보이는 4KACF의 차이는 0.39 mmol/g이다. 결국 1KACF와 4KACF의 비표면적의 차이가 516 m2/g이였던 바, 표면적의 증가는 1KACF에 대해서 4KACF가 70% 정도 증가하였지만, 그에 반해 이산화탄소의 흡착량은 15% 증가하였다. KOH의 농도가 증가함에 따라 비표면적 및 세공의 부피가 증가하였지만, 전체 세공에 대한 미세공의 상대적인 분포 (VT/Vmicro)는 1KACF (0.950)와 4KACF (0.950)가 차이가 없었기 때문에 이산화탄소의 흡착량이 크게 증가하지 않았다 (Cong et al., 2015; Park and Kim, 2001). 일반적인 고체흡착제에서 기체분자를 물리적으로 흡착할 때 기체분자는 반데르발스의 힘에 의해 표면흡착이 이루어진다. 흡착제의 흡착능 (adsorption potential)은 미세공이 많을수록 활성점이 증가하고, 포텐셜우물 (potential well) 또한 현저히 많이 생성될 수 있으므로 기체분자와 흡착제 표면간의 결합에너지가 높아지고, 흡착력이 강해진다. 따라서 활성탄소섬유의 표면 미세공이 차지하는 비율이 높을수록 이산화탄소 분자에 대한 흡착량이 향상될 수 있다 (Lee and Park, 2013; Sevilla and Fuertes, 2012).
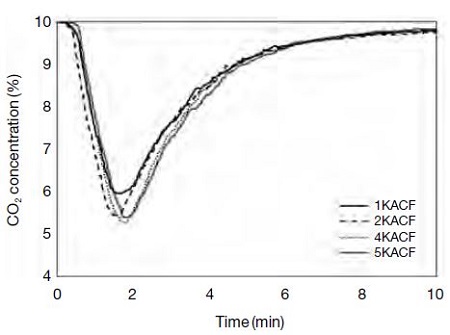
10% 농도흐름에서 활성탄소섬유의 파과곡선을 그림 10에 나타내었으며 흡착량은 표 6에 나타내었다. 이산화탄소 흡착량은 미세하지만 4KACF>5KACF>2KACF>1KACF 순으로 산출되었다. 이는 앞서 측정한 순수 이산화탄소 흐름에서의 흡착량과 유사한 경향이며, 흡착량은 4KACF가 1.50 mmol/g으로 가장 높게 나타났다. 10% 농도의 이산화탄소 흐름에 대해서도 순수 이산화탄소의 경우와 마찬가지로 흡착량은 흡착제의 비표면적과 세공의 부피와 비례하는 것으로 나타났다. 이산화탄소의 농도가 낮아지더라도 흡착에 영향을 주는 인자인 표면구조가 중요하지만, 90%를 차지하고 있는 다른 기체분자에 의해 표면 활성점이 경쟁적으로 포화될 여지가 있다. 따라서 상대적으로 저농도 흐름에서 흡착량이 감소한 것으로 판단된다. 이러한 물리적 흡착의 한계를 극복하기 위하여 세공이 잘 발달된 활성탄소섬유의 화학작용기를 부여함으로써 타 기체분자에 대한 이산화탄소의 선택도를 향상시키는 연구가 이루어지고 있다 (Lee and Park, 2013).
4. 결 론
본 연구에서는 이산화탄소 흡착을 위한 흡착제로서의 활성탄소섬유를 제조함에 있어서 활성화를 촉진시키기 위한 보조제로서 수산화칼륨을 활용하였으며, 다음과 같은 결론을 도출하였다.
활성화제로서 KOH는 4몰의 수용액이 가장 높은 비표면적 (1226 m2/g)과 세공부피 (0.483 cm3/g)를 갖는 것으로 나타났으며, 이는 KOH의 농도가 증가할수록 섬유의 탄소층과 칼륨의 반응이 활발하게 일어나 비표면적과 세공의 부피를 증가시키기 때문인 것으로 파악되었다. 그러나 KOH의 농도가 지나치게 높아질 경우에는 세공의 파괴 및 막힘 현상으로 오히려 비표면적과 표면적이 감소하는 것으로 나타났다.
고온의 활성화 과정 후에 ACF의 표면에 생성되는 불순물들은 표면 활성점들을 감소시키는 현상이 눈에 띄게 나타났는 바, 흡착제로서 활용하기 위하여는 세척과정이 필수적임을 알 수 있었다. 본 연구에서 제조한 활성탄소섬유 가운데 4KACF가 최대 3.59 mmol/g의 이산화탄소 흡착능을 보여주었으며, 10% 이산화탄소 흐름에서는 1.50 mmol/g의 흡착량이 측정되었다. 한편, 각 시료에 따른 이산화탄소의 흡착량 차이가 비표면적의 증가량에 비해 적은 이유는 비표면적과 미세공의 부피가 증가하여 흡착량이 증가하였지만, 미세공의 비율에 대한 차이가 적기 때문에 흡착량이 크게 증가하지 않는다. 또한 이산화탄소의 농도가 낮을수록 이산화탄소의 흡착량은 비표면적과 세공의 부피의 영향을 적게 받는 것으로 판단된다.
Acknowledgments
본 연구는 한국연구재단 이공분야기초연구사업의 지원으로 수행된 연구입니다 (NRF-2015R1D1A1A010 60182).
References
- Bouchelta, C., M.S. Medjram, O. Bertrand, and J.P. Bellat, (2008), Preparation and characterization of activated carbon from date stones by physical activation with steam, J. Anal. Appl. Pyrolysis, 82(1), p70-77.
-
Caglayan, B.S., and A. Er. Aksoylu, (2013), NO2 adsorption on chemically modified activated carbon, J. Hazard. Mater, 252/253, p19-28.
[https://doi.org/10.1016/j.jhazmat.2013.02.028]

- Castello, D.L., M.A.L. Rodenas, D.C. Amoros, and A.L. Solano, (2001), Preparation of activated carbons from spanish anthracite Ⅰ. Activation by KOH, Carbon, 39(5), p741-749.
- Chen, J.C., and I.R. Harrison, (2002), Modification of polyacrylonitrile (PAN) carbon fiber precursor via post-spinning plasticization and stretching in dimethylformamide (DMF), Carbon, 40(1), p25-45.
- Cong, H., M. Zhang, Y. Chen, K. Chen, Y. Hao, Y. Zhao, and L. Feng, (2015), Highly selective CO2 capture by nitrogrn enriched porous carbons, Carbon, 92, p297-304.
- Diez, N., P. Alvarez, M. Granda, C. Blanco, R. Santamaria, and R. Menendez, (2015), CO2 adsorption capacity and kinetics in nitrogen-enriched activated carbon fibers prepared by different methods, Chem. Eng. J, 281, p704-712.
- Heidari, A., H. Younesi, A. Rashidi, and A.A. Ghoreyshi, (2014), Evaluation of CO2 adsorption with eucalyptus wood based activated carbon modified by ammonia solution through heat treatment, Chem. Eng. J, 254, p503-513.
- Hong, H.E., A.A. Adelodun, and Y.M. Jo, (2013), Preparation of KOH impregnated AC pellets for selective CO2 capture, J. Odor Indoor Environ, 12(4), p203-210.
- Hsiao, H.Y., C.M. Huang, M.Y. Hsu, and H. Chen, (2011), Preparation of high-surface-area PAN-based activated carbon by solution-blowing process for CO2 adsorption, Sep. Purif. Technol, 82, p19-27.
- Huang, X., (2009), Fabrication and properties of carbon fibers, Mater, 2(4), p2369-2403.
- Lee, K.J., N. Shiratori, G.H. Lee, J. Miyawaki, I. Mochida, S.H. Yoon, and J. Jang, (2010), Activated carbon nanofiber produced from electrospun polyacrylonitrile nanofiber as a highly efficient formaldehyde adsorbent, Carbon, 48(15), p4248-4255.
- Lee, S.Y., and S.J. Park, (2013a), Determination of the optimal pore size for improved CO2 adsorption in activated carbon fibers, J. Colloid. Interface Sci, 389(1), p230-235.
- Lee, S.Y., and S.J. Park, (2013b), Effect of CO2 activation on electrochemical performance of microporous carbons derived from poly (vinylidene fluoride), J. Solid Stats Chem, 207, p158-162.
- Leung, D.Y.C., G. Caramanna, and M.M. Maroto-Valer, (2014), An overview of current status of carbon dioxide capture and storage technologies, Renewable and Sustainable Energy Rev, 39, p426-443.
- Meng, L.Y., and S.J. Park, (2012), MgO-templated porous carbon-based CO2 adsorbents produced by KOH activation, Mater. Chem. Phys, 137(1), p91-96.
- Nan, D., J. Liu, and W. Ma, (2015), Electrospun phenolic resinbased carbon ultrafine fibers with abundant ultrasmall micropores for CO2 adsorption, Chem. Eng. J, 276, p44-50.
- Paiva, M.C., P. Kotasthane, D.D. Edie, and A.A. Ogale, (2003), UV stabilization route for melt-processible PANbased carbon fibers, Carbon, 41(7), p1399-1409.
- Park, S.J., and K.D. Kim, (2001), Influence of activation temperature on adsorption characteristics of activated carbon fiber composites, Carbon, 39(11), p1741-1746.
- Pinero, E.R., P. Azais, T. Cacciaguerra, D.C. Amoros, A.L. Solano, and F. Beguin, (2005), KOH and NaOH activation mechanisms of multiwalled carbon nanotubes with different structural organisation, Carbon, 43(4), p786-795.
- Rambabu, N., R. Azargohar, A.K. Dalai, and J. Adjaye, (2013), Evaluation and comparison of enrichment efficiency of physical/chemical activations and functionalized activated carbons derived from fluid petroleum coke for environmental applications, Fuel Process. Technol, 106, p501-510.
-
Ramesh, T., S. Su, X.X. Yu, and J.S. Bae, (2013), Application of acarbon fibre composites to CO2 capture from flue gas, Int. J. Greenh. Gas Control, 13, p191-200.
[https://doi.org/10.1016/j.ijggc.2012.12.014]

- Rodenas, M.A.L., D. Cazorla-Amoros, and A. Linares-Solano, (2003), Understanding chemical reactions between carbons and NaOH and KOH, Carbon, 41(2), p267-275.
- Sait, Y., and Y. Derya, (2015), Preparation and characterization of activated carbons from Paulownia wood by chemical activation with H3PO4, J. Taiwan Inst. Chem. E, 53, p1-10.
- Shakerian, F., K.H. Kim, J.E. Szulejko, and J.W. Park, (2015), A comparative review between amines and ammonia as sorptive media for post-combustion CO2 capture, Appl. Energy, 148, p10-22.
- Tseng, R.L., S.K. Tesng, F.C. Wu, C.C. Hu, and C.C. Wang, (2008), Effect of micropore development on the physicochemical properties of KOH-activated carbons, J. Chin. Inst. Eng, 39(1), p37-47.
- Unai, I.V., L.A. Jose, Z. Lorena, and S. Irene, (2014), An insight into the reactions occurring during the chemical activation of bone char, Chem. Eng. J, 251, p217-227.
- Xiaojun, M., F. Zhang, J. Zhu, L. Yu, and X. Liu, (2014), Preparation of highly developed mesoporous activated carbon fiber from liquefied wood using wood charcoal as additive and its adsorption of methylene blue from solution, Bioresour. Technol, 164, p1-6.
- Yoon, S.H., S.Y. Lim, Y. Song, Y. Ota, W. Qiao, A. Tanaka, and I. Mochida, (2004), KOH activation of carbon nanofibers, Carbon, 42(8-9), p1723-1729.
-
Yusof, N., and A.F. Ismail, (2012), Post spinning and pyrolysis processes of polyacrylonitirle (PAN)-based carbon fiber and activated carbon fiber: A review, J. Anal. Appl. Pyrolysis, 93, p1-13.
[https://doi.org/10.1016/j.jaap.2011.10.001]