질산철을 이용하여 표면개질된 활성탄의 황화수소 흡착
Copyright © 2015 Korean Society for Atmospheric Environment
Abstract
The purpose of this study was to fabricate a ferric nitrate impregnated activated carbon, and the performance for hydrogen sulfide by adsorption was evaluated. Sodium hydroxide was utilized to control pH in the process during generation of ferric hydroxide on the surface of the carbon. Critical mixing duration for generation of ferric hydroxide on the carbon was 48 hrs at pH 1 of the solution, in which the chemical adsorption of hydrogen sulfide was enhanced. The adsorption capacity of the impregnated carbon increased up to 0.10 g hydrogen sulfide/g carbon, which was 4.3 times higher than that of the raw carbon. Presence of FeOOH on the surface of the impregnated carbon was examined by X-ray diffraction.
Keywords:
Hydrogen sulfide, Impregnated activated carbon, Adsorption1. 서 론
황화수소는 석유 및 천연가스 관련시설, 발전시설을 포함한 다양한 산업시설에서 발생되며, 독성과 부식성이 가지고 있어 주요한 대기오염물질로 인식되고 있다(Aslam et al., 2015; Huang et al., 2006). 배출가스 내의 황화수소를 처리하는 기술에는 흡착, 흡수, 막분리, 생물학적 분해 등이 알려져 있으며, 적정기술 확보를 위한 기술 개발이 요구되고 있다(Lee et al., 2009; Boubel et al., 2000; Kim et al., 2000).
흡착공정은 활성탄, 활성 알루미나, 제올라이트, 실리카겔 등이 흡착제로 이용된다. 흡착제 중 활성탄은 다목적 흡착제로서 많이 사용되는 재질로 알려져 있으며, 다양한 공정에서 활용되고 있다 (Banasala and Goyal, 2005). 활성탄 (activated carbon)은 다른 합성물에 비하여 화학적, 열적, 방사성적 안정성이 높으며 기계적 강도 및 견고한 기공구조 등의 측면에서 장점이 있다(Lee and Park, 2003). 하지만 활성탄의 표면은 비극성이기 때문에 분자량이 작거나 상대적으로 극성을 가진 물질에서는 가스흡착에 불리한 것으로 알려져 있다(Lee et al., 2013; Kim et al., 2005a). 따라서 가스흡착을 위하여 활성탄 표면에 작용기 (Functional group)을 형성하여 화학적 흡착을 도모할 수 있다(Banasal and Goval, 2005).
화학적 흡착능을 증대시킬 목적으로 표면을 개질할 경우에 개질 조건에 따라 흡착 특성에 영향을 주며, 특히 제조 용액의 종류 및 pH, 화학물질의 첨가속도, 개질과정의 교반속도 및 건조시간이 중요한 인자로 알려져 있다(Lee et al., 2002). Xiao et al. (2008)은 석탄계 활성탄을 6% Na2CO3용액으로 개질하였으며, 개질 활성탄의 황화수소 흡착능은 황화수소 유입농도에 따라 다소 차이는 있지만 비개질 활성탄(0.002~0.003 g/g)과 비교하여 약 3.5배 증가하였다. Sitthikhankaew et al. (2014)의 연구에서는 7% KOH용액으로 개질된 활성탄의 황화수소 흡착능은 건가스 조건에서 4.3 L/100 g (0.061 g/g)으로 나타났다. Huang et al. (2006)는 활성탄에 Cu (NO3)2를 첨착시켜 비개질 활성탄의 황화수소 흡착능 0.127 mmol/g (0.004 g/g)를 1.364 mmol/g (0.046 g/g)으로 10배 가량 향상시켰으며, 첨착용액의 pH는 3, 첨착용액의 농도는 0.2M에서 최고 흡착능을 보이는 것으로 확인하였다. Poulton et al. (2004)의 연구에서는 철 촉매의 생성에 사용되는 제조용액(염화철, 황화철, 질산철)의 종류와 pH에 따라 가스와의 반응성이 상이할 수 있다고 밝히고 있다. 이와 같이 활성탄의 표면에 작용기(-OH, -COOH등) 생성과 철촉매 형성을 통해 황화수소의 화학적 흡착을 도모한 연구가 보고되고 있다.
본 연구는 질산철을 이용하여 활성탄의 표면을 개질하였으며, 개질 조건이 활성탄의 황화수소 흡착 특성에 미치는 영향을 평가하였다. 본 연구의 개질 조건 대상은 제조 용액의 pH, 교반시간 및 건조시간이었다. 개질 활성탄의 흡착능은 컬럼 흡착 실험을 통해 산출하였으며, 활성탄의 표면 분석을 통해 흡착 특성을 조사하였다.
2. 실험 방법
2. 1 개질 활성탄 제조
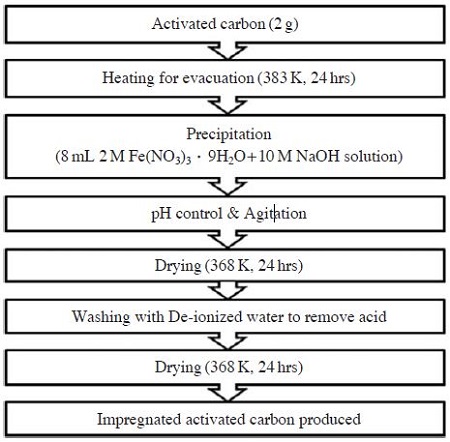
본 연구에서는 Chen et al. (2007)이 제안한 활성탄 개질방법을 일부 수정한 질산철 침전법을 이용하여 개질 활성탄을 제조하였다. 개질에 사용된 용액은 강산으로 알려진 2M Fe(NO3)3∙9H2O와 pH 조절용 10 M NaOH이 선정되었다. 그림 1은 개질활성탄의 제조과정을 보여준다.
표면 개질에 사용된 흡착제는 8×16 mesh 크기의 석탄계 활성탄(JCG-20, 자연과학산업 (주))이며, 활성탄에 함유되어 있는 불순물을 제거하기 위해 증류수로 3회 세척 후 110°C에서 24시간 동안 건조하여 사용하였다. 세척∙건조된 활성탄 2 g을 2M Fe(NO3)3∙9H2O 8 mL과 혼합한 후, 10 M NaOH용액을 추가 혼합하였다. NaOH의 투입부피는 달리하여 최종 용액의 pH가 각각 1, 4, 6, 8, 12가 되도록 준비하였다. 활성탄이 혼합된 용액시료는 교반기를 통해 0~72 hr 동안 교반되었으며, 교반이 완료된 시료는 95°C에서 0~48 hr 동안 건조하였다. 본 연구에서는 개질 용액의 pH, 교반시간, 건조시간을 주요 개질 조건으로 보고, 개질 조건별 활성탄을 제조하여 평가하였다.
2. 2 파과실험
본 연구의 파과실험은 유리 재질의 원통반응기를 사용하였으며, 반응기의 전체부피는 11.8 mL이었다(내부직경 10 mm, 높이 150 mm). 모든 실험에서 반응기에 충전된 활성탄의 높이는 60 mm이었다. 황화수소 가스(N2 balance, Air Korea Inc. Korea)는 0.3 L/min의 유속으로 혼합챔버를 통해 원통반응기에 유입되었으며, 황화수소의 유입농도는 3,333 ppm이었다. 황화수소의 공탑체류시간은 2.4초였다. 유입농도의 10%(333 ppm)가 유출되는 시점을 파과시점으로 보고 실험을 종료하였으며, 파과시점을 기준으로 흡착능을 계산하였다. 황화수소 가스 흡착량과 흡착능은 식(1)과 식(2)로 계산되었다.
| (1) |
여기서, Ci와 Cout은 황화수소 가스의 유입농도와 유출농도 (g/L), t는 흡착시간 (min), Q는 유량(L/min), Mads는 흡착된 량(g)이다.
| (2) |
여기서, ML은 반응기에 충전된 활성탄의 양 (g)이며 W는 흡착능(g/g)으로 표현된다.
2. 3 분석방법
황화수소 가스의 유출농도는 광이온화방식(PID)의 센서(TG-501, Graywolf sensing solution, US)를 사용하여 실시간 측정되었다. 또한, 고농도의 황화수소가 유출될 경우에는 유출가스를 주기적으로 채취하여 펄스형 불꽃광도 검출기(Pulsed Frame Photometric Detector 5380, O∙I analytical, USA)가 장착된 가스크로 마토그래피(YL 6100GC, YoungLin Instrument, Korea)를 사용하여 분석하였다.
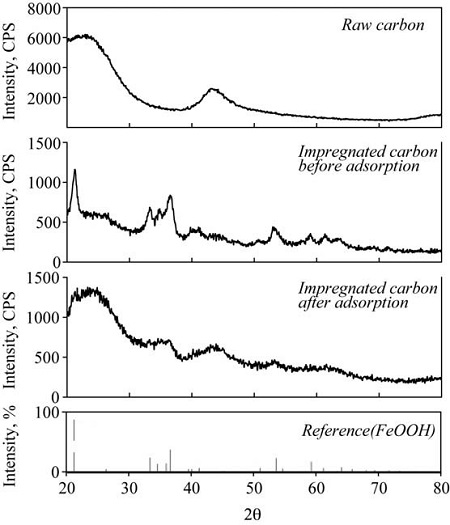
활성탄 표면의 기공분포 특성은 표면특성분석장치(Brunauer-Emmett-Teller, BELSORP-mini II, BEL Japan Inc., Japan)를 사용하여 N2 gas를 이용한 흡∙탈착 측정을 통해 분석되었다. 활성탄 표면의 구조는 주사전자현미경(Scanning Electro Microscope, Texcan vega3, Tescan Korea Inc.)을 사용하였으며, 3000 또는 5000배의 배율로 표면을 관찰하였다. 활성탄 표면에 첨착된 철 성분의 함량을 알기 위하여 ED-XRF (Energy Dispersive X-ray Fluorescence Spectrometer, ARL QUANT’X, Thermo Fisher Scientific, USA)을 사용하였으며 16~20 kV 조건에서 분석하였다. 또한 활성탄 표면에 수산화철의 형성여부를 파악하고자 XRD (Xray Diffractometer, X’Pert Pro-MNR, Philps, USA)을 사용하였으며 40 kV 조건에서 표면결정상을 분석하였다.
3. 결과 및 고찰
3. 1 제조용액 pH의 영향
침전법으로 철 침전이 활성탄 표면에 생성될 때 영향을 주는 요인으로 용액 pH, 침전제 종류 및 첨가속도, 교반속도, 숙성조건 등이 있다. 용액 pH는 표면 산소관능기와 수산화철의 양을 결정한다. 황화수소는 철산화물과 철수산화물과 쉽게 반응하기 때문에 활성탄 표면에 철산화물 또는 철수산화물을 형성하게 되면 우수한 흡착능을 보일 수 있다(Wan et al., 2010; Lee et al., 2002).
본 실험에서는 침전생성용 용액에 NaOH를 가하여 각각 pH 1, 4, 6, 8, 12로 조절하였다. 제조된 개질 활성탄의 파과실험 결과는 그림 2와 같다. 낮은 pH에서 우수한 흡착특성을 보였으며, pH 1에서 흡착능 0.063 g/g을 나타냈다. pH가 낮을수록 활성탄 표면에 산성관능기가 증가할 수 있고, 흡착에 유리한 활성 표면적을 형성하는 것으로 볼 수 있다(Jeong et al., 2005). 또한 pH가 높아질수록 생성되는 수산화철의 생성량이 증가할 수 있으며, 활성탄의 기공을 막아 흡착능을 저해하는 요인이 될 수 있다. 이러한 현상은 개질활성탄의 표면 특성 분석에서 확인할 수 있었다.
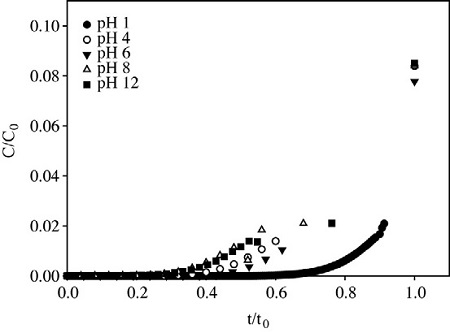
Breakthrough curves of impregnated carbon with different pH of solution (test samples were made in the condition of 1 hr of mixing time and 24 hr of drying).
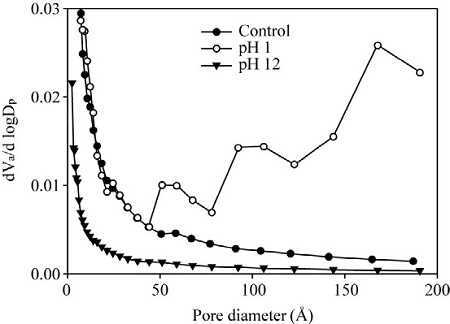
그림 3은 개질 활성탄의 기공 특성을 보여준다. 비개질 활성탄의 비표면적은 1111.3 m2/g이었고, pH 1에서 개질된 활성탄은 878.16 m2/g, pH 12의 경우에는 99.904m2/g을 보였다. pH 1에서 공극분포는 미세기공 (micropore) 영역에서 비개질 활성탄과 비교하여 다소 낮은 기공부피를 보였고, 중기공 (mesopore) 영역에서 기공부피가 증가함을 확인하였다. 개질활성탄 제조과정 중에서 사용한 강산이 활성탄 표면의 미세기공을 붕괴시켜 중기공의 영역이 증가하는 것으로 볼 수 있다(Han, 2001). 반면에 pH 12에서는 비개질 활성탄에 비해 현저하게 낮은 기공부피를 보이고 있다. pH 1의 조건과 비교하여 강산에 의한 작용은 없었지만, 개질과정 중 사용된 용액의 매질에 의해 미세기공이 막히는 현상이 발생한 것으로 보인다(Shim et al., 1997). Yang et al. (2008)의 연구에서는 활성탄 표면 기공크기의 감소 원인을 철 입자에 의한 기공 폐쇄에서 찾았으며, pH가 증가할수록 철 이온이 수산화기와 반응하여 침전물이 형성되고 활성탄의 내부 미세기공으로의 접근성이 떨어진다고 보고하였다. 다만, 개질활성탄은 제조과정 중 기공이 감소하고 물리적 흡착이 저해될 수 있지만, 철 첨착에 의한 화학적 흡착은 도모될 것으로 기대할 수 있다.
그림 4는 비개질 활성탄과 pH 1, pH 12로 개질된 활성탄의 표면을 전자주사현미경(SEM)으로 분석한 결과이며, 그림 3의 결과를 이해하는 데 도움을 준다. pH 1에서 개질된 활성탄의 표면(그림 4-a)는 표면이 깨끗하고 부드러운 모습을 확인할 수 있으며, 침전법으로 생성된 물질이 표면 전체에 얇게 펼쳐진 것으로 보인다. 반면에 흡착후의 표면 (그림 4-b)은 황화수소와 표면 생성 물질과 반응하여 흡착된 것으로 사료된다. pH 12에서 개질된 활성탄 (그림 4-c)는 비개질 활성탄 (그림 4-d)에 비해 표면이 부드럽지만 기공이 막혀 있는 것으로 보이며, 이러한 현상은 위에서 언급한 바와 같이 철 침전물의 형성에 의한 활성탄의 내부 미세기공의 막힘에서 기인되었다고 볼 수 있다.
3. 2 교반시간 및 건조시간의 영향
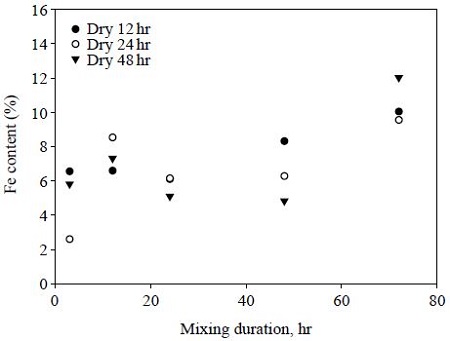
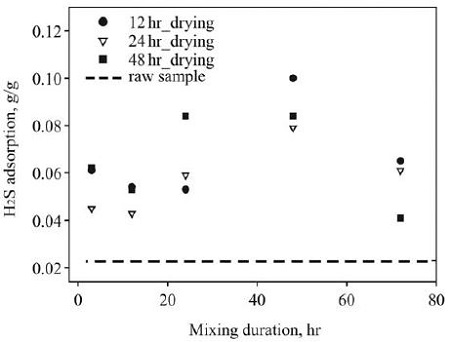
활성탄 개질과정 중 질산철 용액과 활성탄을 혼합한 후의 교반시간과 교반 종료 후의 건조시간에 따른 황화수소 흡착특성의 변화를 관찰하고자 하였다. 흡착제 제조는 pH 1로 조절된 질산철 용액을 이용하여 진행되었다. 그림 5는 개질조건 (건조시간과 교반시간)과 개질활성탄의 표면에서 분석된 철 함량과의 관계를 보여준다. 건조시간과 상관없이 교반시간이 증가할수록 철 함량이 커지는 것을 확인할 수 있으며, 건조시간과 철 함량과는 뚜렷한 상관성을 확인할 수 없었다. 그림 6은 교반시간과 건조시간에 따른 황화수소의 흡착량 (g/g)을 보여준다. 건조시간에 상관없이 교반시간이 길어질수록 황화수소의 흡착량은 증가하지만, 48 hr 이후에는 감소하는 현상이 관찰되었다. 48 hr 교반시간에서 12 hr 건조된 개질 활성탄의 황화수소 흡착능은 0.10 g/g이었다. 비개질 활성탄의 황화수소 흡착능은 0.023 g/g이었다. 그림 5와 그림 6을 연관하여 고찰해 보면, 철 함량과 황화수소 흡착량은 선형적 상관성이 없는 것으로 볼 수 있다. 이는 황화수소 흡착을 위한 흡착제 개질의 최적조건이 존재함을 의미하며, 본 연구에서는 48 hrs 교반조건에서 상대적으로 우수한 황화수소 흡착을 보였다. Park et al. (2012)는 염화철을 이용하여 표면개질활성탄을 제조하였고, 생성된 철 형태의 물질이 활성탄 기공 내부로 분산되는 정도에 따라 흡착능이 결정된다고 보고하였다.
표 1은 BET분석에 의한 활성탄의 기공 특성을 보여주고 있다. 일반 활성탄의 비표면적은 1111.3m2/g이었으며, 개질한 활성탄은 그 이하를 나타냈다. 또한 개질 활성탄의 기공 변화는 중기공 영역에서 진행된 것으로 확인되었다(data not provided). 비표면적이 감소하는 이유는 첨착과정 중 첨착물질이 활성탄 표면으로 확산되었기 때문에 일어난 현상으로 보이며(Huang et al., 2006), 중기공 영역의 기공 변화는 산용액의 영향(Yang et al., 2008; Han, 2001; Shim et al., 1997)으로 유추할 수 있다.
본 실험에서 제조된 활성탄의 개질기작은 질산철 용액과 수산화나트륨이 반응하여 생성된 수산화철(Fe(OH)3, FeOOH)이 활성탄 표면에 첨착(식 3, 식 4)되고, 첨착된 수산화철은 황화수소와 결합하여 황화철을 생성(식 5)한 것으로 유추된다. Wiecrorek-Ciurowa and Kozak (1999)의 연구에 의하면 질산염철은 온도가 상승함에 따라 열분해 과정을 거쳐 FeOH(NO3)2, Fe (OH)2NO3, FeOOH, Fe2O3으로 변화된다고 보고하였다.
(3) Fe(NO3)3+3NaOH → Fe(OH)3+3NaNO3(4) Fe(NO3)3+3NaOH → FeOOH+3NaNO3+H2O
(3) Fe(OH)3+3/2H2S → FeS+1/2S+3H2
그림 7은 X선 회절 분석법에 의한 활성탄 표면의 결정구조를 보여주고 있으며, 개질활성탄에서 수산화철인 FeOOH를 확인할 수 있다. 또한, 흡착 전과 후의 개질활성탄이 결정구조가 확연히 차이가 남을 확인할 수 있으며, 이는 황화수소의 화학적 흡착에서 기인된 것으로 볼 수 있다. X선 회절 분석의 결과에서 파고분포가 선명하지 않은 이유는 활성탄 표면에서 철 산화물이 결정성이 높지 않은 상태로 존재하고 있는 것에서 그 원인을 유추할 수 있다.
4. 결 론
본 연구에서는 8×16 mesh의 석탄계활성탄을 원료로 침전법을 통해 생성된 철 촉매를 첨착하여 개질활성탄을 제조하였다. 이때 개질활성탄의 개질조건인 pH, 교반시간 및 건조시간이 황화수소 흡착에 미치는 영향을 파악하고자 파과실험으로 흡착능력을 확인하였으며, 흡착제 표면분석을 통해 그 흡착특성을 평가하였다. 본 실험을 통해 다음과 같은 결론을 얻었다.
- 1) 개질활성탄의 개질조건인자에서 제조용액의 pH가 1일 때, 황화수소 흡착능력이 0.063 g/g으로 가장 우수하며 pH가 낮을수록 흡착에 유리한 활성표면적을 형성하는 것을 확인하였다. 이는 비개질 활성탄의 흡착능력에 비해 2.7배 높은 결과를 보여주었다.
- 2) 개질활성탄 표면분석결과 pH 1에서 비개질 활성탄과 비교하여 비표면적은 878.16m2/g으로 낮았지만, 표면에 첨착된 수산화철의 영향으로 흡착능력은 더 우수한 것으로 확인되었다. pH 12의 경우 비표면적이 99.90 m2/g로 현저하게 낮았으며, 표면기공이 생성된 철 침전물의 영향으로 기공이 막혀있는 모습을 확인 할 수 있었다.
- 3) 개질활성탄의 제조인자 중 건조시간이 흡착특성에 미치는 영향은 확인할 수 없었으나, 교반시간의 경우 48 hr에서 가장 적합한 제조조건으로 판단되었다. 이 조건에서 황화수소 흡착능은 0.10 g/g을 보였다.
- 4) Fe(NO3)3∙9H2O용액과 NaOH용액으로 침전법을 이용하여 생성된 철 촉매인 수산화철 개질활성탄의 제조 가능성을 확인하였으며, XRD분석으로 활성탄 표면의 결정구조를 분석한 결과 FeOOH이 개질활성탄 표면에 존재하는 것을 확인하였다.
Acknowledgments
본 연구는 환경부 글로벌탑 환경기술개발사업 중 Non-CO2 온실가스 저감기술개발 사업단 (RQ201310018)과 교육과학기술부의 재원으로 한국연구재단의 기초연구사업 지원(2012R1A1A1005320)을 받아 수행된 것임.
References
-
Aslam, Z., R.A. Shawabkeh, I.A. Hussein, and N. Al-Baghli, (2015), Synthesis of activated carbon from oil fly ash for removal of H2S from gas stream, Appl. Surf. Sci., 327, p107-115.
[https://doi.org/10.1016/j.apsusc.2014.11.152]

-
Banasal, R.C., and M. Goyal, (2005), Activated carbon adsorption, CRC Press, USA, p52-60.
[https://doi.org/10.1201/9781420028812]

- Boubel, R.W., D.L. Fox, D.B. Turner, and A.C. Sterm, (2000), Fundamentals of air pollution, 3rd ed., Academic Press, p223-225.
-
Chen, W., R. Paratte, J. Zou, F.S. Cannon, and B.A. Dempsey, (2007), Arsenic removal by iron-modified activated carbon, Water Res., 41(9), p1851-1858.
[https://doi.org/10.1016/j.watres.2007.01.052]

- Han, J.S., (2001), The effect of the porous texture and the surface chemistry of activated carbon on adsorption of hydrogen sulfide, Yonsei University Graduate Thesis.
-
Huang, C.C., C.H. Chan, and S.M. Chu, (2006), Effect of moisture on H2S adsorption by copper impregnated activated carbon, J. Hazard. Mater., 136(3), p866-873.
[https://doi.org/10.1016/j.jhazmat.2006.01.025]

- Jeong, Y.H., (2005), Activated carbon, DongHwa technique, p96-100.
- Kim, D.J., S.G. Seo, and S.C. Kim, (2005a), Removal of odor containing sulfur compound, methyl mercaptan using modified activated carbon with various acidic chemicals, J. Korean Soc. Atmos. Environ., 21(2), p155-160, (in Korean with English abstract).
- Kim, J.S., M.C. Kim, S.C. Park, J.M. Seo, J.D. Jeong, I.J. Cho, K.S. Cha, and G.S. Hwang, (2000), Air pollution control technology, DongHwa technique, p391-404.
-
Kim, K.H., E.C. Choi, and Y.S. Jeon, (2005b), Characterization of malodourous sulfur compounds in landfill gas, Atmos. Environ., 39(6), p1103-1112.
[https://doi.org/10.1016/j.atmosenv.2004.09.083]

- Lee, H.Y., and, Seoul National University Alumni of Perforation Laboratory, (2002), Catalytic processes, Seoul National University Publishing department, p43-70.
- Lee, S.K., and Y.S. Park, (2003), Adsorption characteristics of H2S on the impregnated granular activated carbon with diethanolamine, J. Korean Soc. Environ. Eng., 2(25), p567-573, (in Korean with English abstract).
-
Lee, S.W., G.O. Oh, R.N. Kim, and D.K. Kim, (2013), Surface properties of modified activated carbon for ammonia gas removal, J. Korean Soc. Atmos. Environ., 29(3), p317-324, (in Korean with English abstract).
[https://doi.org/10.5572/KOSAE.2013.29.3.317]

- Lee, T.Y., J.K. Lee, and J.K. Lee, (2009), Determination of Major Reduced Sulfur Gases Emitted from Wastes stored in Environmental Facility Using GC/FPD, J. Korean Geo-Environ. Soc., 10(2), p37-43, (in Korean with English abstract).
-
Park, Y.R., S.H. Hong, J.H. Kim, and J.Y. Park, (2012), Arsenic Removal using the surface modified granular activated carbon treated with ferric chloride, J. Korean Soc. Water Wastewater, 26(1), p77-85, (in Korean with English abstract).
[https://doi.org/10.11001/jksww.2012.26.1.077]

-
Poulton, S.W., M.D. Krom, and R. Raiswell, (2004), A revised scheme for the reactivity of iron (oxyhydr) oxide minerals towards dissolved sulfide, Geochimica et Cosmochimica Acta, 68(18), p3703-3715.
[https://doi.org/10.1016/j.gca.2004.03.012]

- Shim, J.W., K.R. Ko, S.Y. Kim, B.H. Yang, and S.K. Ryu, (1997), Adsorption characteristics of acid, base treated activated carbon fiber, Theories and Application of Chem. Eng., 3, p2097-2100.
-
Sitthikhankaew, R., D. Chadwick, S. Assabumrungrat, and N. Laosiripojana, (2014), Effects of humidity, O2, and CO2 on H2S adsorption onto upgraded and KOH impregnated activated carbons, Fuel Process. Technol., 124, p249-257.
[https://doi.org/10.1016/j.fuproc.2014.03.010]

-
Wan, M.A., D. Wan, and H.H. Amir, (2010), Textural characteristics, surface chemistry and oxidation of activated carbon, J. Nat. Gas Chem., 19, p267-279.
[https://doi.org/10.1016/S1003-9953(09)60066-9]

-
Wieczorek-Cuirowa, K., and A.J. Kozak, (1999), The thermal decomposition of Fe(NO3)3∙9H2O, J. Therm. Anal. Calorim., 58, p647-651.
[https://doi.org/10.1023/A:1010112814013]

-
Xiao, Y., S. Wang, D. Wu, and Q. Yuan, (2008), Experimental and simulation study of hydrogen sulfide adsorption on impregnated activated carbon under anaerobic conditions, J. Hazard. Mater., 153(3), p1193-1200.
[https://doi.org/10.1016/j.jhazmat.2007.09.081]

-
Yang, N., S. Zhu, D. Zhang, and S. Xu, (2008), Synthesis and properties of magnetic Fe3O4-activated carbon nanocomposite particles for dye removal, Mater. Lett., 62(4-5), p645-647.
[https://doi.org/10.1016/j.matlet.2007.06.049]