상온망간촉매를 이용한 아세트알데하이드 오존산화에서 상대습도와 오존 유입량이 미치는 영향
Abstract
Ozone oxidation using a manganese catalyst at room temperature was applied to remove acetaldehyde, one of the hazardous air pollutants commonly emitted from domestic sources. The effects of relative humidity and ozone concentration on acetaldehyde removals were determined using a column study. In the dry condition, acetaldehyde removal efficiencies were maintained at greater than 99% by the catalytic ozonation, and CO2 selectivity increased from 27% to 64% with increasing the ozone concentration in the inlet. A mass balance on ozonation by-products indicated that the ozonation reactions for the acetaldehyde oxidation sequentially proceeded to by-products such as acetic acid, formaldehyde, formic acid, and ethylene and then CO2, the final product. As the relative humidity increased, water molecules competitively absorbed on the catalyst surface, resulting in a decrease in acetaldehyde removals and CO2 selectivities. Interestingly, the secondary reaction for the by-products oxidation was slightly enhanced in the presence of water vapor. Consequently, the acetaldehyde oxidation was hindered by the competition between water molecules and reactants; however, the adsorbed water vapor improved the oxidation of ozonation by-products in each reaction step. This finding can also be applied as a way to accelerate the oxidation reaction of by-products in the process of regenerating a catalyst deactivated by carbon deposition into ozone.
Keywords:
Acetaldehyde, Manganese catalyst, Relative humidity, Ozonation, Oxidation by-products1. 서 론
알데하이드류 오염물질은 폐기물 처리시설과 인쇄업, 아스팔트 제조업, 도료 제조업, 화석연료 소각시설 등에서 다량 배출된다 (Hwang et al., 2018; Yoon and Kim, 2012). 음식물 조리과정 또는 음식물쓰레기 처리장과 같은 생활 주변 배출원에서 발생하는 아세트알데하이드는 특정대기유해물질이며 동시에 지정악취물질로 분류되어 있어 관리대책이 요구된다. 특히 상온에서 음식물 폐기물의 부패과정에서 아세트알데하이드가 65~70 ppm의 높은 농도로 발생하여 (Kim et al., 2016), 수거 및 처리시설 주변에서 다양한 환경문제를 야기한다. 아세트알데하이드의 제거방법으로는 일반적인 방지기술인 흡착법이나 오존산화법 등이 통상적으로 적용되고 있다 (Kim, 2006). 그러나 생활주변 배출원에서의 아세트알데하이드 발생 특성상 상온에서 수분과 함께 배출되는 경우가 대부분이며, 따라서 흡착법이나 산화법 같은 전통적인 기술들은 처리효율이 감소한다. 결과적으로 기존 방지기술의 적용 및 유지관리에 어려움이 있으므로, 아세트알데하이드의 처리효율을 증가시키면서도 배출원 특성에 적합한 새로운 방지기술의 개발이 요구된다.
최근 오존산화법과 촉매를 동시에 적용하여 유기탄소화합물의 산화 효율을 높이는 방법이 다양하게 적용되고 있다. 촉매는 크게 귀금속 촉매 (Pt, Pd, Au)와 금속 촉매 (Al2O3, TiO2, CeO2, MnOx)로 분류되며, 고가의 귀금속 촉매를 대체할 수 있는 저가의 금속 촉매가 많이 이용된다. 특히 금속 촉매에 속하는 전이금속산화물 촉매 (Mn, Cr, Fe, Cu)는 전이금속산화물에 존재하는 산소와 금속원소의 결합구조가 불안정하여 흡착되는 산소에 높은 활성도를 가진다. 산소 활성도가 높을수록 오존 활성도가 증가하며, 표면에 흡착된 오존을 활성산소 (O- 또는 O2-)로 해리하는 과정에 유리하다. 그 결과 전이금속산화물 촉매는 상온에서 오존 분해 효율이 높은 것으로 알려져 있으며, 망간산화물 촉매가 효과적인 것으로 보고되었다 (Dhandapani and Oyama, 1997). 휘발성유기화합물 (volatile organic compounds, VOCs)의 오존촉매산화 결과에서도 망간산화물 촉매의 오존 분해율과 VOCs 제거율 모두 가장 높게 나타났다 (Huang et al., 2015).
망간산화물은 소성 온도에 따라 환원 정도가 변하면서 3가지 형태 (MnO2, Mn2O3, Mn3O4)로 변화하며, 상온에서 오존산화법으로 VOCs를 산화한 결과 Mn3O4에 비해 MnO2과 Mn2O3의 제거율이 높았다 (Zhang et al., 2021). 이러한 망간산화물 촉매를 제조하는 방법은 망간산화물을 덩어리 형태로 제조하는 방법과 지지체의 표면에 망간산화물을 담지하는 방법이 있다. 지지체의 표면에 망간산화물을 담지하면 촉매의 내구성을 높일 수 있으며, 지지체의 표면 특성을 통해 망간산화물 촉매의 활성점의 수와 크기를 조절할 수 있다. Cho and Song (2021)의 연구에 따르면 내구성과 압력손실에 유리한 허니컴 형태의 세라믹 지지체를 강산 용액으로 전처리하여 비표면적이 낮은 단점을 극복할 수 있었다. 본 실험에서는 강산을 이용하여 표면을 개질한 세라믹을 지지체로 선정하였으며, 습식담지법을 이용하여 망간산화물을 표면에 담지하였다.
촉매 반응은 Langmuir-Hinshelwood (LH)와 Eley-Rideal (ER), Mars-van Krevelen (MvK) 3가지의 메커니즘을 따르는 것으로 알려져 있다. LH 메커니즘은 흡착된 물질 사이의 반응을 나타내고, ER 메커니즘은 흡착된 물질과 공기 중의 물질 사이의 반응을 나타내며, MvK 메커니즘은 전이금속산화물에 존재하는 불안정한 산소가 물질을 산화시키는 반응을 설명할 수 있다 (Yoon et al., 2017). 망간산화물 촉매를 이용한 오존산화는 LH 메커니즘을 따르며 반응물의 농도에 많은 영향을 받을 것으로 예측된다. Ryu et al. (2019)에 따르면 망간산화물 촉매를 이용한 톨루엔 오존산화에서 제거율과 COx (즉, CO2+CO) 전환율은 유입되는 오존의 농도에 큰 영향을 받았다. 상대습도가 높은 경우에는 물 분자 또한 반응물 중 하나이므로 오존과 아세트알데하이드, 물 분자가 경쟁하면서 산화 반응이 이루어진다 (Lee et al., 2020). Fan et al. (2010)에 따르면 벤젠과 톨루엔의 경우 상대습도의 증가에 따라 제거율이 감소하였으며, p-자일렌은 제거율에 변화가 없었다. 하지만 상대습도 55% 조건에서 망간산화물 촉매를 이용한 포름알데하이드 오존산화를 진행한 결과 제거율과 CO2 전환율이 모두 증가하였다 (Zhao et al., 2012). 위와 같이 유입물질의 종류에 따라 상대습도의 영향은 현저한 차이가 존재한다. 그럼에도 불구하고 망간산화물 촉매를 이용한 VOCs와 알데하이드류 제거에서 상대습도의 영향을 평가한 논문은 많지 않다.
본 실험을 통해 망간산화물 촉매 표면에 물 분자가 유입될 때 발생하는 경쟁 반응이 아세트알데하이드와 부산물 산화에 미치는 영향을 분석하였다. 따라서 상대습도가 0%인 완전히 건조한 조건과 상대습도가 높은 두 가지 조건의 공기를 촉매층에 유입시켜 망간산화물 촉매의 오존산화 효율과 산화 부산물 생성을 비교 평가하였다. 또한 아세트알데하이드와 오존의 완전산화 반응식을 기준으로 오존 유입량이 당량비보다 적은 조건과 과량인 조건으로 나눠 비교 실험을 진행하였다. 오존산화 부산물의 정성적 분석을 통해 아세트알데하이드의 오존산화 경로를 파악하였다. 망간산화물 촉매에 의한 아세트알데하이드 오존산화 배출가스에 존재하는 탄소화합물을 분석하여 탄소 수지를 작성하였으며, 탄소 수지의 변화와 수분 흡착량의 관계를 파악하여 물 분자의 경쟁 흡착이 아세트알데하이드 오존산화에 미치는 역할을 파악하였다.
2. 실험재료 및 방법
2. 1 망간산화물 촉매의 제조 및 특성
내구성과 압력손실에서 유리한 허니컴 형태의 세라믹 (Cordierite, Mg2Al4Si5O18) 지지체 (industrial cat-alyst support, Ceracomb Co., Korea)를 선정하였으며, 비표면적과 기공 부피를 높이기 위한 전처리 과정을 진행하였다. 진한 황산 용액에 세라믹 지지체를 넣어 90분 동안 전처리를 진행하였으며, 황산 용액에서 꺼낸 지지체를 증류수로 세척하여 115°C에서 건조 후 망간산화물 담지에 사용하였다. 망간/지지체 (5%wt)의 비율로 망간을 담지하였으며, 망간아세테이트 [Mn(CH3CO2)2·(H2O)n] 수용액을 이용하여 습식담지하였다. 제조한 망간산화물 촉매의 BET 분석 결과 36.264 m2/g이었으며, 기공 부피는 0.037 cm3/g으로 측정되었다. XRD (X-Ray diffractometer) 분석을 통한 표면의 망간산화물 형태를 분석한 결과 지지체인 코디어라이트 피크와 Mn2O3 피크가 주로 분석되었다
2. 2 아세트알데하이드 오존산화 실험
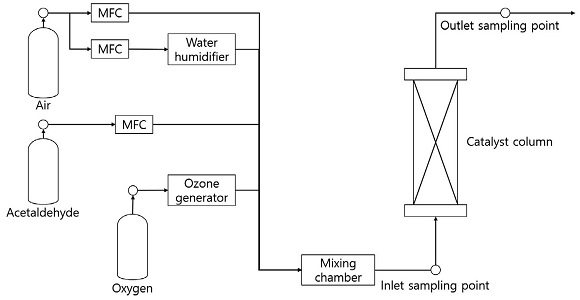
제조한 망간산화물 촉매의 아세트알데하이드 오존산화 효율을 평가하기 위한 실험장치의 구성은 그림 1과 같다. 50 mL 원통형 컬럼에 촉매를 고정하였으며, 아세트알데하이드와 오존, 수증기가 혼합된 공기를 총 유량 3 L/min으로 통과시켰다. 에어코리아에서 제작된 아세트알데하이드 표준가스 (2,000 ppm)와 고순도 공기를 희석하여 컬럼 유입농도를 100 ppm으로 조절하였다. 고농도 오존 발생기 (ozone generator, LAB-1, ozonetech)에서 실시간으로 생성된 오존을 공기와 혼합하였다. 오존 유입농도는 완전산화 반응 (CH3CHO+5O3 → 2CO2+2H2O+5O2)에 필요한 아세트알데하이드와 오존의 몰 비율인 1 : 5를 기준으로 1 : 3, 1 : 15의 비율로 선정하였다. 수증기 발생기에서 생성된 물 분자와 고순도 공기를 혼합하여 상대습도를 조절하였으며, 완전히 건조한 상대습도 0%와 물 분자가 유입되는 50%, 포화상태 수준의 80% 조건으로 실험을 진행하여 상대습도 증가의 영향을 분석하였다. 실험은 총 240분 동안 진행되었으며, 망간 촉매의 아세트알데하이드 오존산화 반응은 90분 이내에 안정화되었다. 오존과 아세트알데하이드 컬럼 배출농도가 안정화된 이후 (90~240분)의 평균값을 그림으로 나타내었다. 모든 실험은 상온 조건이 유지되는 실험실에서 진행되었으며, 컬럼을 지나는 공기의 온도 또한 25±2°C가 유지되었다.
GC/FID (gas chromatography, Agilent Technologies, USA)를 사용하여 아세트알데하이드의 농도 변화를 측정하였으며, GC/MS (gas chromatograph mass spectrometer, Shimadzu, Japan)를 이용하여 오존산화 이후 발생하는 부산물을 분석하였다. CO2 농도는 NDIR 방식의 측정기 (Hymeth, Kinsco Technology, Korea)로 측정하였으며, 분석범위가 CO 0~1,000 ppm CO2 0~5,000 ppm이었다. 오존의 농도 변화는 UV 흡광방식 농도분석기 (OM1500B, Ozonetech, Korea)로 측정하였으며, 분석범위는 0~2,000 ppm이었다. 유입, 유출 라인에 설치된 온습도계 (176 H1, Testo, USA)를 이용하여 상대습도의 변화를 연속 측정하였다.
3. 결과 및 고찰
3. 1 상대습도와 오존 유입농도에 따른 아세트알데하이드 오존산화
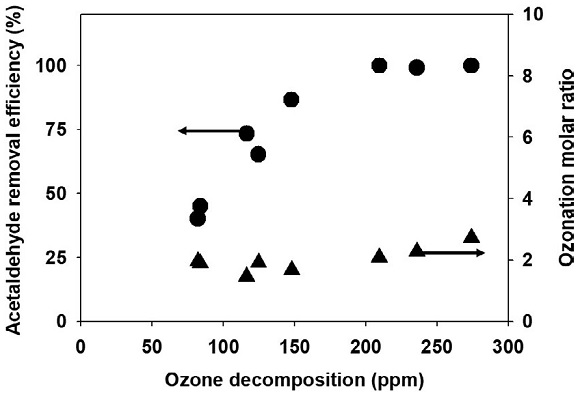
유입 공기의 상대습도가 증가하면 오존과 아세트알데하이드 제거율이 감소하는 경향을 보였으며, 상대습도 전체 구간에서 아세트알데하이드 제거율이 촉매 표면에서 분해되는 오존량에 영향을 받았다. 상대습도 0%에서 오존산화를 진행한 결과 그림 2(a)와 같이 모든 오존 유입 비율에서 아세트알데하이드 제거율이 100%였다. 오존의 경우 유입 비율의 증가와 함께 분해율은 60%, 52%, 55%로 감소하였지만, 실제 분해되는 오존 농도를 보면 209 ppm에서 274 ppm, 839 ppm으로 증가하는 것을 볼 수 있다. 상대습도 50% 조건에서도 오존 유입 비율이 증가하면 아세트알데하이드 제거율은 73%, 87%, 99%로 오존 유입 비율의 증가에 따라 증가하였으며, 오존 분해율은 36%, 28%, 15%로 감소하는 것을 볼 수 있다. 상대습도 80% 조건에서도 아세트알데하이드 제거율은 41%, 44%, 65%로 증가하고 오존 분해율은 25%, 16%, 8%로 감소하였다. 오존 유입 비율이 높아지면서 물 분자와의 경쟁 반응에서 오존의 표면 반응량은 증가하였으며, 결과적으로 아세트알데하이드 제거율이 높아지는 것을 볼 수 있었다. 하지만 그림 3과 같이 오존 2몰과 아세트알데하이드 1몰의 동일한 비율로 아세트알데하이드가 산화되었으며, 유입되는 아세트알데하이드의 2배 농도로 오존을 유입시킬 경우 아세트알데하이드 제거율을 100%로 달성할 수 있을 것이다.
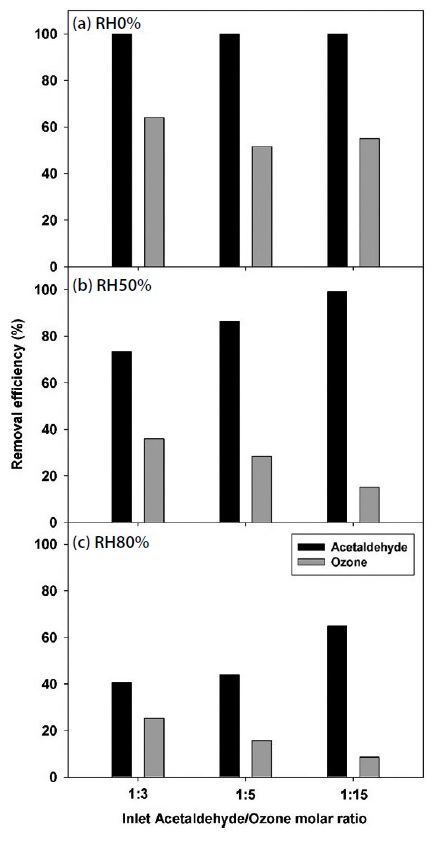
Effects of the ratio of ozone to acetaldehyde in the inlet of the column on ozone and acetaldehyde removal efficiencies at (a) RH0%, (b) RH50%, and (c) RH80%.
3. 2 상대습도와 오존 유입농도에 따른 CO2 전환율
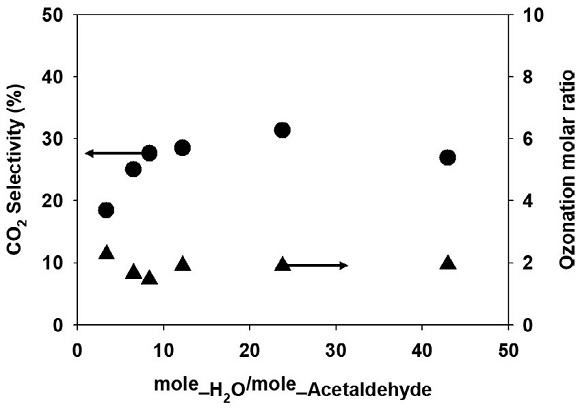
CO2 전환율을 계산한 결과 오존과 아세트알데하이드만 유입되는 조건에서는 오존 분해량에 비례하여 증가하지만, 물 분자가 유입되어 경쟁 반응이 시작되면 흡착된 수분이 오존산화 부산물에 영향을 미쳤다. 그림 4(a)와 같이 오존 유입 비율이 1 : 3으로 유입되는 경우 CO2 전환율이 27%였으며, 오존 유입 비율을 1 : 5와 1 : 15로 증가시키면 CO2 전환율 또한 39%와 64%로 증가하였다. 하지만 그림 4(b), (c)와 같이 상대습도 50%에서 CO2 전환율은 오존 유입 비율 1 : 3에서 28%였으며, 1 : 5일 때 25%, 1 : 15일 때 18%로 계산되었으며, 상대습도 80%에서는 오존 유입 비율의 증가에 따라 27%, 31%, 29%로 계산되었다. 물 분자가 촉매 표면에 흡착되기 시작하면 오존 유입 농도의 증가가 아세트알데하이드 오존산화에 미치는 영향이 감소하였으며, 반응물의 농도와 흡착된 수분량의 변화가 CO2 전환율에 많은 영향을 주었다. 특히 촉매 표면에 흡착된 수분은 부산물의 산화에 영향을 준다고 판단하였으며, 산화된 아세트알데하이드와 흡착된 수분량의 몰 비율을 계산하여 CO2 전환율과 관계를 확인하였다 (그림 5). 오존 2몰과 아세트알데하이드 1몰이 반응하는 경우 유입되는 아세트알데하이드를 아세트산으로 산화시키는 반응이 대부분 발생하였으며, 이때는 부산물의 산화가 일어나지 않았다. 오존산화 비율 조건이 낮아 부산물의 산화가 진행되지 않을 때 상대습도가 증가하면, 물 분자의 흡착과 동시에 CO2 전환율이 증가하기 시작하였다. 특히 흡착된 수분량과 산화된 아세트알데하이드 (오존산화 부산물)의 비율과 함께 증가하였으며, 비율이 23보다 높은 경우 CO2 전환율이 30% 구간에서 일정하게 유지되었다.
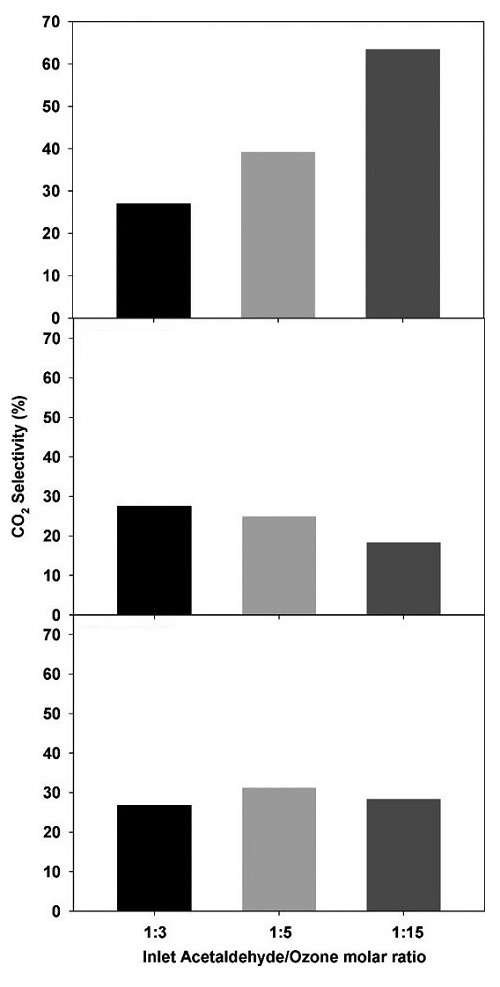
Effects of the ratio of ozone to acetaldehyde in the inlet of the column on the CO2 selectivity at (a) RH0%, (b) RH50%, and (c) RH80%.
3. 3 상대습도에 따른 부산물 분석 결과
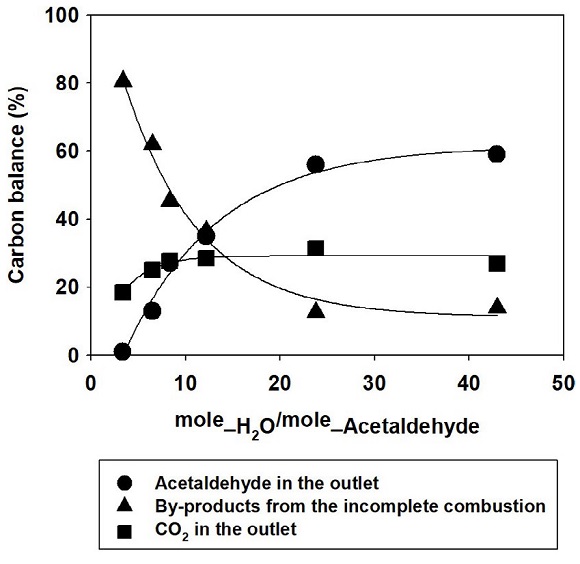
망간산화물 촉매를 이용한 아세트알데하이드 오존산화 과정에서 발생하는 오존산화 부산물을 분석한 결과 아세트알데하이드의 1차 산화물로 알려진 아세트산이 가장 높은 비율로 발생하였다. 상대습도 0%의 경우 오존 유입 비율이 낮은 1 : 3 조건에서는 부산물이 가장 높은 비율로 발생하였으며, 아세트산 이외의 포름알데하이드와 노난알이 분석되었다. 오존과 아세트알데하이드가 2.1의 몰 비율로 산화되면서 부산물의 산화는 미미하였으며, 오히려 부산물끼리 반응하여 탄소수가 높은 노난알이 배출된 것으로 판단된다. 오존 유입농도가 증가하면 그림 6과 같이 부산물의 비율이 지속적으로 감소하였으며, 1 : 3 조건과 같은 탄소수가 높아지는 현상이 발생하지 않았다. 하지만 그림 7과 같이 촉매의 표면에 물 분자가 흡착되는 조건에서는 부산물의 비율이 흡착되는 수분량에 영향을 받았으며, 흡착되는 수분량이 증가할수록 부산물의 비율이 감소하였다. 또한 수분량의 증가와 함께 포름알데하이드와 포름산, 에틸렌의 비율이 증가하였는데, 아세트산과 같은 1차 부산물이 산화된 결과로 판단된다. Zhang et al. (2019)에 따르면 상대습도의 증가와 함께 오존 분해율은 감소하지만, 활성산소와 물 분자가 반응하여 생성되는 OH·가 포름알데하이드와 반응하여 CO2 전환율이 증가하였다고 보고되었다. 망간산화물 촉매를 이용한 아세트알데하이드 오존산화는 물 분자가 표면에 없는 경우 아세트알데하이드의 1차 산화가 완료된 이후 부산물의 산화가 시작되었으며, 물 분자의 경쟁 흡착은 아세트알데하이드의 1차 산화를 저하시킨다. 하지만 물 분자로 생성된 OH·가 오존산화에서 발생하는 부산물의 산화를 가속화시키는 것으로 판단된다.
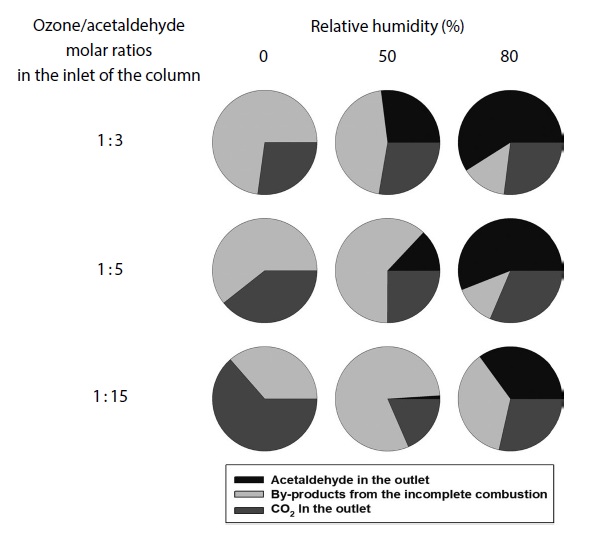
Carbon balances at various humidities and ozone to acetaldehyde molar ratios in the inlet of the column.
4. 결 론
망간산화물 촉매에 의한 아세트알데하이드의 오존산화 반응은 오존 유입농도에 비례하였다. 아세트알데하이드 오존산화 반응은 단계적으로 발생하였으며, 1차 산화가 완료된 후 여분의 오존에 의해 부산물의 산화가 진행되면서 CO2 전환율이 증가하였다. 상대습도가 증가하면 물 분자와 오존, 아세트알데하이드가 촉매의 표면에서 경쟁 흡착 반응을 시작하면서 활성점이 감소하여 아세트알데하이드 산화 효율이 감소하였다. 하지만 오존산화 및 부산물 생성에 촉매 표면에 흡착된 수분이 많은 영향을 미쳤으며, 아세트알데하이드의 1차 산화반응과 부산물의 산화반응이 동시에 발생하였다. 촉매 표면에 흡착되는 수분량이 증가하면 포름알데하이드와 포름산의 비율과 CO2 전환율이 증가하였다. 촉매 표면에 흡착된 물 분자와 활성산소가 반응하여 생성되는 수산화 라디칼 (OH·)은 아세트알데하이드를 직접적으로 산화하지 못하지만, 오존산화 부산물을 선택적으로 산화시키는 것으로 판단된다. 비활성화 촉매의 재생과 같은 부산물의 빠른 산화가 필요한 경우, 재생 공기의 상대습도를 조절하므로 부산물의 선택적 산화를 가속화하여 재생 효율을 높일 수 있을 것으로 예상된다.
Acknowledgments
본 연구는 환경부의 환경정책기반공공기술개발사업 (2017000700002)의 지원에 의해 수행되었습니다.
References
-
Cho, J.-P., Song, J.-H. (2021) Effect of support pretreatment and relative humidity on acetaldehyde ozonation using manganese catalyst, Journal of Odor and Indoor Environment, 20(1), 68-75, (in Korean with English abstract).
[https://doi.org/10.15250/joie.2021.20.1.68]

-
Dhandapani, B., Oyama, S.T. (1997) Gas phase ozone decomposition catalysts, Applied Catalysis B: Environmental, 11(2), 129-166.
[https://doi.org/10.1016/S0926-3373(96)00044-6]

-
Fan, X., Zhu, T., Wan, Y., Yan, X. (2010) Effects of humidity on the plasma-catalytic removal of low-concentration BTX in air, Journal of Hazardous Materials, 180(1-3), 616-621.
[https://doi.org/10.1016/j.jhazmat.2010.04.078]

-
Huang, H., Huang, W., Xu, Y., Ye, X., Wu, M., Shao, Q., Ou, G., Peng, Z., Shi, J., Chen, J., Feng, Q., Zan, Y., Huang, H., Hu, P. (2015) Catalytic oxidation of gaseous benzene with ozone over zeolite-supported metal oxide nanoparticles at room temperature, Catalysis Today, 258, 627-633.
[https://doi.org/10.1016/j.cattod.2015.01.006]

- Hwang, C.-W., Song, I.-S., Kim, S.-K., Oh, C.-H., Kim, T.-H., Jeong, B.-H., Park, E.-H., Kim, J.-S., Choi, K.-C. (2018) A Study on the Emission Characteristics of Aldehydes from Various Industries, Journal of Environmental Health Sciences, 44(2), 169-177, (in Korean with English abstract).
-
Kim, H.-N., Yim, B., Kim, S.-T. (2016) Effect of reducing the odor of food wastes using effective microorganism (EM), Journal of Korean Society of Environmental Engineers, 38(4), 162-168, (in Korean with English abstract).
[https://doi.org/10.4491/KSEE.2016.38.4.162]

- Kim, J.-C. (2006) Trends and Control Technologies of Volatile Organic Compound, Journal of Korean Society for Atmospheric Environment, 22(6), 743-757, (in Korean with English abstract).
-
Lee, H., Song, M.-Y., Ryu, S., Park, Y.-K. (2020) Acetaldehyde oxidation under high humidity using a catalytic non-thermal plasma system over Mn-loaded Y zeolites, Materials Letters, 262, 127051.
[https://doi.org/10.1016/j.matlet.2019.127051]

-
Ryu, H.-W., Song, M.-Y., Park, J.-S., Kim, J.-M., Jung, S.-C., Song, J., Kim, B.-J., Park, Y.-K. (2019) Removal of toluene using ozone at room temperature over mesoporous Mn/Al2O3 catalysts, Environmental Research, 172, 649-657.
[https://doi.org/10.1016/j.envres.2019.03.016]

-
Yoon, Y.-K., Kim, D.-K. (2012) Emission characteristics of odor compounds from pneumatic waste collection plants, Journal of Korean Society of Environmental Engineers, 34(8), 541-548, (in Korean with English abstract).
[https://doi.org/10.4491/KSEE.2012.34.8.541]

- Yoon, C.-H. (2017) The Comparison of Non-Catalytic and Catalytic Oxidation Destruction Technologies for VOCs Abatement, Journal of the Korean Society for Environmental Technology, 18(5), 448-462, (in Korean with English abstract).
-
Zhang, Y., Chen, M., Zhang, Z., Jiang, Z., Shangguan, W., Einaga, H. (2019) Simultaneously catalytic decomposition of formaldehyde and ozone over manganese cerium oxides at room temperature: Promotional effect of relative humidity on the MnCeOx solid solution, Catalysis Today, 327, 323-333.
[https://doi.org/10.1016/j.cattod.2018.04.027]

-
Zhang, L., Wang, S., Lv, L., Ding, Y., Tian, D., Wang, S. (2021) Insights into the Reactive and Deactivation Mechanisms of Manganese Oxides for Ozone Elimination: The Roles of Surface Oxygen Species, Langmuir, 37(4), 1410-1419.
[https://doi.org/10.1021/acs.langmuir.0c02841]

-
Zhao, D.Z., Shi, C., Li, X.S., Zhu, A.M., Jang, B.W.L. (2012) Enhanced effect of water vapor on complete oxidation of formaldehyde in air with ozone over MnOx catalysts at room temperature, Journal of Hazardous Materials, 239, 362-369.
[https://doi.org/10.1016/j.jhazmat.2012.09.009]

조준표 (세종대학교 건설환경공학과 박사과정)
송지현 (세종대학교 건설환경공학과 교수)