Application of Adsorption Sampling and Thermal Desorption with GC/MS Analysis for the Measurement of Low-Molecular Weight PAHs in Ambient Air
Copyright © 2014 Korean Society for Atmospheric Environment
Polycyclic aromatic hydrocarbons (PAHs) have been of particular concern since they are present both in the vapor and particulate phases in ambient air. In this study, a simple method was applied to determine the vapor phase PAHs, and the performance of the new method was evaluated with a conventional method. The simple method was based on adsorption sampling and thermal desorption with GC/MS analysis, which is generally applied to the determination of volatile organic compounds (VOCs) in the air. A combination of Carbotrap (300 mg) and Carbotrap-C (100 mg) sorbents was used as the adsorbent. Target compounds included two rings PAHs such as naphthalene, acenaphthylene, and acenaphthene. Among them, naphthalene was listed as one of the main HAPs together with a number of VOCs in petroleum refining industries in the USA. For comparison purposes, a method based on adsorption sampling and solvent extraction with GC/MS analysis was adopted, which is in principle same as the NIOSH 5515 method. The performance of the adsorption sampling and thermal desorption method was evaluated with respect to repeatabilities, detection limits, linearities, and storage stabilities for target compounds. The analytical repeatabilities of standard samples are all within 20%. Lower detection limits was estimated to be less than 0.1 ppbv. In the results from comparison studies between two methods for real air samples. Although the correlation coefficients were more than 0.9, a systematic difference between the two groups was revealed by the paired t-test (α=0.05). Concentrations of two-rings PAHs determined by adsorption and thermal desorption method consistently higher than those by solvent extraction method. The difference was caused by not only the poor sampling efficiencies of XAD-2 for target PAHs and but also sample losses during the solvent extraction and concentration procedure. This implies that the levels of lower molecular PAHs tend to be underestimated when determined by a conventional PAH method utilizing XAD-2 (and/or PUF) sampling and solvent extraction method. The adsorption sampling and thermal desorption with GC analysis is very simple, rapid, and reliable for lower-molecular weight PAHs. In addition, the method can be used for the measurement of VOCs in the air simultaneously. Therefore, we recommend that the determination of naphthalene, the most volatile PAH, will be better when it is measured by a VOC method instead of a conventional PAH method from a viewpoint of accuracy.
Keywords:
PAHs, Naphthalene, Adsorption sampling, Thermal desorption, GC/MS, Solvent extraction1. 서 론
도시대기 중에 존재하는 다환방향족탄화수소(polycyclic aromatic hydrocarbons, 이하 PAH)는 저농도로 존재하기는 하나 피폭 대상 인구가 많고 자동차 등과 같은 다양한 배출원으로 인해 노출 형태가 연속적이라는 점 때문에 중요하게 인식되고 있다 (Baek, 1999). 분자량과 주변온도에 따라 대기 중에서 기체상과 입자상으로 존재하며, 휘발성이 강한 PAHs는 대부분 증기상으로 존재한다. 상온∙상압의 환경대기에서는 일반적으로 벤젠고리 3개 이하의 PAH는 약 80% 이상이 증기상으로, 벤젠고리 4개의 PAH는 약 50% 전후로 증기상과 입자상으로 존재하며 벤젠고리 5개 이상의 고분자 PAH는 약 80% 이상이 입자상으로 존재한다고 알려져 있다(Baek and Choi, 1998a, b; Baek et al., 1991). 이러한 저분자 PAHs 가운데 가장 대표적인 물질인 naphthalene을 비롯하여 벤젠고리 2개를 함유하고 있는 acenaphthylene 및 acenaphthene 역시 일반 대기환경에서는 거의 대부분이 증기상으로 존재하는 것으로 보고되었다 (Conde et al., 2005; Lu et al., 2005). PAHs 가운데 가장 관심사가 높은 benzo(a)pyrene (이하 BaP)의 경우 발암물질이라는 측면에서 인체 위해도가 높아 이에 대한 많은 연구가 이루어졌으나 총 PAHs 중 미미한 부분을 차지하고 있다 (Menichini et al., 2007; Lobscheid et al., 2007; Eiguren-Fernandez et al., 2004; Baek, 1999). 그러나 naphthalene의 경우에는 BaP에 비해 독성은 낮으나 도시대기 중에 만연해 있으며, 실내∙외 모든 환경에서 검출되고 있다 (Lu et al., 2005; Li and Ro, 2000; Chuang et al., 1999). 이러한 naphthalene은 USEPA에 의해 유해대기오염물질로 정의되고 있으며, 국제암연구센터 (International Agency for Research on Cancer, IARC)에서 인체 발암 가능성이 있는 2B 그룹으로 분류하고 있다. 가스상 naphthalene은 눈과 피부, 호흡기를 자극하며, 장기간 흡입하게 되면 신장, 간, 중앙신경계를 손상하고 백내장을 유발하게 된다. 또한 혈액독성물질로서 고농도에 노출되면 적혈구를 손상하여 용혈성 빈혈을 일으키는 것으로 보고되었다(USEPA, 2003). USEPA의 Integrated Risk Information System에서는 만성호흡노출에 대한 참조농도 (Reference concentration, 이하 RfC)를 3 μg/m3으로 채택하였다(USEPA, 2012). 콜타르와 원유의 천연 조성인 naphthalene은 화석연료나 목재 연소, 정제 공정, 자동차 배기가스 및 naphthalene을 함유한 제품의 증발 등을 통해 대기 중으로 배출된다 (Marr, 1999; Rhead and Pemberton, 1996). 또한 naphthalene이 대기 중에 존재하는 총 PAHs 가운데 상당 부분을 차지하고 있음을 감안하면 기체상 PAHs에 대한 정확한 측정은 매우 중요하다고 할 수 있다.
이러한 기체상 PAHs의 측정방법은 일반적으로 시료채취 및 추출, 농축과정이 복잡하며, 전처리 과정에서 상당한 오차가 유발될 수도 있다. 가장 흔히 사용되고 있는 기체상/입자상 동시 측정방법으로는 highvolume 샘플링을 통한 필터와 back-up 흡착제를 이용하는 방법이다(Baek, 1999; Baek and Choi, 1998a). 기체상 시료 채취를 위한 back-up 흡착제로는 압력손실을 적게 유발하는 polyurethane foam (PUF)이 많이 이용되고 있으나 PUF가 가지는 불순물이나 breakthrough 용량에 대한 정보가 부족하여 신뢰성이 저하되는 단점이 있다(Schauer et al., 1999; Baek and Choi, 1998a). Back-up 흡착제로 XAD-2를 사용하는 방법은 기체상 PAHs에 대해 PUF에 비해서 채취능은 우수하나 시료 채취시의 압력손실이 큰 것으로 알려져 있다(Baek and Choi, 1998b). 환경대기 중 PAH 시료채취와 분석의 국제표준방법인 ISO 12884에 의하면 naphthalene에 대한 PUF의 시료채취효율은 약 35%, XAD-2는 약 60% 수준으로 알려져 있으므로 반드시 실험을 통하여 시료채취효율에 대한 정량적 정보를 제공하도록 요구하고 있다 (ISO, 2000). 이외에도 두 방법 모두 시료탈착 시 용매를 이용하게 되므로 추출∙농축 과정이 번거롭고 시료손실이 야기될 수 있는 단점이 있다.
따라서 본 연구에서는 벤젠고리를 두 개 함유하고 있는 저분자 PAHs는 고분자 PAHs에 비하여 휘발성이 강하다는 점에 착안하여 기존의 용매추출법이 아닌 흡착-열탈착-GC/MS 방법을 이용하여 대기 중에서 대부분 기체상으로 존재하는 naphthalene, acenaphthylene, acenaphthene의 측정가능성을 평가하고자 하였다. 두 방법의 성능을 비교 평가하기 위하여 표준시료를 이용한 실험실 내의 정도관리와 실제 대기시료를 대상으로 하는 현장측정 실험을 병행하였다. 또한 흡착-열탈착-GC/MS 분석방법이 휘발성유기화합물 (volatile organic compounds, 이하 VOCs)의 표준측정 방법임을 감안하여 VOCs와 기체상 PAHs (특히naphthalene)의 동시 측정방법에 대한 가능성 및 가이드라인을 제시하고자 한다.
2. 재료 및 방법
2. 1 대기시료채취 및 분석
실제 대기시료에 적용할 목적의 현장시료 채취는 공장이나 도로 등과 같은 외부의 영향이 비교적 적은 대학교 5층 건물 옥상에서 이루어졌다. 시료채취는 2009년 11월에 10~14시, 14시~18시에 4시간 간격으로 하루에 2회씩 5일간 수행하였다. 시료채취 시 기온은 10~17oC, 풍속은 1~2 m/s, 상대습도는 20~30% 정도로 비교적 맑고 건조한 기상조건을 나타내었다. 본 연구의 주 측정방법은 흡착-열탈착-GC방법으로서 USEPA Method TO-17 (USEPA, 1999)에 준하여 수행하였다. 또한 주 측정방법과 비교하기 위해 비교적 간단한 PAHs 측정방법인 NIOSH Method 5515 (흡착-용매추출-GC방법)를 사용하여 동일지점에서 동일한 시간에 시료를 채취, 분석하여 결과를 비교∙평가하였다.
2. 2 흡착-열탈착-GC 방법
시료채취 매체로는 여러 종류의 VOC에 대해 흡착능과 탈착능이 우수한 Carbotrap (약 400 mg)을 스테인리스 스틸 흡착관(1/4′′×9 cm, Perkin Elmer, UK)에 충진하여 사용하였다. 이때 비교적 휘발성이 낮은 고분자 VOCs가 강한 흡착제에 흡착되어 탈착 회수율이 저하되는 현상을 방지하기 위해 전단에 Carbotrap 보다 약한 흡착제인 Carbotrap-C를 이중 충전하였다. 모든 흡착관은 불순물을 제거하기 위해 흡착관 자동전처리장치인 TC-20 (Markers, UK)으로 conditioning하였다. 이후 Swagelok 타입의 마개와 PTFE 패럴로 막고 50 mL 유리 바이알에 넣어 실온 보관하였다. 시료채취는 FLEC Air pump 1001 (Chematec, Denmark)을 사용하여 50 mL/min의 유량으로 4시간 동안 약 12 L 정도의 시료를 채취하였다. 시료채취가 끝난 흡착관은 다시 Swagelok으로 막고 유리바이알에 넣어 냉장 보관하였으며 3일 이내에 분석을 수행하였다.
시료의 정성∙정량에 사용된 표준물질은 시판되고 있는 EPA VOC MIX-2 (Catalog No. 4-8777, Lot No. LA79001, Supelco)와 acenaphthylene (Catalog No. 21,537-6, Aldrich), acenaphthene (Catalog No. A80-5, Aldrich)을 methanol에 녹여 제조하였다. 제조한 표준물질은 실험용도에 필요한 6단계 (10, 20, 50, 100, 200, 500 ng/μL)의 농도로 희석하였다. 표준용액의 대상물질에 대한 물성치는 표 1에 나타내었다. 표준물질 이외에 기기의 감도변화에 따른 보정에 필요한 내부표준물질 (internal standards, IS)은 d6-benzene, d8-toluene, d10-ethylbenzene, d5-bromobenzene 4종이 포함된 deuterated 물질(Aldrich Chemical, USA)을 사용하였다. 함침에 사용한 내부표준물질의 농도는 100, 500, 200, 100 ng/μL으로 희석하여 사용하였다. 내부표준물질 및 내부표준물질에 의해 보정되는 대상물질의 선택적 특성이온은 표 2에 나타내었다. 주요 측정대상물질인 naphthalene, acenaphthylene, acenaphthene은 d5-bromobenzene을 적용하여 보정하였다.
액상 표준물질을 기화하여 함침하기 위해 GC의 packed column injector를 사용하였다. Injector 온도는 300oC로 설정하고 운반가스 (He)의 유량은 100 mL/min을 유지하였다. 표준물질의 함침은 GC syringe로 일정량(1 μL)을 주입하여 흡착관에 흡착시켰다. 내부표준물질의 함침은 표준물질을 주입한 후 30초 후에 주입하였으며, 다시 30초가 흐른 뒤 흡착관을 분리하였다. 표준물질의 함침시간은 총 1분, 내부표준물질은 30초로 이루어지게 하였다. 시료를 대상으로 주입한 내부표준물질의 경우에는 동일한 온도 조건하에서 위와 같은 방법으로 30초간 함침 받아 사용하였다.
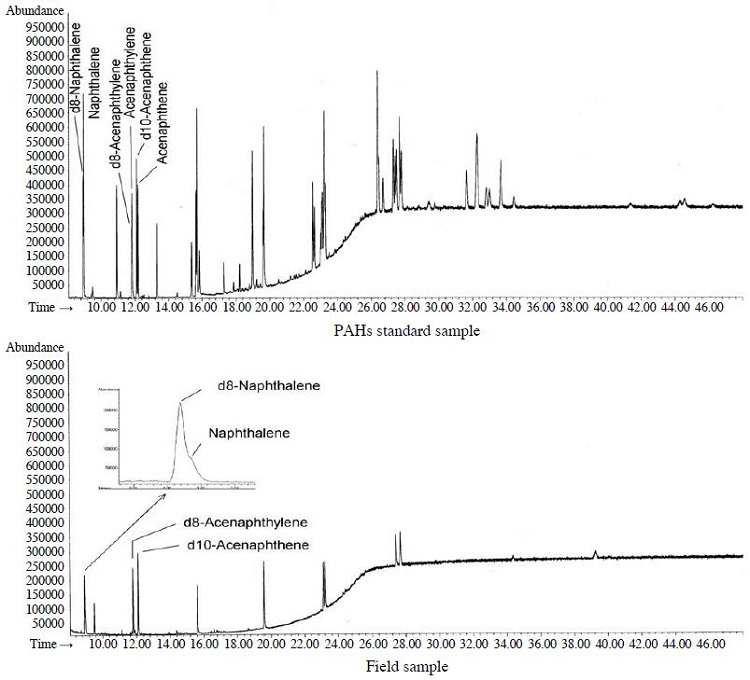
시료의 분석은 자동 열탈착 장치(UNITY/ULTRA, Markes, UK)와 GC/MSD (HP 6890/5973)시스템을 사용하였으며, 자세한 분석조건은 표 3에 나타내었다. 흡착관에 채취된 시료는 자동 열탈착 장치에서 1차적으로 10분간 열탈착하였으며 (300oC, 50 mL/min), 탈착된 시료는 다시 -10oC의 저온응축트랩을 통해 응축된 후 약 6초 이내에 320oC까지 급속 가열되는 2차 열탈착 과정을 통해 GC로 주입하였다. 표준시료와 현장시료에 대한 GC/MSD의 크로마토그램의 일례는 그림 1에 나타내었다.
2. 3 흡착-용매추출-GC 방법
용매추출방법에 적용할 PAH 시료채취용 매체는 XAD-2가 충진된 glass sealed tube (Catalog No. 226-30-06, SKC, 이하 XAD tube)를 사용하였으며, XAD tube의 blank test에서 naphthalene이 상당량 (2 μg 이상) 검출되어 모든 XAD tube는 사용 전에 hexane과 acetone 9 : 1 혼합용매 20mL를 통과시켜 세척하였다. 세척이 끝난 XAD tube는 고순도 헬륨으로 건조하여 사용하였다. 또한 시료채취 시에는 알루미늄 호일을 감아 햇빛의 영향을 최소화하였다. 시료채취는 flow controller (LR37697, Millipore, USA)와 적산유량계를 기본으로 사용하였으며, 저유량의 시료채취를 위해 double take sampler (SKC, USA)를 병행하여 사용하였다. Millipore flow controller를 사용한 경우에는 약 5 L/min의 유량으로 1.2 m3 정도의 시료를 채취하였다. Double take sampler (SKC inc., USA)를 사용한 경우에는 전자식 초미량 유량계 (Ultraflow Electronic Calibrator, SKC Inc., USA)를 사용하여 1~2 L/min의 유량으로 총 240~480 L 정도의 시료를 채취하였다. 시료채취가 끝난 XAD tube는 전용마개로 막은 후 파라필름을 감아 냉장 보관하였으며, 3일 이내에 분석하였다.
정성∙정량을 위해 미국 표준시험연구소(NIST)에서 제공하는 SRM(Standard Reference Material, SRM; SRM 2260a)을 사용하였으며, 개별 PAH powder (Cambridge Isotope Laboratories, Inc.)와 Accustandard USA Z-014J를 내부표준물질(internal standards, IS)과 대리표준물질(surrogate standards, SS)로 각각 사용하였다. 사용된 측정대상물질과 내부표준물질 (internal standards, IS), 대리표준물질(surrogate standars, SS)에 대한 정보는 표 4에 나타내었다.
시료채취가 끝난 XAD tube는 시료의 파과여부를 파악하기 위하여 tube 전단(400 mg)과 후단(200 mg)을 분리하여 추출하였다. 양측을 막고 있는 유리섬유를 포함한 XAD를 30 mL vial에 넣고 Hexane과 acetone 9 : 1 혼합용매 20 mL와 대리표준물질을 100 μL를 주입한 후 마개를 막고 1시간 동안 초음파 추출을 하였다. NIOSH 5515 방법에서는 초음파 추출 시간을 약 15~20 min으로 권장하고 있으나 본 연구에서는 추출효율을 고려하여 추출시간을 1시간으로 연장하였다. 초음파 추출이 끝난 시료는 자동농축장치(Rapid-Vap, Labconco, USA)를 사용하여 농축하였다. XAD가 섞여 들어가지 않도록 추출된 용매를 조심히 따른 후 소량의 추출용매로 2~3회 정도 씻어 vial에 잔류량이 최소화되도록 하였다. 시료가 3~4mL로 농축되면 pasteur pipette을 이용하여 무수황산나트륨 카트리지(Whatman, USA)가 장착된 20 mL 주사기에 옮겨 수분을 제거하였다. 또한 주사기에 용매 2 mL 정도를 넣어 줌으로써 무수황산나트륨 카트리지에 시료가 남는 것을 최소화하였다. 수분이 제거된 시료는 고순도 질소건조장치가 연결되어 있는 농축 vial에서 1mL로 농축하였다. 최종 농축된 시료는 pasteur pipette을 이용하여 바이알에 옮겨 담고 internal standard 100 μL를 주입하였다.
GC/MS (Agilent Technologies 6890N/5973 inert)를 이용하여 분석하였으며, 칼럼은 DB-5MS capillary column (30 m×0.32 mm×1.0 μm, J&W Scientific)을 사용하였다. 환경대기 중에 PAHs는 저농도로 존재하므로 시료주입부는 splitless mode로 설정하여 시료 1 μL를 주입하였다. 시료주입에는 10 μL syringe가 장착되어 있는 auto injector를 사용하였으며, 분석된 표준물질과 현장시료에 대한 크로마토그램 일례는 그림 2에, 그리고 분석조건은 표 5에 각각 나타내었다.
2. 4 자료의 통계처리
본 연구에서는 측정 방법의 성능 평가와 결과 비교를 위하여 몇가지 통계적 기법을 적용하였다. 분석방법의 선형성 평가에는 회귀분석과 상관성분석을 적용하였으며, 재현성 평가는 동일한 시료의 반복분석 결과를 바탕으로 평균치와 표준편차를 각각 계산하고 상대표준편차 (변동계수)로 표현하였다. 검출저한계 평가에는 방법검출한계(method detection limits, 이하 MDL)의 개념을 적용하였다. MDL은 개별대상 물질에 대한 기기검출한계보다 약간 높은 (약 3~5배 정도) 수준의 낮은 농도의 표준시료를 최소한 5개 이상 마련하여 실제시료와 동일한 시료처리과정을 거친 후 분석하여 표준편차를 구한 후 유의수준 1% 및 자유도 n-1 (여기서 n은 시료 수)에서의 student’s t값을 곱하여 구하였다 (USEPA, 1990; Glaser et al., 1981).
이외에도 중복재현성(duplicate precision, 이하 DP)은 동시에 채취한 두 시료의 평균치에 대한 두 시료간의 차이의 절대값을 100분율로 나타내었으며 평균 중복재현성(Mean DP, 이하 MDP)는 여러 쌍의 자료에 대한 중복재현성 값의 평균치를 계산하였다. 한편, 두 측정방법간의 정확성은 어느 한쪽의 값을 참값으로 보고 그에 대한 다른 방법의 상대오차를 계산한 후 여러 쌍의 자료에 대하여 평균값을 계산한 평균상대오차(mean relative error, 이하 MRE)로 표현하였다. 이외에도 두 그룹간의 평균치 비교는 일단 모든 자료가 정규분포를 한다고 가정하고 t-test를 적용하였으며, 동시에 측정된 두 쌍의 자료에 대해서는 대응(paired) t-test를 적용하였다.
3. 결과 및 고찰
3. 1 흡착-열탈착-GC 방법의 성능평가
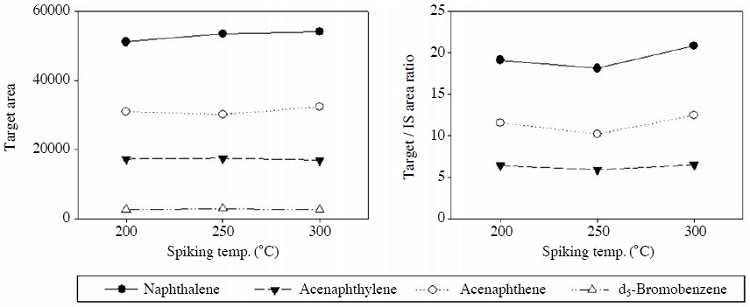
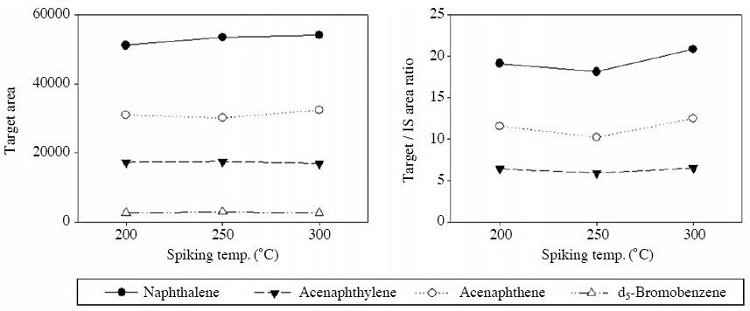
표준물질을 기화시켜 함침하였으므로 함침온도에 따른 영향을 평가하기 위해 500 ng/μL의 표준물질을 사용하여 온도조건을 200, 250, 300oC로 각각 변경하여 분석하였다. 온도조건에 따른 대상물질의 area와 내부표준물질을 보정한 결과는 그림 3에 나타내었다. 그 결과 200oC 이상에서는 온도에 따른 저분자 PAH의 함침량 변화는 크지 않은 것으로 나타나 본 연구에서는 액상 표준물질을 완전히 기화하기 위해 함침온도를 300oC로 결정하였다.
함침온도 평가와 병행하여 고농도의 표준물질(500 ng/μL)에 대한 파과유무 평가도 동시에 수행하였다. 함침하기 전 온도를 높인 injector의 내부오염물질 유무를 파악하기 위해 전처리한 흡착관을 연결하여 운반가스 (He) 흐름 하에 5분 이상 함침하였다. 또한 고농도의 표준시료 (500 ng/μL) 함침시 후단에 직렬로 흡착관을 연결하여 파과유무를 확인하였으며, 함침이 끝남과 동시에 다시 깨끗한 흡착관을 연결하여 injector 내부의 시료잔류 유무에 대한 실험도 수행하였다. 그 결과 고농도의 표준시료를 대상으로 평가하였음에도 불구하고 모든 실험에서 파과현상은 없었으며, injector내의 시료 잔류도 없었음을 확인할 수 있었다.
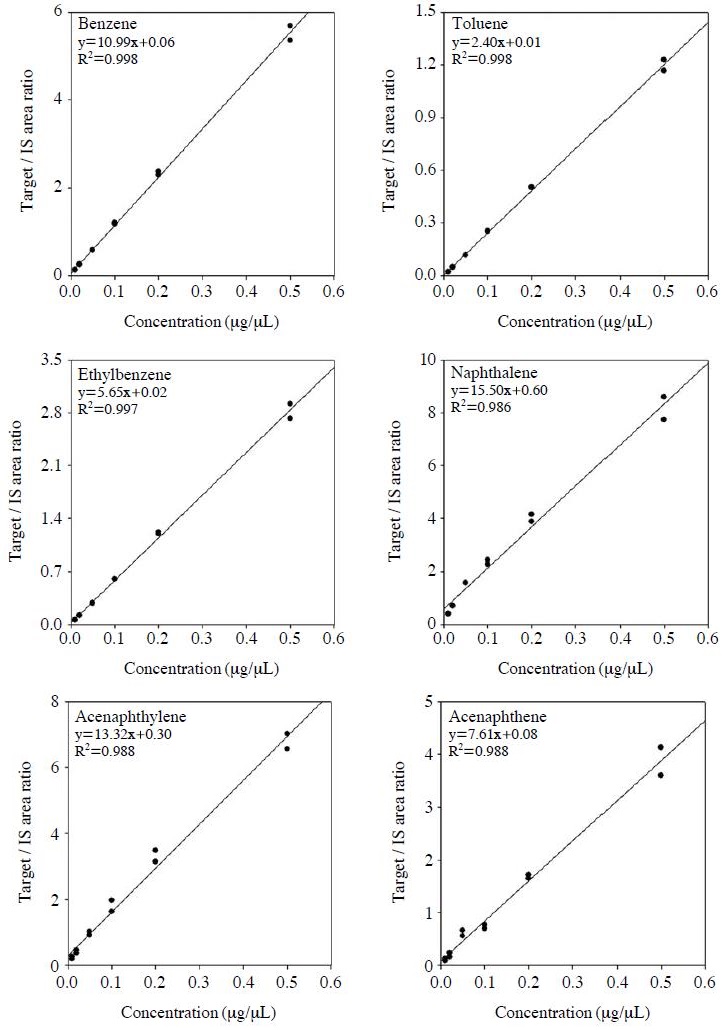
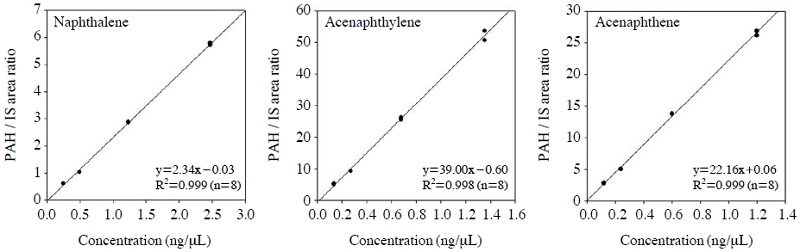
본 연구에서는 실제 시료의 정량에 사용된 6단계의 표준물질(10, 20, 50, 100, 200, 500 ng/μL)을 함침하여 선형성을 평가하였다. 앞서 기술한 실험결과에서 결정한 injector (300oC, 100 mL/min) 조건에서 1분간 표준물질과 내부표준물질을 함침하였으며, 선형성 결과는 그림 4에 나타내었다. 대표적인 VOCs인 benzene, toluene, ethylbenzene 등의 상관계수는 0.99 이상, Naphthalene, acenaphthylene, acenaphthene의 상관계수는 0.98 이상으로 좋은 결과를 나타내었다.
본 연구에서 분석재현성(analytical precision)은 일중재현성 (within-a-day repeatability)과 일간재현성(between days repeatability)의 두 방법으로 평가하였다. 여기서 일중재현성은 같은 동일한 날에 동일한 측정조건에서 같은 시료를 반복하여 분석한 결과들 사이의 일치하는 정도로 정의된다. 전자는 일반적으로 repeatability라 하고 후자를 이와 구분하여 reproducibility로 부르기도 한다 (Miller and Miller, 1987). 본 연구에서는 재현성 평가를 위해 50 ng/μL의 표준시료를 사용하여 총 8개의 동일한 시료를 일중과 일간으로 나누어 각각 분석하였다. 함침조건 등 모든 분석절차는 동일하게 적용하였으며 결과는 상대표준편차 (realative standard deviation, 이하 RSD)로 정량화하였다. 표 6에 나타난 바와 같이 VOCs의 일중재현성은 10% 이내로 우수한 결과를 나타내었으며, PAH 그룹인 naphthalene과 acenaphthylene 및 acenaphthene은 10% 이상으로 나타나 VOCs에 비해 상대적으로 재현성이 떨어지는 것으로 나타났다. 한편, VOC와 PAH 그룹 모두 일간재현성이 일중재현성에 비해 약간 떨어지는 것으로 나타났다. 주요 분석 대상물질인 naphthalene의 경우 전반적인 재현성이 12% 이내 수준으로 나타났으며 이로 미루어볼 때 본 연구에서의 분석 방법의 재현성은 양호한 것으로 판단된다. 미국 EPA TO-17에 의하면 시료채취과정의 불확실성까지 포함한 다중시료의 재현성 (multiplicate precision)은 실제시료를 대상으로 동일한 지점에서 동일한 시료를 서로 다른 유량(약 4배 범위 이내)으로 채취하여 분석했을 때의 상대표준편차로 정량화한다고 언급하고 있다. 따라서 본 연구에서는 실제시료에 대한 중복재현성 평가를 위해 시료채취 유량만 달리하여 평가하였다. 약 12, 24, 36 L의 시료를 각각 채취하여 평가하였으며, 결과는 표 7에 나타내었다. 검출된 물질은 benzene, toluene 등 총 7개 물질이며, VOCs의 RSD는 10% 정도 이내로 나타났다. 또한 매우 저농도로 검출된 naphthalene의 RSD는 21.8%, acenaphthylene 31.6%, acenaphthene 17.2%로 나타났다. 미국 EPA TO-17 시험법에서 중복재현성의 경우 30% 이내를 유지하도록 권고하고 있음을 감안하면 본 연구 결과도 양호한 수준인 것으로 판단된다.
검출저한계 (lower detection limits; LDL)는 방법검출한계 (method detection limits, 이하 MDL)를 추정하여 평가하였다 (USEPA, 1999). 이를 위하여 먼저 GC/MS 크로마토그램상에 S/N 비 2.5를 적용하여 기기검출한계를 추정하고, 이를 바탕으로 기기검출한계의 약 5배 수준의 농도를 갖는 spiking용 표준시료를 제작하였다. 결과적으로 각 물질의 농도가 10 ng/μL의 저농도 표준용액 1 μL를 총 8개의 시료에 함침하여 평가하였다. MDL에 대한 평가 결과는 표 8에 나타내었으며, 분석된 시료의 질량 (ng)과 실제 시료채취량(약 12 L)을 적용하여 계산한 농도값(ppb)을 함께 나타내었다. Naphthalene의 경우 MDL은 질량기준으로 약 1.2 ng, 대기 중 농도로 환산하면 0.02 ppb 정도로 나타났다. 이외의 모든 항목에 대한 MDL은 질량 기준으로 약 5 ng 이하, 대기 중 농도는 대략 0.1 ppb 이하 수준으로 나타났다. 참고로 미국 EPA TO-17의 VOC에 대한 권장 MDL은 대략 0.5 ppb 수준을 요구하고 있다.
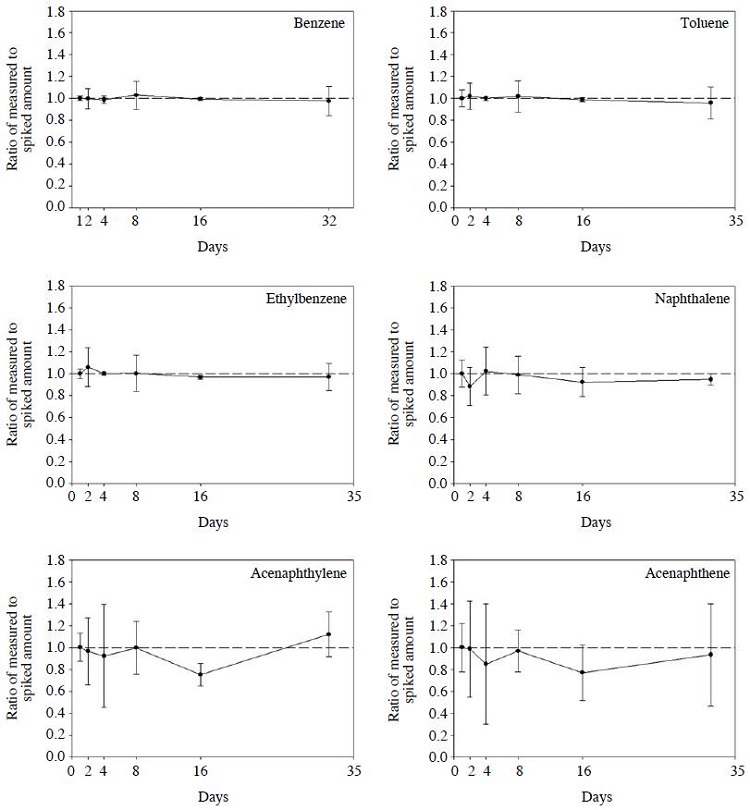
측정대상물질에 대한 분석전의 저장안정성(storage stability) 평가를 위해 전처리 과정을 거친 깨끗한 흡착관에 표준시료를 각각 500 ng씩 함침한 후 일정 간격을 두고 분석을 수행하였다. 분석에 사용된 시료는 총 32개이며, 함침 첫날 4개의 시료를 분석하고 나머지 시료는 4oC 이하의 냉장고에 보관하였다. 보관된 시료는 2, 4, 8, 16, 32일 후에 무작위로 선택하여 실험 당일 내부표준물질을 함침한 후 분석하였다. 첫째 날 분석한 시료를 기준으로 시간경과에 따른 질량변화를 파악하였다(그림 5).
그 결과 VOCs의 경우 저장기간 동안의 평균값 차이는 10% 이내였으며, 편차도 작게 나타나 상당히 안정된 결과를 보였다. 저분자 PAHs의 경우에는 평균값의 차이가 20% 이내였으며, acenaphthylene과 acenaphthene은 편차가 비교적 크게 나타났다. 이들 두 물질의 편차가 크게 나타난 것은 저장안정성 문제보다는 상대적으로 분석 불확도가 크기 때문인 것으로 판단된다.
3. 2 흡착-용매추출-GC 측정방법 정도관리
Naphthalene, acenaphthylene, acenaphthene 3종을 대상으로 실제시료 정량시 사용한 표준용액을 이용하여 선형성을 평가하였다. 그 결과 대상물질 모두 상관계수가 0.99 이상으로 좋은 결과를 나타내었다(그림 6).
재현성은 표준용액과 현장시료를 대상으로 평가하였다. 총 4개의 표준용액(공칭 1 ng/μL)을 분석한 후 감응계수 (response factor)값을 이용하여 상대표준편차로 평가하였다. 그 결과 표 9에 나타낸 바와 같이 일중 재현성은 모두 5% 이내의 양호한 결과를 나타내었으며 일간 재현성은 일중재현성보다는 조금 떨어지고 있으나 전반적으로 10% 이내로 나타났다. 한편, 현장시료에 대한 서로 다른 유량에서의 재현성 평가는 동일한 시간에 동일한 장소에서 시료채취 유량을 달리하여 실험하였다. 시료채취 유량을 각각 1, 2, 5 L/min으로 변경하여 약 0.24, 0.48 및 1.2m3의 시료를 채취하였다. 분석결과 naphthalene만 세 시료 모두에서 검출되었으며, naphthalene의 전반적인 측정재현성은 RSD로 평가할 때 13.3%로 나타났다(표 10).
용매추출법에 의한 저분자 PAH의 방법검출저한계(MDL)은 열탈착 방법과 동일하게 추정하였으며, 이를 다시 실제시료의 분석조건(최종농출량 1 mL, GC 주입량 2 μL, 시료채취량 1.2m3)을 적용하여 대기 중 농도로 환산하여 표 11에 나타내었다. 여기서 ppb 농도 환산은 0oC, 1기압기준으로 하였다. 그 결과 검출저한계는 질량기준으로 0.7~1.7 ng 수준으로 나타났으며, 이를 대기 중 농도로 환산하면 0.58~1.42 ng/m3 정도로 추정된다. 용매추출분석법의 MDL이 표 8에 나타낸 열탈착법에 의한 MDL보다 낮게 나타난 것은 두 가지 이유와 관련지을 수 있다. 첫째는 GC/MS 분석시 열탈착방법은 총이온(total ion) 크로마토그래프로, 용매추출법은 선택적 이온 스캐닝 방법으로 정량하였는데 일반적으로 선택적 이온 방법의 감도가 총 이온 방법보다 우수한 것으로 알려져 있다. 둘째는 시료채취 유량의 차이에서 기인 한 것으로 흡착-열탈착 방법에서는 공기채취량을 약 12L로 설정하였으나 용매추출방법에서는 이보다 약 100배 가량 많은 1.2m3를 기준으로 추정한 것이다. 결과적으로 두 방법의 감도는 적용 조건에 따라 약 200~300배 정도 차이가 남을 알 수 있다.
3. 3 현장시료 측정결과 및 비교 평가
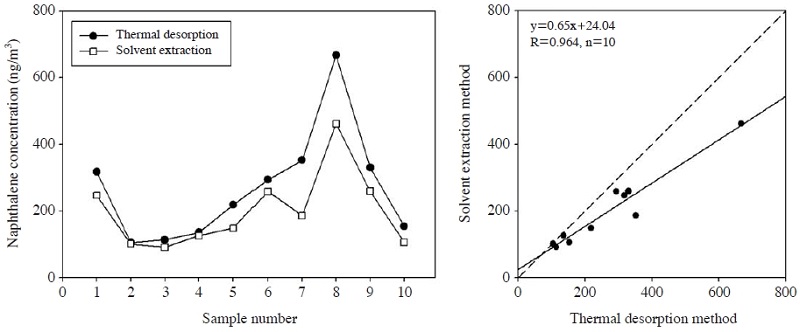
실제대기 중에서의 두 방법에 대한 비교 평가는 대학 캠퍼스내 건물 5층 옥상에서 이루어졌으며, 두 가지 방법으로 동시에 시료를 채취하였다. 채취된 시료는 10쌍으로 총 20개의 시료를 확보하였다. 두 방법에 의한 VOCs와 PAHs 측정결과는 표 12에 나타내었으며 두 그룹간의 자료에 대한 평균상대정확성(mean relative error, 이하 MRE)과 상관계수 및 유의성 검정결과는 표 13에 나타내었다. 저분자 PAHs의 경우 naphthalene은 모든 시료에서 검출되었으며, 전반적으로 열탈착 방법이 용매추출법에 비해 최대 약 50%까지 더 고농도를 나타내는 것으로 조사되었다. Acenaphthylene과 acenaphthene의 경우에는 용매추출법으로 분석한 10개 시료 중 3개 시료에서만 검출되었으며 naphthalene 농도의 약 20% 이하 수준으로 나타났다. 그러나 열탈착방법에서는 이들 두 물질은 검출되지 않았다. 또한 naphthalene에 대해 두 측정방법 간의 상관성 분석을 실시한 결과 상관계수는 0.964로 높게 나타났으며, 시료간 변동양상은 매우 유사함을 알 수 있다(그림 7). 또한 두 방법 간에는 평균치에서는 유의적인 차이가 없었으나 각 시료 쌍에 대한 대응비교(paired t-test) 결과 유의적인 차이가 있는 것으로 나타났다(표 13).
위와 같은 결과로 미루어 볼 때 시료의 채취효율은 흡착-열탈착방법이 우수한 것을 알 수 있으나 검출감도는 용매추출법이 우수한 것으로 볼 수 있다. Naphthalene의 경우 용매추출법에 근거한 PAH 측정방법에 따르면 PUF나 XAD-2를 사용하지 않을 수 없으므로 검출감도는 좋을 수 있으나 시료채취시의 손실과 시료전처리 과정에서의 불가피한 손실 등으로 실제보다 낮은 농도로 정량될 가능성이 매우 높다. 이러한 구조적 문제는 결국 위해성 평가에서 상대적으로 부정확한 정보를 제공할 가능성이 있다. 그러나 일반적으로 VOC에 적용되는 흡착-열탈착방법을 적용할 경우 시료의 손실 없이 보다 정확하게 정량할 수 있다는 장점이 있다. 기존 연구결과에 의하면 환경대기 중 naphthalene은 증기상으로 약 99% 이상 존재하며, 총 농도(증기상+입자상) 역시 수백 ng/m3 수준으로 나타난다고 보고되고 있으므로(Baek and Choi, 1998a) 환경대기 중 naphthalene의 측정은 흡착-열탈착 방법이 더 적절할 수도 있다고 판단된다. 따라서 비록 acenaphthylene이나 acenaphthene 등은 측정이 어려울 수 있으나 매우 중요한 PAH 중 하나인 naphthalene은 흡착-열탈착-GC 방법에 의해 보다 정확한 측정이 가능한 것으로 판단된다.
4. 결 론
본 연구에서는 대기 중 기체상 저분자 PAHs 분석을 위한 흡착-열탈착-GC 방법의 적용 가능성에 대해 조사하였다. 표준물질을 이용한 실험실내 정도관리 측면과 PAH 측정에 상용되는 흡착-용매추출방법과의 비교실험을 현장시료를 이용하여 평가하였다.
그 결과 naphthalene, acenaphthylene, acenaphthene 표준시료에 대한 선형성 평가 결과 R2이 0.98 이상이었으며, 일중 및 일간재현성은 모두 10% (RSD로서) 이하, 서로 다른 유량으로 채취한 실제시료를 대상으로 한 중복재현성은 20% 이하 수준의 양호한 결과를 나타내었다. 방법검출한계(MDL) 평가에서는 MDL이 0.1 ppbv 이하로 추정되었다. 저장안정성 평가에서는 분석시료 사이에 비교적 큰 편차를 보이고 있어 향후 재실험을 통한 검증이 필요한 것으로 판단된다.
실제 환경대기 중에서 흡착-열탈착-GC 방법과 흡착-용매추출-GC 방법을 비교 평가한 결과에서는 naphthalene에 대해 두 방법간의 상관성이 0.96 이상으로 나타났으나, 대응비교를 통한 유의성 검증 결과에서는 유의적인 차이가 있는 것으로 나타났다. Acenaphthylene, acenaphthene의 경우에는 검출빈도가 낮아 정확한 평가가 수행되지 못하였다. Naphthalene의 경우 흡착-열탈착법이 용매추출법보다 일관성 있게 높게 나타났으며 이로 미루어 볼 때 전자가 후자에 비해 시료채취효율이 우수하고 분석과정에서의 시료 손실 가능성이 적은 것으로 판단된다.
따라서 본 연구에서 평가한 흡착-열탈착-GC 방법은 기존의 기체상 PAHs 분석방법이 가지는 용매추출 등의 번거로움을 보완할 수 있으며, 정확한 측정도 가능한 것으로 판단된다. 또한 PAHs로서의 naphthalene은 미국 석유 정제업에서 VOCs와 함께 HAPs로 규정하고 있음을 감안할 때 국내 HAPs 관리를 위해 PAHs로서의 naphthalene과 일반 VOCs를 함께 분석함으로써 그 측정방법을 간단히 할 수 있는 큰 장점을 지니는 것으로 판단된다.
References
- Baek, S.O., Atmospheric Polycyclic Aromatic hydrocarbons - environmental implications, J. Korean Soc. Atmos. Environ, (1999), 15(5), p525-544.
- Baek, S.O., J.S. Choi, Evaluation of sampling methodology for the measurement of polycyclic aromatic hydrocarbons in the atmosphere, J. Korean Air Pollution Res. Assoc, (1998a), 14(1), p43-62.
- Baek, S.O., J.S. Choi, Effect of ambient temperature on the distribution of atmospheric concentrations of polycylic aromatic hydrocarbons in the vapor and particulate phases, J. Korean Air Pollution Res. Assoc, (1998b), 14(2), p117-131.
-
Baek, S.O., R.A. Field, M.E. Goldstone, P.W. Kirk, J.N. Lester, R. Perry, Concentrations particulate and gaseous polycyclic aromatic hydrocarbons in London air following the lead content of petrol in the United Kingdom, Environ. Sci. Tech, (1991), 22, p503-520.
[https://doi.org/10.1016/0048-9697(92)90354-U]

-
Chuang, J.C., P.J. Callahan, C.W. Lyu, N.K. Wilson, Polycyclic aromatic hydrocarbon exposures of children in low-income families, Journal of Exposure Analysis and Environmental Epidemiology, (1999), 9, p85-98.
[https://doi.org/10.1038/sj.jea.7500003]

-
Conde, F.J., J.H. Ayala, A.M. Afonso, V. González, Emission of polycyclic aromatic hydrocarbons from combustion of agricultural and sylvicultural debris, Atmos. Environ, (2005), 39(35), p6654-6663.
[https://doi.org/10.1016/j.atmosenv.2005.07.043]

-
Eiguren-Fernandez, A., A.H. Miguel, J.R. Fronines, S. Thurairatnam, L. Avol, Seasonal and Spatial variation of polycyclic aromatic hydrocarbons in vapor-phase and PM2.5 in Southern California urban and rural communities, Aerosol Sci. Tech, (2004), 38(5), p447-455.
[https://doi.org/10.1080/02786820490449511]

-
Glaser, J.A., D.L. Foerst, G.D. McKee, S.A. Quave, W.L. Budde, Trace analysis for wastewaters, Environ. Sci. Tech, (1981), 15(12), p1426-1435.
[https://doi.org/10.1021/es00094a002]

- International Standard Organization, Ambient air-Determination of total (gas and particle phase) polycyclic aromatic hydrocarbons - Collection on sorbent-backed filters with gas chromatographic/mass spectrometric analyses. Reference Number ISO 12884:2000 (E), (2000).
-
Li, C.S., Y.S. Ro, Indoor characteristics of polycyclic aromatic hydrocarbons in the urban atmosphere of Taipei, Atmos. Environ, (2000), 34(4), p611-620.
[https://doi.org/10.1016/S1352-2310(99)00171-5]

-
Lobscheid, A.B., T.E. Mckone, D.A. Vallero, Exploring relationships between outdoor air particulateassociated polycyclic aromatic hydrocarbon and PM2.5: A case study of benzo(a)pyrene in California metropolitan regions, Atmos. Environ, (2007), 41(27), p5659-5672.
[https://doi.org/10.1016/j.atmosenv.2007.02.042]

-
Lu, R., J. Wu, R.P. Turco, A.M. Winer, R. Atkinson, J. Arey, S.E. Paulson, F.W. Lurmann, A.H. Miguel, A.E. Fernandez, Naphthalene distributions and human exposure in Southern California, Atmos. Environ, (2005), 39(3), p489-507.
[https://doi.org/10.1016/j.atmosenv.2004.09.045]

-
Marr, L.C., T.W. Kirchstetter, R.A. Harley, A.H. Miguel, S.V. Hering, S.K. Hammond, Characterization of polycylic aromatic hydrocarbons in motor vehicle fuel and exhaust emissions, Environ. Sci. Tech, (1999), 33(18), p3091-3099.
[https://doi.org/10.1021/es981227l]

-
Menichini, E., N. Iacovella, F. Monfredini, L. Turrio-Baldassarri, Relationships between indoor and outdoor air pollution by carcinogenic PAHs and PCBs, Atmos. Environ, (2007), 41(40), p9518-9529.
[https://doi.org/10.1016/j.atmosenv.2007.08.041]

- Miller, J.C., J.N. Miller, Statistics for analytical chemistry (2nd ed.), Trans-Atlantic Pub, (1987), p18-19.
-
Rhead, M.M., R.D. Pemberton, Sources of naphthalene in diesel exhaust emissions, Energy & Fuels, (1996), 10, p837-843.
[https://doi.org/10.1021/ef9502261]

-
Schauer, J.J., M.J. Kleeman, G.R. Cass, B.R.T. Simoneit, Simoneit (1999) Measurement of emissions from air pollution sources. 2. C-1 through C-30 organic compounds from medium duty diesel trucks, Environ. Sci. Tech, (1999), 33(10), p1578-1587.
[https://doi.org/10.1021/es980081n]

- USEPA, Definition and procedure for the determination of the method detection limit, 40 CFR Part 136 (analytical procedure), appendix B, 319, (1990).
- USEPA, Compendium of methods for the determination of toxic organic compounds in ambient air, Compendium Method TO-17 (http://www.epa.gov/ttn/amtic/files/ambient/airtox/tocomp99.pdf), (1999).
- USEPA, Health effects support document for naphthalene (http://www.epa.gov/safewater/ccl/pdfs/reg_determine1/support_cc1_naphthalene_healtheffects.pdf), (2003).
- USEPA, Integrated Risk Information System, Naphthalene(>http://www.epa.gov/ncea/iris/subst/0436.htm), (2012).