Emission Characteristics of Odorous Gases with the Decay of Albumin and Yolk of Boiled Egg
Copyright © 2014 Korean Society for Atmospheric Environment
In this study, the concentration of odorants released from albumin (EA) and yolk (EY) portions of boiled egg samples were determined as a function of storage time. The concentrations were measured at storage days of 0, 1, 3, 6, and 9 under room temperature. As such, odorants produced during both fresh and decay conditions were measured through time. A total of 19 compounds were selected as the main target odorants along with 12 reference compounds. GC-MS (for VOC) and GC-PFPD system (for sulfur gases) equipped with thermal desorption (TD) system were employed for odorant analysis in this work. The initial concentrations measured from the chamber system were converted into flux terms (ng∙g-1∙min-1). The EA showed the highest concentration of H2S (234 ng∙g-1∙min-1) at EA-0, and the concentrations of AT (Acetone) was also seen clearly in the range of 11.7 (EA-0) to 58.6 ng∙g-1∙min-1 (EA-9). The EY showed similar patterns. EtAl (Ethyl alcohol) increased 9.47 (EA-1) to 96.7 ng∙g-1∙min-1 (EA-9) in EA samples. Ketone, alcohol, sulfur groups generally exhibited high concentrations compared to other odorants. These data were also compared in relation to olfactometry related dilution-to-threshold (D/T) ratio by air dilution sensory (ADS) test and sum of odor intensity (SOI).
Keywords:
Boiled egg, Odorant, Decay, Gas Chromatography (GC), Thermal Desorption (TD)1. 서 론
생활 수준의 향상에 따라 사람들은 주위 환경에 더욱 많은 관심을 두게 된다. 이들 환경 중에서도 생활과 밀접한 관련이 있는 냄새, 특히 악취에 대한 관리의 중요성이 점차 두드러지는 추세에 있다. 우리나라를 포함하여 선진국에서는 이런 악취문제에 대해 체계적인 관리방안을 도출하기 위해 주요 악취물질들에 대한 측정방법 및 제도적인 관리기준을 체계적으로 구축하기 위한 연구를 다양한 관점에서 추진하고 있다(Yang and Suck, 2000). 우리나라는 22종의 악취 성분을 지정하여, 법적관리 기준으로 활용하고 있다(KMOE, 2008).
공장지역이나 쓰레기 매립지 등을 위시한 다양한 인위적 배출원들은 여러 종류의 악취물질들을 발생한다(Jo, 2011; Schiffmana et al., 2001). 이들 배출원에서는 다양한 유기물질들이 미생물들에 의해 부패하면서 악취의 배출을 수반한다. 부패가 진행하면서 미생물들의 활동은 활발해지고 발생하는 화합물들의 종류나 규모도 다양하게 변화하게 된다. 특히, 우리의 생활환경에서도 음식물의 취급 및 관리과정에서 이런 상황을 쉽게 찾아볼 수 있다.
앞서 음식물의 부패와 악취의 연계성을 조사하기 위하여, 황환원화합물을 중심적으로 분석하는 1차적인 실험을 진행하였다. 이때 사용한 조사대상은 환원황화합물을 많이 방출하는 것으로 알려진 삶은 달걀을 선택하였다. 참고 조사대상으로 비교적 대중적인 가공식품, 고기통조림과 제철 과일인 딸기를 선택하였다(Kim et al., 2013a). 본 연구에서는 2차적으로 삶은 달걀을 심층연구하기 위해, 삶은 달걀을 Albumin of Boiled Egg (EA)와 Yolk of Boiled Egg (EY)로 구분하여 각각의 부위에서 부패를 통해 발생하는 악취물질들의 발생특성을 조사하였다. 이를 위해, 휘발성유기화합물(Volatile organic compounds: VOC), 카보닐화합물(Carbonyl compounds: CC), 유기지방산(Volatile fatty acids: VFA), 환원황화합물(Reduced sulfur compounds: RSC)과 같은 주요 냄새성분 및 기타 고농도로 발생하는 성분들을 중점적으로 정량분석하였다. 또한, 악취공정시험방법(NIER, 2007)에서 제시하는, 공기희석관능법에 따른 희석배수의 실험자료를 바탕으로 측정결과 값들을 산출하였다. 실험을 진행하는 기간 동안 측정한 성분들에 대한 결과값을 비교 검토하여, 조사대상 음식물들의 시간적 변화에 따라 방출하는 악취의 연관성과 경향성을 분석하였다.
2. 연구 방법
2. 1 분석시료 준비
본 연구에서는 삶은 달걀을 EA와 EY로 분리한 후 시간의 경과에 따른 부패를 유도하여, 단계별 발생하는 냄새물질의 발생특성을 알아보고자 하였다. 이를 위해 VOC, CC, VFA, RSC들 중 지정악취성분에 해당하는 19종을 중심으로 측정을 하였다. 이외에도 기타 참고성분 12종을 포함하여, 추가로 정량분석을 시도하였다. VOC, CC, VFA계열의 표준시료를 제조하기 위해, 97.0% 이상 순도의 25종 원표준시료(Sigmaaldrich, USA)를 methanol (99.8%, J.T.Baker, USA)에 희석하여 제조하였다. 최종작업용 표준시료는 Benzene을 기준으로 9.81~196 ng∙μL-1 수준으로 제조하였다. RSC계열의 표준시료는 성분별 농도가 30 ppm인 기체상 원표준시료(Rigas, Korea)를 Polyester aluminum bag (PEA bag; TOP Trading Eng, Korea)에 고순도 질소(N2, 99.999%)로 10 ppb 농도대로 희석하여 조제하였다. 제조한 각각의 작업용 표준시료를 통해 검량선(Response factor: RF) 및 기본적인 정도관리변수(검출한계(Method detection limit: MDL), 재현성(Relative standard error: RSE)) 등의 자료를 도출하여 표 1에 제시하였다. 그리고 발생성분들의 경향성을 체계적으로 평가하기 위하여, Aldehyde, Ketone, Aromatic, Alcohol, Ester, Acid, Hydrocarbon, Sulfur그룹 등으로 세분화하여 비교하였다.
본 연구에서는 주변에서 쉽게 찾아볼 수 있는 신선한 국내산 날달걀을 대형상점에서 구매하여 끓는 물에 약 15분간 삶은 후, 상온에서 식혀주었다. 충분히 삶은 달걀을 EA와 EY로 분리한 후 전자저울로 대략 2 cm 크기로 자른 재료를 각각 50.2 g, 50.1 g으로 확보하였다. 확보한 재료를 약 750 mL 부피의 임핀저에 각각 따로 넣고, 총 5차례(Elapsed Day=D: D-0, D-1, D-3, D-6, D-9)에 걸쳐 신선기와 부패기의 기체상 시료를 채취하였다. VOC, CC, VFA, RSC계열의 성분들을 각각 다음과 같은 채취방식으로 시료를 채취하였다. VOC, CC, VFA계열의 시료는 임핀저 전단에 고순도 질소로 채운 10 L PEA bag를 연결하고, 후단에는 3단 고체흡착관(Sorbent tube: ST, Tenax TA+Carbopack B+Carbopack X (each 100 mg))과 펌프(MP-Σ300, Sibata, JAPAN)를 연결하여 일정한 유속(100 mL∙min-1)의 음압으로 시료를 총 100 또는 250mL로 직접 흡착 채취하였다. RSC계열의 시료는 앞서 언급한 방법과 유사하지만 임핀저 전단에 고순도 공기 실린더(99.999%, 그린가스)를 연결하고 후단에 PEA bag을 이용하여, 100 mL∙min-1의 유속 100분간 총 10 L의 시료를 Bag방식으로 채취하였다(그림 1). 조사기간으로 설정한 9일 기간 중 시료의 채취가 이루어지지 않는 평상시에는 임핀저 전단과 후단을 모두 개방시켜, 자연환경과 근접한 호기성 상태를 유지해 주었다. 각각의 시료에 대한 약칭코드는 표 2에 정리 제시하였다. 신선한 시기부터 부패하는 과정을 담은 사진들도 그림 2에 제시하였다. 육안으로만 재료를 관찰하여도 재료가 부패한다는 것을 확인할 수 있었다. EA는 D-0에 시료 표면이 밝은 흰색을 띠고 있었지만, 시간이 지남에 따라 조금씩 어두운 흰색으로 변화하였다. 그리고 EY는 일반적인 달걀의 노른자 형태를 보이고 있었고, 부패과정과 동시에 미생물들이 번식하는 것을 눈으로 확인할 수 있었다.
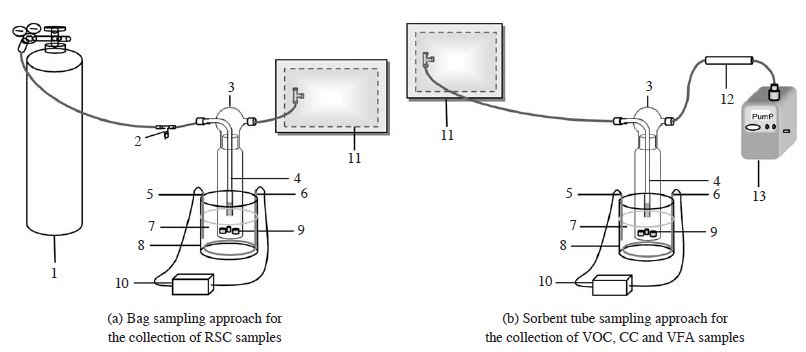
Illustration of sampling device and impinger system. 1. Ultra pure air (99.999%); 2. N2 flow regulator; 3. Impinger bottle; 4. Glass tubing with a bubbler tip to evenly distribute the diluent gas; 5. Sensor; 6. heater; 7. Water heated to 25oC; 8. Aluminum container; 9. Samples: Albumin of Boiled Egg and Yolk of Boiled Egg; 10. Temperature regulator; 11. 10 L polyester aluminum bag (Collect gas samples from samples); 12. Sorbent tube (Tenax TA+Carbopack B+Carbopack X each 100 mg); and 13. SIBATA pump.
2. 2 악취물질들의 기기분석 방법
본 연구에서는 15가지 VOC, CC, VFA 등을 위시한 주요악취성분 외 10가지 기타성분들을 중점으로 분석하였다. 표준시료 또는 실제시료를 흡착시킨 ST를 저온농축열탈착시스템(Thermal desorber (TD), Unity, Markes International, Ltd, UK)를 이용하여 전처리 과정을 진행하였다. 이후 TD와 Gas Chromatography(GC-2010, Shimadzu, Japan) - Mass spectrometer (GC MS-QP2010, Shimadzu, Japan)를 조합하여 활용하였다. TD내부의 저온 농축을 유도하는 Cold trap (CT)의 흡착제는 Carbopack B, Carbopack C을 2단으로 사용하였다. CT의 온도는 -10oC에서 시료를 농축유도한 후, 320oC에서 10분간 열탈착한 시료를 GC column으로 이동시켰다. GC내부에는 CP Wax column(diameter: 0.25 mm, length: 60 m, film thickness: 2.5μm, Agilent, USA)을 사용하여 조사 대상 성분들을 분리 및 분석하였다. 표 3에는 이에 대한 자세한 조건을 제시하였다.
지정악취성분에 속하는 네 가지의 RSC에 추가로 두 가지의 황성분을 추가하여 정량하였다. 표준시료 및 조사 대상 냄새 시료를 포집한 PEA bag을 TD/Airserver(AS)에 연결하여 AS를 통해 시료의 주입량을 5~500mL로 적절히 조절하였다. 이후 TD/AS와 GCPulsed flame photometric detector (PFPD: Varian, USA)를 조합하여 분석을 진행하였다.
TD내부 CT의 흡착제는 Carbopack B, Silica Gel을 2단으로 사용하였다. CT의 온도는 -15oC에서 시료를 농축 유도하였다. RSC의 경우 CT의 온도가 높을 경우, 흡착제에 제대로 흡착이 이루어지지 않으므로, 낮은 온도에서 분석을 진행하였다. 열탈착 시 250oC를 5분간 유지한 상태로 시료를 GC로 이송시켰다. GC 내부에는 BP-1 column (diameter: 0.32 mm, length: 60 m, film thickness: 5 μm)을 장착하여 RSC의 분리를 유도하였다. 표 3에 이에 대한 자세한 분석 조건을 제시하였다.
2. 3 희석배수의 산정방법
악취공정시험방법에서 제시하는, 공기희석관능법(Air dilution sensory (ADS) test)을 통해 희석배수(Dilution threshold ratio; D/T-ratio)를 산정하였다. 이에 대한 자세한 내용은 Jo et al. (2012) 등의 선행 연구에서 상세하게 제시한 바 있다.
3. 결과 및 토의
3. 1 시간의 경과에 따른 냄새의 특성변화
본 연구에서는 삶은 달걀의 EA와 EY를 분리하여, 각각의 부위별로 부패 정도에 따라 발생하는 기체상 성분들을 파악하고자 하였다. 조사 대상시료인 삶은 달걀은 임핀저에 주입 후 sweep gas (N2, 99.999% and Air gas, 99.999%)를 100 mL∙min-1으로 주입하였다. 이를 통해 발생한 기체상 시료를 ST 및 PEA bag으로 채취한 후 GC 시스템으로 분석하였다. 최초 기체상 시료들은 몰분율(ppb) 농도로 산출하였다(표 4). 그리고 시료에 주입한 sweep gas의 유량을 고려하여 단위 유량 당 발생하는 기체상 시료의 질량을 아래와 같이 flux 개념으로 산출하였다(표 4) (Kim et al., 2012).
Flux (F)=C∙(Q /M)
F: 시간당 조사 대상시료 무게에서 방생되는 성분들의 농도(ng∙g-1∙min−1)
C: 임핀저에서 발생되는 시료의 부피에 포함된 성분들의 농도(ng∙m-3)
M: 조사 대상시료의 무게(g)
Q: 임핀저를 통과하는 유속의 속도(m3∙min-1)
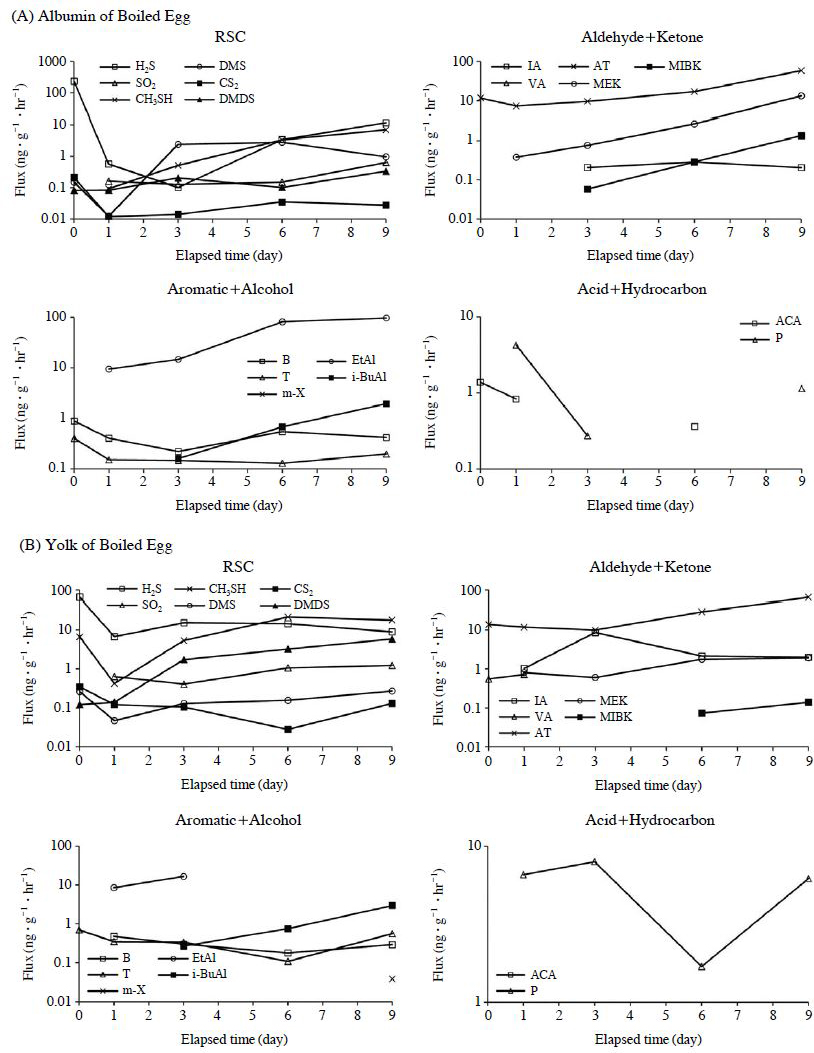
위와 같이 산출한 Target성분들을 비교 분석하였을때, 성분들은 그룹별로 유사한 시간적 발생특성을 확인할 수 있었다. Ketone, Alcohol, Sulfur 그룹에서 다른 성분들에 비해 상대적으로 높은 농도가 발생하였다. Sulfur 그룹에서 H2S가 D-0에서 가장 많이 발생하였다(D-0에서 최고 234 (EA-0) ng∙g-1∙min-1). 시간이 지날수록 배출량이 현저히 떨어지는 것으로 나타났다. Ketone 그룹의 경우 대표적으로 AT의 시간적 배출량(ng∙g-1∙min-1)을 보면, D-0에 11.7 (EA-0) ng∙g-1∙min-1이 시간이 지날수록 7.28 (EA-1)ng∙g-1∙min-1까지 조금 감소하였다가 다시 대폭 증가하는 것으로 나타났다. 그리고 D-9에 58.6 (EA-9)ng∙g-1∙min-1으로 최고치로 나타났다. EY에서도 거의 같은 경향성을 보였다. MEK와 MIBK들도 비슷한 경향성으로 나타났다. Alcohol 그룹에서는 EA에서 시간이 지날수록 배출량이 증가하는 것으로 나타났다. 특히 EtAl은 9.47 (EA-1), 96.7 (EA-9) ng∙g-1∙min-1으로 부패가 진행할수록 증가하는 것으로 나타났다. Aldehyde 그룹의 LA, VA는 대부분 EY에서 0.55~8.57 ng∙g-1∙min-1으로 나타났으며, Acid 그룹의 ACA는 EA에서 0.36~1.38 ng∙g-1∙min-1으로 나타났다. 이들 성분의 시간적 배출 경향성을 그림 3에 제시하였다. 또한, 성분들의 D-0~9까지 전체 기간의 평균값을 그림 4에 참고로 제시하였다. 평균수치에서 AT, EtAl, H2S들이 상대적으로 높은 농도를 기록한 것을 확인할 수 있다.

Concentrations of target compounds measured from two types of boiled egg samples (EA and EY) for the duration of up to 9 days.(A) Concentrations in ppb unit.
조사 대상은 자연환경과 근접한 상태를 유지하여 호기성 상태의 미생물이 번식할 수 있는 적절한 조건을 유지하였다. 이 과정에서 본 연구 결과의 대상으로 선정한 악취성분들의 배출을 유도하였다. EA와 EY에서 발생하는 성분의 차이가 나는 것은 각각 조사 대상이 포함하고 있는 영양소 및 그에 적합한 미생물의 차이에 따른 것으로 판단할 수 있다(표 5).
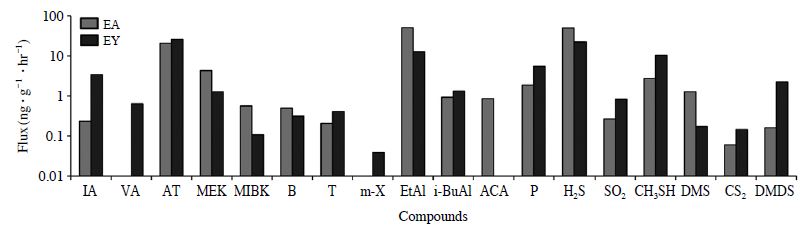
Comparison of average concentration of all target odorants and reference compounds released from EA and EY samples.
선행연구에서 삶은 달걀을 분리하지 않고 위와 같은 방식으로 실험한 결과에서는 H2S가 첫날에 3,655ppb로 가장 높게 나타났다(Kim et al., 2013a). 본 실험의 결과도 농도 기준으로 비교할 경우, 첫째 날에 EA가 2,800 ppb 그리고 EY가 790 ppb로 나타났다. 따라서 달걀을 부위별로 분리하지 않은 선행연구의 결과보다 분리한 본 연구의 결과가 상대적으로 낮게 나타나지만 EA가 보다 더 비슷한 경향성을 보이는 것을 확인할 수 있었다. 또한, SO2를 제외한 다른 다섯 가지 RSC들도 증가 또는 감소하는 경향성이 비슷한 패턴으로 나타나는 것을 확인하였다. 이외 다른 선행연구에서는 우유를 가공하여 만든 치즈를 온도가 37oC인 저장고에 장기간 보관하여 발생하는 물질을 전처리 장치인 SPME를 이용하여 GC-PFPD장치로 분석을 하였다. 이때, H2S, CH3SH, DMS, DMDS가 각각 150, 25, 20, 1 ppb로 발생한 것을 확인하였다(Burbank and Qian, 2008). 위와 같이 선행연구를 참고하였을 때, 유가공식품과 같은 음식물들도 시간의 변화에 따라 Sulfur그룹의 성분들이 배출한다는 것을 알 수 있다.
본 연구에서는 조사 대상시료를 GC/MS시스템을 이용하여 Non-target성분들을 정성분석하였다. 또한, ECN(Effective Carbon Number)방식을 사용하여 이들의 농도를 정량적으로 추정하였다(Kim et al., 2013b). Scanlon and Willis (1985)은 ECN방식을 이용하여 alcohols, polyols, n-acid 그룹에 속하는 미지시료 대한 감응계수를 산출하였고, ECN방식에 대한 변환식을 체계적으로 제시하였다. ECN방식으로 구한 농도는 위와 같은 방식으로 Flux값도 산출하였다(표 4).
Non-target성분들도 Target성분들 처럼 경향성을 파악해 보고자 그룹을 나누어 비교하였다. 대표적으로 몇몇 성분을 살펴보면, Hydrocarbon 그룹에서 두 가지 시료가 다른 경향성을 나타내는 것을 확인하였다. EA에 Butane, Hexane의 경우 D-0에서 9.45와 70.1ng∙g-1∙min-1를 기록하였다. 시간의 경과에 따라 배출량이 서서히 감소하여 Butane은 0.34 (EA-1) ng∙g-1∙min-1, Hexane은 0.54 (EA-9) ng∙g-1∙min-1을 기록하였다. 그리고 EY의 Hexane은 147 (EY-0)~0.69(EY-6) ng∙g-1∙min-1 사이에서 증가, 감소를 반복하였다 Isoprene은 3.13 (EY-3)~10.5 (EY-9) ng∙g-1∙min-1로 증가하였다. Alcohol 그룹의 경우, 증가하는 경향성이 상대적으로 강하게 나타났다. 그리고 Acetaldehyde와 2-Nitro-propane은 EA에서 각각 1.29 (EA-3)~4.16 (EA-0)와 77.1 (EA-6)~222 (EA-9) ng∙g-1∙min-1을 기록하였다. 2-Nitro-propane은 평균치가 161 ng∙g-1∙min-1으로 Non-target성분들 중에서 가장 높은 수치로 나타났다. 또한, Methylene chloride은 두 가지 시료 모두에서 137 (EA-0)~0.38 (EA-6)과 123 (EY-0)~0.60 (EY-9) ng∙g-1∙min-1의 감소추세를 보였다.
3. 2 악취강도 중심의 비교
기체상 시료를 GC시스템으로 분석하여 산출한 몰분율(ppb) 농도자료를 선행 연구에서 주로 활용한 악취도환산식에 대입하여, 개별성분들의 악취강도(odor intensity=OI) 값과 연계하여 비교를 시도하였다(Nagata, 2003). Nagata의 변환식을 이용하여, 24가지 성분에 대한 변환결과들을 표 6에 제시하였다. 검출한계 이하로 검출한 값들은 미산출(Not calculated: NC)로 표기하였다. 변환한 OI수치들을 비교해 보았을 때, 양쪽 시료 모두 Sulfur, Aldehyde, Alcohol 그룹들이 높은 OI를 차지하는 것으로 나타났다. EA에서는 H2S 성분이 4.57 (EA-0), EY에서는 CH3SH성분이 5.06 (EY-6)으로 가장 높은 수치를 기록하였다.

Odor intensity (OI) formula for each odorant and the resulting OI values and the corresponding D/T ratio.
각각 성분으로부터 산출한 OI값들을 이용하여, 이들을 전체적으로 취합할 수 있는 악취강도의 합(Sum of odor intensity; SOI)을 다음 식으로 산출하였다.
SOI=Log{10OI(i)1+10OI(i)2+10OI(i)3+…+10OI(i)n} (1)
(i: 24가지 성분들 중 시료에서 검출한 악취도)
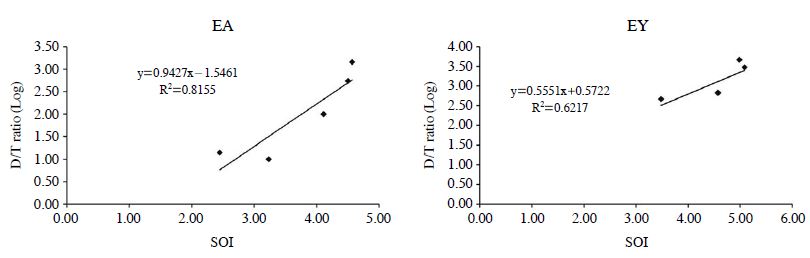
SOI는 개별성분의 기여도를 지수함수적으로 더해주는 개념이므로, 결과적으로 가장 기여도가 큰 성분의 효과를 극대화하는 경향을 보여준다. 즉, 악취도가 높은 성분의 영향을 반영하므로 마스킹 효과의 경향성이 존재한다면 어느 정도 효과적으로 반영할 수 있다. 이러한 제한성을 고려하여, 기기 분석으로 산출한 SOI값과 사람의 오감 중의 하나인 후각을 통해 구해진 D/T-ratio을 연계하여 비교분석해 보았다(Kim and Park, 2008). 각 시료의 SOI값이 높게 나타난 4.57 (EA-0), 5.08 (EY-6) 값들은 D/T-ratio가 각각 1,442과 3,000으로 높은 결과를 기록하였다. 또한 EA-0시료에서 H2S성분과 EY-6시료에서 CH3SH의 OI값도 높게 나타났다. 상대적으로 Sulfur 그룹에서 OI값이 높을 때, 전반적인 D/T-ratio값이 높게 나타났다. 따라서 Sulfur그룹의 성분들이 악취의 원인으로 중요한 역할을 할 수 있다는 것을 추정할 수 있다.
선행연구들(Kim and Park, 2008)의 결과에서 악취강도에 대한 측정값이 감소할 경우, SOI와 D/T-ratio도 함께 감소하는 것으로 나타났다. 이런 관점을 고려할 때, 악취도와 사람의 후각으로 측정한 D/T-ratio이 어느 정도 연관성을 보일 수도 있다는 것을 확인하였다. 그러나 본 실험 결과에서 4.57 (EA-0, EY-3)로 같은 SOI값이 나타났지만, D/T-ratio은 1,442 (EA-0), 669 (EY-3)으로 거의 2배의 차이가 나는 예외의 수치를 볼 수 있다. 그러나 그림 5에 나타난 것처럼 SOI와 D/T-ratio의 관계는 전반적으로 유사한 경향성이 존재하는 것을 확인할 수 있고, 이는 그림 6에서도 유사하게 나타났다.
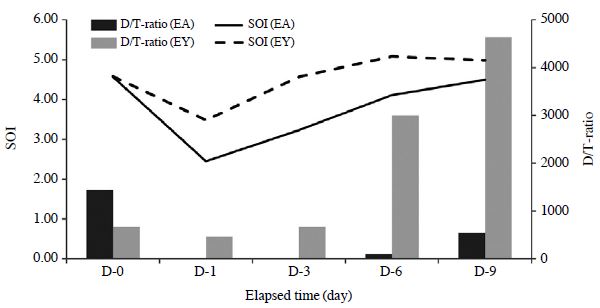
Comparison between D/T ratio and SOI measured during decay experiment for each component of egg samples (EA and EY).
4. 결 론
본 연구에서는 부패한 삶은 달걀에서 발생하는 냄새성분들과 휘발성 물질을 분석해 보았다. 삶은 직후(신선한 상태) EA와 EY로 분리하여, 자연과 비슷한 환경(호기성)에서 시간의 경과에 따라 부패과정이 일어날 때, 발생하는 물질들을 채취하여 분석하였다. 다른 영양성분을 가진 조사대상이 부패에 따라 발생하는 성분의 특성을 31가지의 Target성분으로 집중적으로 연구하였다. 또한, SOI와 D/T-ratio 값을 함께 산출하여 여러 방면에서 결과값을 분석해 보았다. D/T-ratio 값을 통해 사람이 후각으로 직접 느끼는 악취의 영향을 비교하였다. 여러 원인으로 악취를 느낄 수 있지만 본 연구의 결과를 참고로 하였을 때, 부패 시 Aldehyde, Sulfur 그룹들이 악취에 큰 영향을 미치는 것으로 판단하였다. 차후, 추가실험을 통해 조사대상을 보다 다양하게 선정하여 음식물의 부패에 의해 발생하는 성분들의 연관성과 경향성을 보다 더 넓게 파악해 볼 필요가 있다. 또한, 음식물은 사람들의 직접적인 관련이 있는 존재이다. 음식물의 신선여부를 판단하기 위한 과학적인 증거자료로도 충분히 활용할 수 있다.
Acknowledgments
이 논문은 2013년도 정부(교육과학기술부)의 재원으로 한국연구재단의 기초연구사업 지원을 받아 수행된 것임(과제번호 2009-0093848).
References
-
Burbank, H., M.C. Qian, Development of volatile sulfur compounds in heat-shocked and pasteurized milk cheese, Int. Dairy J, (2008), 18, p811-818.
[https://doi.org/10.1016/j.idairyj.2007.12.006]

- Jo, S.H., K.H. Kim, H.J. Jo, M.H. Lee, Y.H. Kim, J.H. Ahn, E.Y. Ryu, Y.W. Kim, Changes in odorant emission patterns of boiled egg samples between fresh and decayed stages, J. Korean Soc. Odor Res. Eng, (2012), 11, p65-79.
- Jo, S.H., K.H. Kim, M.M. Rahman, H.O. Yoon, Emission characteristics of reduced sulfur compounds and gaseous elemental mercury from landfill gas, J. Korean Soc. Odor Res. Eng, (2011), 10, p126-135.
-
Kim, B.W., J.H. Ahn, K.H. Kim, S.H. Jo, Emission characteristics of odorous sulfur gases from food types: a case study on boiled egg, milk, canned meat, and strawberry, J. Korean Soc. Atmos. Environ, (2013a), 29, p615-624.
[https://doi.org/10.5572/KOSAE.2013.29.5.615]

-
Kim, K.H., S.Y. Park, A comparative analysis of malodor samples between direct (olfactometry) and indirect (instrumental) methods, Atmos. Environ, (2008), 42, p5061-5070.
[https://doi.org/10.1016/j.atmosenv.2008.02.017]

-
Kim, K.H., H.O. Yoon, M.C. Jung, J.M. Oh, J.C. Brown, A Simple Approach for Measuring Emission Patterns of Vapor Phase Mercury under Temperature-Controlled Conditions from Soil, The Scientific World Journal, (2012), 940413, p8.
[https://doi.org/10.1100/2012/940413]

-
Kim, Y.H., K.H. Kim, J.E. Szulejko, D. Parker, Quantitative analysis of fragrance and odorants released from fresh and decaying strawberries, Sensors, (2013b), 13, p7939-7978.
[https://doi.org/10.3390/s130607939]

- Korean Ministry of Environment, Malodor Prevention Act, (2008).
- Ministry of Food and Drug Safety, Food and Nutrient data system, (2011).
- Y. Nagata, Measurement of odor threshold by triangle odor bag method, Odor Measurement Review, MOE, Japan, (2003).
- National Institute of Environmental Research, organic functions test, (2007).
-
Scanlon, J.T., D.E. Willis, Calculation of flame lionization detector relative response factors using the effective carbon number concept, J. Chromatogr. Sci, (1985), 23, p333-340.
[https://doi.org/10.1093/chromsci/23.8.333]

-
Schiffmana, S.S., J.L. Bennett, J.H. Raymer, Quantification of odors and odorants from swine operations in North Carolina, Agr. Forest Meteorol, (2001), 108, p213-240.
[https://doi.org/10.1016/S0168-1923(01)00239-8]

- Yang, S.B., S.M. Suck, A Comparative Study for Odor Control Regulations, J. Korean Soc. Atmos. Environ, (2000), 16, p79-87.