전자빔 조사 기술을 이용한 악취물질의 분해 메커니즘 고찰
Copyright © 2020 Korean Society for Atmospheric Environment
Abstract
There have been increased concerns regarding odor compounds due to industrialization and urbanization. These compounds are emitted from various industrial and environmental fundamental facilities. To prevent the spread of odorous substances, various technologies have been developed and applied in actual fields. These technologies have both merits and demerits. Electron beam (EB) is one of the most promising advanced technologies in the field of odorous compound control. In this paper, we explored the EB technology for odorous compound removal. In particular, we focused on the by-products produced decomposed by the electron beam and their decomposition mechanisms. Finally, we also discuss the current status and limitations of EB technology along with its prospects.
Keywords:
Electron beam, Odorous compounds, OH radical, Radiolysis, Decomposition mechanism1. 서 론
산업화로 인하여 과거에는 일부 산업단지 인근지역에서만 문제가 되었던 악취가 최근에는 중요한 사회적 이슈로 대두되고 있다 (Son, 2012; Emerson and Rajagopal, 2004; Davoli et al., 2003). 환경부에서는 2004년 2월 악취방지법을 제정하여 악취물질을 단계별로 확대 시행하였고, 2010년 1월 이후에는 총 22개의 악취물질들을 규제하고 있다 (표 1) (NLIC, 2019). 이에 따라 강화된 악취 규제와 악취문제는 현재 지역현안으로서 부각되고 있는 실정이다. 악취는 인간에게 정신적 또는 생리학적으로 문제를 일으키는 물질로서 일반적으로 여러 화합물들의 혼합물로 구성되어 있다 (Kim et al., 2006; Yang and Kim, 2000). 게다가, 악취물질들은 최소감지농도 값이 낮기 때문에 극히 낮은 농도에서도 심리적인 영향을 미칠 수 있다 (Do and Jung, 2019; Capelli et al., 2011).
이와 같은 특성을 가지고 있는 악취물질은 산업생산 (석유정제, 고무, 플라스틱, 피혁, 인산, 질소비료, 종이 등의 생산), 축산 및 가금류 생산 (닭장, 헛간 등), 식품제조공장 (커피 로스팅 공장, 설탕 정제소, 도축 및 육류 포장 공장 및 렌더링 시설 등) 같은 산업현장뿐만 아니라 하수처리시설 (배수구 및 슬러지 처리실 등), 쓰레기 매립지, 폐기물처리시설 (퇴비화 시설 등)과 같은 다양한 환경기초시설 등에서 발생하며, 배출시설에 따라 배출되는 주요 악취물질 또한 매우 다르다 (표 2와 3) (Wysocka et al., 2019; Boumnijel et al., 2016; Lewkowska et al., 2016; Zhou et al., 2016; Ni et al., 2015; Qamaruz-Zaman et al., 2015; Wang et al., 2015; Lee et al., 2013; Qamaruz-Zaman and Milke 2012; Son et al., 2007; Kim et al., 2006; Fukuyama et al., 2004). 게다가 악취물질들은 극히 낮은 최소감지농도를 갖기 때문에 그 제어에 있어서 많은 어려움이 따르고 있다 (Son et al., 2007a).

Classification of diverse odorous compound emission sources by the scale of odor emission (Fukuyama, 2004).

Classification of various odor emission sources by mainly contained odorous compounds (Fukuyama, 2004).
현재까지 악취물질들을 제어하기 위하여 다양한 기술들이 개발 및 사용되고 있고, 이들 기술은 크게 물리, 화학, 생물학적 방법으로 나뉘어지고 각각의 장점들을 가지고 있다. 이들 방법을 보다 구체적으로 나누어 보면, 물리적 방법은 흡착 및 흡수, 화학적 방법은 약액흡수, 화학흡착, 연소 등이 있고, 생물학적 방법으로는 토양탈취 및 바이오필터 같은 방법들이 있다. 그러나 종래에 사용되는 이러한 기술들은 각각 높은 압력 손실, 짧은 수명, 넓은 면적 소요, 미생물 관리, 이차오염물질의 생성과 같은 단점들을 가지고 있다 (Khan and Ghoshal, 2000; Rafson, 1998). 따라서 이러한 단점을 보완하기 위하여, 보다 최근에는 플라즈마 (plasma), 광촉매 (photocatalyst), 전자빔 (electron beam) 등의 기술들이 활발히 연구되고 있다 (표 4) (Son, 2017, 2012; Son et al., 2015b, 2010a; Kim et al., 2012; Hakoda et al., 2010, 2009; Calinescu et al., 2009; Parmer and Rao, 2009; Khan and Ghoshal, 2000; Rafson, 1998). 이 중에서도 상온에서 대유량의 운전이 가능한 전자빔은 가장 촉망받는 대체 기술 중의 하나로서 지난 30여 년간 활발히 연구되고 있다 (Son, 2017). 그러나 이러한 전자빔 기술도 부산물 생성 등과 같은 단점을 가지고 있고, 보다 성공적인 기술로 발전시키기 위해서는 이와 같은 단점을 해결해야만 한다. 따라서, 본 연구에서는 현재까지 연구된 전자빔을 이용한 악취 제어 기술의 효율성 및 그 분해 반응의 특성에 대한 검토를 진행하고자 한다. 특히, 다양한 악취물질의 전자빔 분해 메커니즘 및 분해 부산물을 전반적으로 조사해 보고, 현장에서 전자빔을 활용하기 앞서서 필요한 사항들을 제언하고자 한다.
2. 악취물질 처리를 위한 전자빔 기술의 역사
전자빔은 1970년대 초 일본에서 SO2를 제거하기 위하여 대기오염분야에서 처음으로 사용되었다 (Park et al., 2019; Machi, 1983). 그 후, 전자빔 기술은 SO2와 NOx을 동시에 제거하기 위하여 현재까지 미국, 불가리아, 일본, 중국, 폴란드, 한국 등에서 연구가 진행되었다 (Son, 2017; Chmielewski, 2007, 1995; Doutzkinov, 2005; IAEA, 2004, 2003, 1992; Yonghua et al., 2002; Frank, 1995; Namba et al., 1995; Wittig et al., 1988). 특히, 폴란드와 중국 등지에서는 100,000 Nm3h-1 이상 규모의 실증 플랜트를 개발하여 SO2와 NOx의 제거 효율에 대한 연구를 진행하였다 (Kim et al., 2018; Chmielewski, 2007; Chmielewski et al., 2004; IAEA, 2004; Doi et al., 2000). 한편, 우리나라의 경우, 2000년도 이후부터 전자빔을 이용한 악취물질의 제거 기술이 방향족 화합물을 중심으로 활발히 연구되기 시작됐다 (Kim et al., 2004; Kim, 2002). 현재까지 우리나라 악취방지법에서 지정악취물질로 지정되어 있는 물질 중 케톤류 (ketone)를 제외한 상당수의 물질에 대한 연구가 진행된 상황이다 (Seo et al., 2019; Son, 2017). 이와 같은 연구결과들을 토대로 할 때, 악취물질을 저감하는 데 있어서 전자빔 기술은 기존의 방지기술을 대처할 수 있는 신기술로 주목받고 있다. 하지만, 현재까지는 부산물 생성 및 전자빔 조사시설의 연속 운전가능성 등과 같은 현실적인 문제로 인하여 현장에 적극적으로 도입되지 못하고 있는 실정이다. 따라서 현재는 이와 같은 문제점들을 해결하기 위하여 다양한 형태의 하이브리드 (hybrid) 기술들 (전자빔/촉매, 전자빔/마이크로웨이브, 전자빔/스크러버)이 지속적으로 연구되고 있다 (Son et al., 2017, 2010a).
3. 전자빔 처리 기술의 원리 및 특성
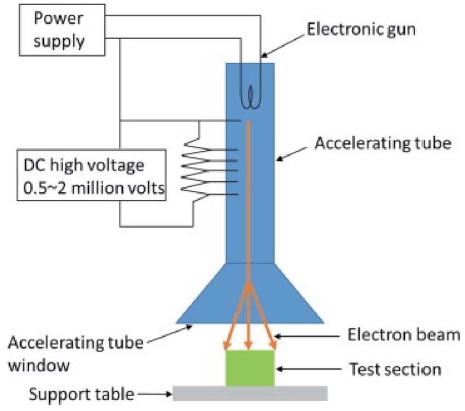
전자빔 (Electron beam)이란 전자 (Electron)와 빔 (Beam)의 합성어로서, 전자빔 가속기 내부 상단의 텅스텐 재질인 음극에서 전자를 방출시켜 진공상태의 가속관을 통해 가속시킨 후 인출창 (Accelerating tube window)을 통하여 공기 중으로 방출되는 전자 띠를 의미한다. 일반적으로 전자빔 가속기는 전자를 발생시키는 전자총 (Electronic gun), 진공상태에서 전자를 가속시키기 위한 가속관 (Accelerating tube), 가속전압을 발생시키는 고전압 발생 장치 (Power supply) 등으로 구성된다 (그림 1) (Wang et al., 2018; Son, 2012). 이러한 전자빔을 이용한 악취물질 제어기술은 상온에서 운전이 가능함으로 에너지 소모 (15 J L-1 이하, 1 kGy≅1 kJ kg-1)가 낮고, 다양한 악취물질이 저농도·고유량으로 배출되는 시설에서 특히 경제적으로 적용될 수 있다 (Son, 2017; Sun and Chmielewski, 2012; Son et al., 2010c; Kim, 2002; IAEA, 1997; Hirota et al., 1995a). 여기서 kGy는 흡수선량을 나타내는 단위로서, 일반적으로 전자빔이 어떠한 매질에 조사되었을 때 실제로 그 매질을 통하여 흡수된 단위 질량당 전리 방사선 에너지량을 의미한다 (Son, 2012; Catherine, 2004). 전자빔 제어기술은 10-18~10-12초 사이에 전자들이 생성된 후 제어 대상물질에 조사가 이루어진다. 그리고, 10-8~10-1초 사이에 수많은 종류의 자유라디칼 및 이온 등이 형성되어 악취물질과 반응이 이루어지므로 매우 빠른 제어 속도를 얻을 수 있다 (Kim et al., 2006, 2005; Park et al., 2005; Kim, 2002). 여기서 자유라디칼이란 화학결합을 형성할 수 있는 하나 또는 그 이상의 비공유 전자를 가지고 있는 원자 또는 분자를 의미한다 (Spinks and Woods, 1990).
전자빔 조사에 의한 악취물질 제거의 초기 반응은 배경가스에 포함된 질소 및 산소 등의 이온화와 여기에 의해서 시작된다. 대상 기체는 이온화 또는 여기되어 이온, 전자, 라디칼을 생성한다. 이렇게 생성된 이온은 배경가스에 포함되어 있는 H2O 등과 반응하여 OH 라디칼과 H3O+ 등을 생성한다. 이때, 전자는 O2와 반응하여 O2- 또는 그 이온집단을 생성한다. 이와 같이 직접적인 그리고 이온적인 분해과정을 통해 최초로 생성된 라디칼은 OH, N, HO2, O, H 등이다 (Son, 2012).
보다 구체적으로 보면, 전자빔 조사에 의해서는 식 (1)~식 (4)와 같은 다양한 활성종들 (N2+, N+, e, N, N(2D), O2+, O+, O, O(2D), H2O+, OH, H, CO2+ 등)이 생성된다 (Son, 2017). 이때, 각각의 활성종 앞에 제시된 수는 G-value를 의미한다. G-value는 100 eV의 에너지를 흡수하였을 때 분해되거나 생성되는 원자나 분자의 수로 정의된다 (Kim, 2002; Nichipor et al., 1995; Mátzing, 1992).
| (1) |
| (2) |
| (3) |
| (4) |
이와 같이 생성된 다양한 활성종들은 전자빔에 의해서 형성된 전자와 함께 악취물질을 제거하는 데 사용된다 (그림 2).
4. 전자빔을 이용한 악취물질 처리 효율 및 부산물
최근까지 전자빔을 이용하여 다양한 악취물질들을 처리하는 연구들이 활발히 진행되고 있다. 그 대상 악취물질로는 아세트알데하이드 (Son et al., 2014), 암모니아 (Son et al., 2013a), 스타이렌 (Son et al., 2012; Ostapczuk et al., 1999), 톨루엔 (Nichipor et al., 2012; Sun et al., 2009a, b; Han et al., 2003; Kim, 2002; Hashimoto et al., 2000; Paur et al., 1990), 트리메틸아민 (Son et al., 2013b), 자일렌 (Sun et al., 2009b; Han et al., 2003; Hirota et al., 2002; Hashimoto et al., 2000), 황화합물 (황화수소, 메틸머르캅탄, 다이메틸설파이드, 다이메틸다이설파이드 Son et al., 2015a, b; Son and Kim, 2015; Hakoda et al., 2009; Auslender et al., 2002), 지방산류 (Seo et al., 2019)가 연구되었다 (Son, 2017). 표 5는 전자빔 조사에 의한 다양한 악취물질의 제어효율에 대해서 나타내고 있다. 그 결과, 제어효율 및 메커니즘은 물질의 종류와 전자빔 조사 조건 등에 따라 확연히 상이하게 나타나는 것을 확인할 수 있었다. 그리고 이에 따라 발생되는 부산물도 차이가 있는 것을 볼 수 있었다. 이러한 선행 연구들의 결과를 종합적으로 보면, 전자빔에 의한 악취물질의 제거효율은 흡수선량이 증가하거나 대상악취물질의 초기농도가 감소할 때, 증가하는 것을 확인할 수 있었다. 대부분의 실험결과를 보면, 전자빔 공정에서 흡수선량과 제거효율의 관계는 양의 상관관계를 가지는 비선형적인 형태로 형성된다 (Son, 2017). 이것은 역반응 또는 OH 라디칼에 대한 낮은 반응성의 존재 가능성 때문에 야기되는 것으로 알려져 있다 (Paur et al., 1991). 그리고 공정 내 오존 및 수분의 첨가는 제거효율의 향상에 큰 도움을 준다. 그러나, 각각의 악취물질마다 분해에 사용되는 최적의 라디칼의 종류는 서로 상이한 것으로 보고된다. 이와 관련된 자세한 내용은 각 물질별로 다음과 같다.
4. 1 암모니아 (NH3)
암모니아는 초기농도가 50과 80 ppm일 때는 10 kGy의 흡수선량에서 95% 이상의 제거효율을 나타내었고, 200 ppm일 때는 15 kGy에서 75%의 제거효율을 나타내는 것을 확인할 수 있었다 (Son et al., 2013a). 그 과정에서 N 계열 라디칼보다는 O 계열 라디칼이 반응에 보다 많은 영향을 주는 것으로 보고했다. 그리고 그 과정에서 오존 (ozone: O3)이 발생된다. 이때, 발생되는 오존의 농도는 최대 45 ppm이다. Son et al. (2013a)의 연구 결과에 따르면 전자빔에 의한 암모니아의 분해 공정은 식 (5), (6)을 통하여 오존에 의해서 제어효율이 크게 증가되는 것으로 알려져 있다 (Xia et al., 2008; Tanthapanichakoon et al., 2004).
| (5) |
| (6) |
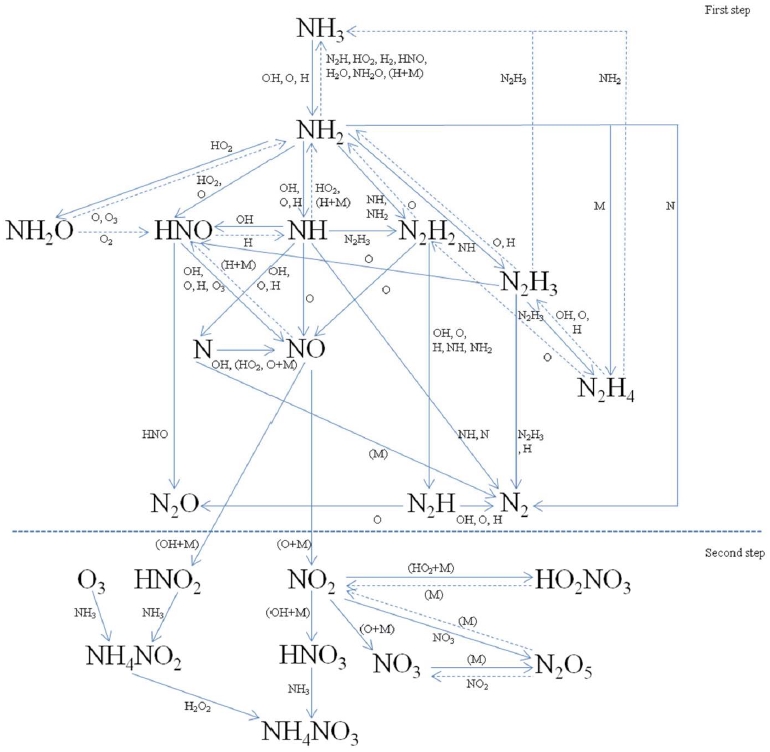
전반적인 암모니아의 분해 공정은 그림 3에서 보는 것처럼, 두 단계에 걸쳐서 이루어진다고 보고된다. 1단계는 전자빔의 조사에 의해서 형성된 라디칼에 의해서 암모니아가 HNO2나 NO2로 전환되는 단계이다. 그리고 2단계는 NO가 잔류 암모니아, OH, O, H2O2, M과 반응하여 NH4NO3와 NH4NO2를 형성하는 것으로 알려져 있다 (Son et al., 2013a).
4. 2 황화합물 (Sulfur compounds)
현재 우리나라 환경부에서 관리하는 지정악취물질에는 4 종류의 황화합물 (황화수소 (Hydrogen sul-fide), 메틸머캅탄 (Methyl mercaptan), 다이메틸설파이드 (Dimethyl sulfide), 다이메틸다이설파이드 (Dimethyl disulfide))이 포함되어 있다. 황화수소 (130 mg m-3)의 경우, IAEA (1992) 및 Paur et al. (1990)는 흡수선량 10 kGy에서 100% 제거되고, 분해된 대부분의 황화수소는 H2SO4와 SO2로 전환된다고 보고하였다. 그리고 최근에 들어서 전자빔 공정을 이용한 황화합물의 주요 분해 메커니즘 및 효율들이 국내 연구진에 의해서 제시되었고, 그들의 결과는 주요 악취배출시설 중의 하나인 염색폐수처리시설에서 파일럿 규모로 적용되었다 (Son and Kim, 2015; Son et al., 2015a, b). 그 결과를 간단히 요약하면, 4 종류의 주요 황계열 악취물질의 제거효율을 비교할 때, 전자빔에서 발생되는 1차 전자에 의한 제거효율은 Hydrogen sulfide가 CH3를 포함하고 있는 다른 황계열 악취물질들 (Methyl mercaptan, Dimethyl sulfide, Dimethyl disulfide)에 비해 떨어지는 것으로 나타났다 (Son and Kim, 2015). 그리고 비슷한 원자로 이루어진 황계열 악취물질들 간에도 라디칼의 종류 (N, O 라디칼)에 따라서 그 제거효율이 상이한 것으로 보고되었다. 예를 들어, Dimethyl sulfide와 Dimethyl disulfide의 경우에는, N 라디칼보다는 O 라디칼에 의한 제거가 보다 효율적이다. 또한, 모든 황계열 악취물질의 경우 추가적으로 수분이 공급될 때 제거효율이 증가되는 것을 확인할 수 있었는데, 이는 수분의 공급으로 인하여 보다 많은 OH 라디칼이 생성되고 이로 인하여, 분해효율이 증가되는 것을 의미한다. 이와 같은 결과는 전자빔을 이용한 다른 악취물질의 분해에 있어서도 동일하게 적용된다. 이와 같은 추가적인 제거효율의 상승은 원자 O와 배가스 내에 존재하는 산소 (O2)의 반응에 의해서 형성된 오존에 의해서도 이루어지는 것을 확인하였다 (Son et al., 2015a; Hakoda et al., 2009). 대표적인 황계열 악취물질들의 분해 메커니즘은 다음과 같다.
다양한 선행연구의 결과를 종합하면, 전자빔에 의한 황화수소는 분해 메커니즘은 크게 3단계로 구분된다. 황화수소는 우선적으로 전자빔에서 발생된 전자와 배경가스가 반응하여 발생된 OH, HO2, O3 등과 반응하여 중간 생성물 (SH, HSO, SO2, and HSO2)을 생성한다 (Son et al., 2015a; Chang and Tseng, 1996; Päur et al., 1990).
| (7) |
이후, 발생된 중간 생성물은 추가적인 반응에 의해서 SO, SO2, and SO2- 등으로 전환된다.
| (8) |
| (9) |
| (10) |
| (11) |
마지막으로 생성된 SO, SO2, SO2- 등은 다음과 같은 추가적인 반응을 통하여 H2SO3와 H2SO4로 전환된다.
| (12) |
| (13) |
| (14) |
| (15) |
메틸머캅탄의 경우에도 황화수소처럼 그 분해 메커니즘을 크게 3가지로 구분할 수 있다 (Yan et al., 2006; Yin et al., 1990; Leod et al., 1984; Glinski et al., 1981; Kerr and Trotman-Dickenson, 1957).
먼저 메틸머캅탄은 다음과 같이 OH와 O3와 반응하여 CH3S, CH3OH, and SO2를 생성한다.
| (16) |
이와 같이 생성된 중간물질들은 또다시 서로 반응하여 다양한 다음과 같이 다양한 물질들을 형성한다.
| (17) |
그리고 다음의 반응을 통하여 중간 생성물들은 최종적으로 CH3SO2CH3 등으로 산화된다.
| (18) |
| (19) |
선행 연구들의 결과에 따르면 전자빔을 이용한 다이메틸설파이드 제어 공정의 최종 부산물은 SO2 또는 (CH3)2S2와 같은 형태로 생성된다. 보다 자세한 분해 메커니즘은 다음과 같다 (Yang et al., 2009; Yan et al., 2006; Frank and Tureček, 1999; Yin et al., 1990).
| (20) |
| (21) |
| (22) |
| (23) |
이 분해 과정에서 생성된 SO2의 농도는 배경가스 내의 산소의 함량에 따라 크게 좌우되고 이는 물질을 구성하는 원자들 간의 결합에너지 (OS=O (551.8 kJ mol-1), SC=S (430.0 kJ mol-1), OC=S (306.9 kJ mol-1))에 의한 것이다 (Son et al., 2015a).
다이메틸다이설파이드의 경우에는 다음과 같은 분해 메커니즘을 따르는 것으로 일반적으로 알려져 있다 (Auslender et al., 2002; Butkovskaya and Setser, 1999; Leod et al., 1984).
| (24) |
| (25) |
| (26) |
| (27) |
플라즈마를 이용한 일부 문헌에서는 황계열 악취물질이 분해될 때, CS2도 부산물로서 생성되는 것으로 알려져 있다. 하지만 CS2의 생성량은 NO 농도와 반응기 내의 온도에 민감하다 (Tsai et al., 2001). 고온 산화의 경우에는 온도가 500℃ 이상이면 CS2의 생성량은 급격히 증가하는 것으로 보고되고 있다 (Frank and Tureček, 1999). 그러나 전자빔 반응에서는 반응기의 온도가 상온이므로 CS2의 생성량은 극히 미량일 것으로 보고된다 (Son et al., 2015a).
황계열 악취물질과 관련하여 위에서 언급한 모든 분해 메커니즘에서는 N 라디칼에 의한 반응들은 제외되어 있다. 따라서, 전자빔에 의한 황계열 악취물질에 대한 분해 메커니즘을 보다 명확히 이해하기 위해서는 N 라디칼종에 의한 분해 메커니즘에 대한 연구도 향후에 추가적으로 수행되어야 할 것이다.
4. 3 트리메틸아민 ((CH3)3N)
다양한 초기농도 (50, 100, 200 ppm)에서 첨가되는 수분의 양이 증가될수록 제거효율은 5~30%까지 증가되고, 10 kGy에서 제거효율이 90% 이상으로 보고된다 (Son et al., 2013b). GC/MSD를 사용하여 전자빔에 의한 트리메틸아민의 부산물을 분석한 결과, CH4가 발생하였고 그 생성량은 분해되는 트리메틸아민의 양이 증가할수록 증가되는 것으로 알려졌다.
다양한 연구들을 조합해 볼 때, 트리메틸아민의 분해 메커니즘은 크게 다음과 같은 두 단계로 구분할 수 있다 (Deac et al., 1996; Seetula et al., 1985; Kozok and Gesser, 1960; Gesser et al., 1957; Bamford, 1939a, b). 1단계는 전자빔에 의해서 발생된 전자에 의해서 CH3 라디칼이 발생되는 단계로서 다음과 같다.
| (28) |
| (29) |
| (30) |
이후 (CH3)2N는 (31)에 의해서 (CH3)2NH와 CH3NCH2로 전환되고 이때, 일부 (CH3)2NH는 (CH3)2N로 되돌아간다 (Seetula et al., 1986; Bamford, 1939a) 또한, 잔류 산소와 (CH3)2N의 반응에 의해서 (CH3)2NH가 추가적으로 생성된다 (Lindley, 1979).
| (31) |
| (32) |
2단계는 CH3가 H, (CH3)2NH, (CH3)2N, (CH3)3N 등과 반응하여 CH4를 생성하는 반응으로 식 (33)~(36)과 같다 (Son et al., 2013b; Tsang, 1989; Seetula et al., 1986; Edward et al., 1966; Gray et al., 1965). 그리고 추가적으로 C2H2, C2H4, C2H6, (CH3)2NH, CH2(OH)2, (CH3)2N-CH2-N(CH3)2, (CH3)2NCH2-C≡N 등이 발생될 것으로 예상된다 (Gesser et al., 1957; Bamford, 1939a).
| (33) |
| (34) |
| (35) |
| (36) |
4. 4 아세트알데하이드 (CH3CHO)
Son et al. (2014)의 연구 결과에 따르면 초기 아세트알데하이드 농도가 240 ppm일 때, 전자빔 (10 kGy, 배경가스 Air)에 의한 제거효율은 88%였다. 또한, 그들은 수분이 함유되면 아세트알데하이드의 제거효율이 10~15% 정도 향상된다고 보고하였고, 34 ppm의 경우에는 2.5 kGy에서 99.9% 제거되는 것으로 보고하였다. 그러나 이와 같이 낮은 흡수선량에서는 수분의 투입으로 인한 추가적인 제거효율은 확인할 수 없었다.
알데하이드를 전자빔으로 분해하면 다양한 분해 메커니즘을 통하여 C2H4O2, C7H6O, C6H6, C7H8 and C8H10와 같이 다양한 부산물들이 발생하는 것으로 보고된다 (Son et al., 2014; Laufer and Fahr, 2004; Tokmakov et al., 1999; Tsang, 1991; Westmoreland et al., 1989; Callear and Smith, 1986, 1984; Tsang and Hampson, 1986; Dean, 1985; Woolley and Cvetanovic, 1969; Tarr et al., 1966). 위와 같은 다양한 부산물 중에서 C2H4O2의 경우 Cameron et al. (2002)이 보고한 것처럼 식 (37)과 같이 OH 라디칼에 의한 반응에 의해서 직접적으로 생성될 수 있다.
| (37) |
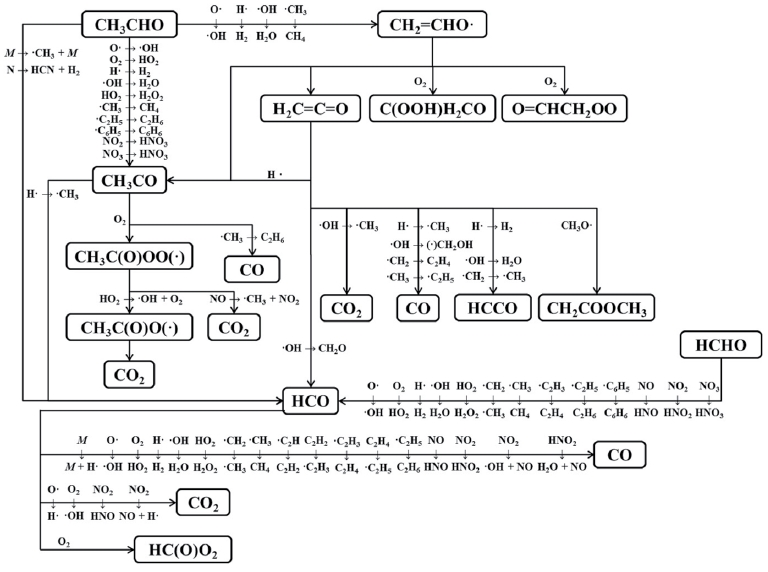
그러나 C7H6O, C6H6, C7H8 and C8H10과 같은 물질들은 보다 복잡한 반응메커니즘에 의해서 형성되는데, 이와 관련된 자세한 내용은 Son et al. (2014)의 논문에서 확인할 수 있고, 그 과정은 그림 4와 같다.
4. 5 스타이렌 (Styrene)
10 kGy의 흡수선량에서 스타이렌은 초기농도가 394 ppm에서 912 ppm으로 증가할 때, 제어효율은 92%에서 83%로 감소한다 (Ostapczuk et al., 1999). 또한, Son et al. (2012)에 따르면 스타이렌의 제어효율은 흡수선량이 증가할수록 초기농도가 낮아질수록 높아진다. 특히, 스타이렌의 초기농도가 50 ppm인 경우에는 2.5 kGy 흡수선량만으로도 98% 이상의 제거효율을 얻을 수 있다. 이와 같이 스타이렌이 전자빔 조사에 의해서 잘 분해되는 이유는 스타이렌이 double bond로 구성된 vinyl기를 가지고 있기 때문이다. 그리고 스타이렌의 경우에는 N 라디칼보다는 O 라디칼에 의해서 보다 잘 분해되는 것으로 보고된다. 게다가 Tanthapanichakoon et al. (2004)의 연구 결과에 따르면, O 라디칼 및 오존의 경우에는 상대적으로 낮은 온도 조건에서도 스타이렌의 제어효율에 영향을 미치지만, N 또는 다른 종류의 라디칼의 경우에는 스타이렌의 분해에 있어서 상대적으로 높은 온도 조건에서만 영향을 발휘하는 것으로 보고된다. 그리고 전자빔에 의한 스타이렌의 분해 과정에서는 산화스타이렌 (styrene oxide)과 벤즈알데하이드 (benzaldehyde) 등이 생성되는 것으로 알려졌다 (Novoselov and Filatov, 2003; Ostapczuk et al., 1999). 이와 유사한 결과는 플라즈마에 의한 스타이렌 제어 연구 결과에서도 볼 수 있다. 플라즈마에 의해서 형성된 원자 산소, 이온화된 원자산소, 라디칼 등에 의해서 형성된 다양한 활성종들이 스타이렌의 vinyl 그룹과 반응하여 부산물로 알데하이드류뿐만 아니라 산화스타이렌 등을 발생시킨다는 것이다 (Na et al., 2006; Buchta et al., 1993; Tuazon et al., 1993).
4. 6 톨루엔 (Toluene)
톨루엔은 다양한 악취물질 중 현재까지 가장 많은 연구가 진행된 물질이다 (Sun et al., 2013, 2009a; Kim et al., 2010, 2005; Son et al., 2010b; Hirota et al., 2004; Kim, 2004, 2002; Han et al., 2003; Päur et al., 1990). Päur et al. (1990)의 결과에 따르면, 흡수선량 10 kGy에서 톨루엔 30 ppm의 제거효율은 60%로서 동일한 벤젠고리를 가지고 있는 벤젠 (40%)보다 더 높다. 우리는 이와 유사한 결과를 Kim (2002)의 논문에서 찾을 수 있었다. Kim (2002)은 CH3 기능기를 가지고 있는 톨루엔이 CH3 기능기가 없는 벤젠보다 더 쉽게 제거된다고 발표했다. 또한, Son et al. (2010b)의 연구결과에 따르면 톨루엔은 에틸벤젠보다 동일한 흡수선량에서 보다 잘 제거되는 것으로 보고되고 있다. Hirota et al. (2004)는 다양한 VOCs가 전자빔에 의해서 90% 제거되기 위하여 필요한 흡수 선량을 측정하였는데, 그 결과 벤젠을 분해하기 위해서는 다른 VOCs (톨루엔, 에틸벤젠, 자일렌)에 비해 2.8~4.4배의 에너지가 더 요구된다고 보고하였다. 이는 벤젠고리에 붙어있는 기능기의 종류가 전자빔 조사를 통한 악취물질의 분해에 있어서 상당한 영향을 미친다는 것을 의미한다. 이는 CH3 기능기 대신에 Cl 기능기를 가지고 있는 4-chlorotoluene과 toluene을 비교한 실험의 결과에서도 확인할 수 있었다 (Sun et al., 2009a). Kim (2002)의 연구에 의하면 톨루엔의 제거에 있어서는 N 라디칼이 O 라디칼보다 톨루엔의 분해에 보다 효율적이다. 게다가, 그 연구에서는 OH 라디칼이 톨루엔에 미치는 영향을 파악하였다. 그 결과, 연속식 실험에 수분을 주입하면 톨루엔의 제거효율이 15~20%까지 향상되는 것을 확인할 수 있었다. 또한, 이러한 결과는 컴퓨터 모델링에 의한 결과에서도 유사하게 나오는 것을 확인할 수 있었고, OH 라디칼이 공기 및 배가스 내의 톨루엔의 제거에 있어서 주요한 영향을 미치는 것으로 보고했다.
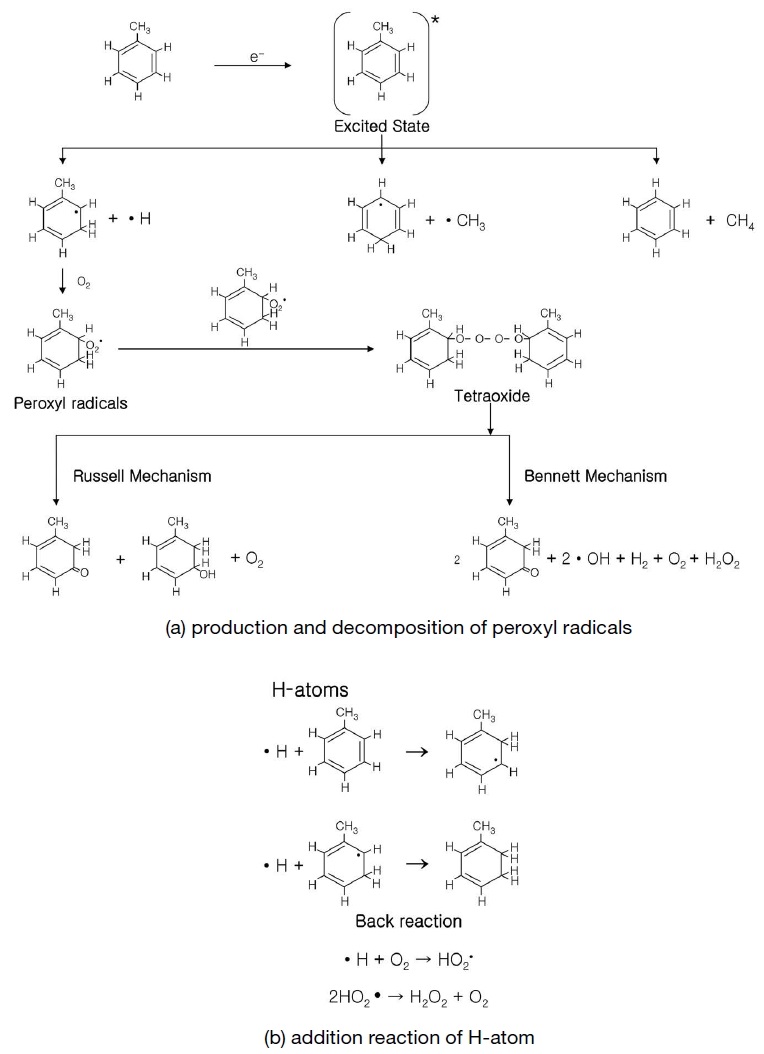
Kim et al. (2005)의 연구에 의하면, 전자빔을 이용한 톨루엔의 분해공정에서 전환되는 CO2와 에어로졸의 양은 분해된 톨루엔의 약 17%와 47%이다. 즉 분해된 톨루엔의 65% 이상이 CO2와 에어로졸로 전환되는 것을 의미한다. 표 5에서 보는 것처럼 전자빔에 의해서 톨루엔이 분해되면 다양한 미량의 부산물들이 발생되는데, 그중에서 가장 대표적으로 발생되는 부산물은 benzaldehyde이다 (Sun et al., 2013, 2009b; Kim et al., 2010, 2005; Son et al., 2010b; Han et al., 2003). 이와 같이 톨루엔의 전자빔 분해공정에서 benzaldehyde가 형성되는 것은 그림 5와 같이 peroxy 라디칼과 관련된 Russell’s and Bennett’s 메커니즘과 관련이 있다 (Kim et al., 2010). 그리고 이와 같은 부산물들은 일반적으로 흡수선량이 증가할수록 증가한다.
4. 7 자일렌 (Xylene)
Hirota et al. (1995b)가 연구한 xylene (22.5±0.5 ppm)의 연구결과에 따르면, xylene은 10 kGy의 전자빔 흡수선량에서 90% 가깝게 제거되는 것을 확인할 수 있다. Xylene의 경우에는 세가지 (o-, m-, p-) 이성질체에 대한 연구도 진행되었다 (Hirota et al., 2004; Han et al., 2003). 그 결과, 두 연구에서 물질간의 제어효율 경향성은 서로 다르게 나타났지만, 이들의 결과에서 동일한 화합물 안에서도 화합물의 분자 구조에 따라 전자빔이 미치는 영향은 확연히 다르다는 것을 확인할 수 있었다. 그러나 xylene의 경우에도 앞에서 언급한 toluene와 마찬가지로 OH 라디칼이 분해 반응에 있어서 지배적인 역할을 한다 (Gerasimov, 2007). Hashimoto et al. (2000)에 따르면 전자빔 조사에 의해서 분해된 o-xylene (초기농도 90 ppm)의 54%가 에어로졸로 전환되고, 이는 benzene (30%)보다 동일 조건에서 보다 많은 에어로졸이 발생되는 것으로 보고된다.
4. 8 뷰티르아세테이트 (Butylacetate)
Hirota et al. (1995b)은 xylene의 전자빔 조사에 따른 제어연구와 동일한 조건으로 butylacetate에 대한 연구도 수행했는데, 그 결과 제어효율은 동일한 조건에서 xylene의 제거효율에 절반밖에 미치지 못하는 것을 확인할 수 있었다. 이와 같이 xylene과 butylacetate 사이에 제거효율의 차이가 발생되는 이유는, xylene과 같은 방향족 VOCs는 전자빔에 의해서 일반적으로 거의 대부분 에어로졸로 분해되기 때문에 더 이상 분해를 위한 활성종의 소모가 필요하기 않아 높은 제거효율을 쉽게 얻을 수 있다. 그러나 butylacetate와 같은 지방족 VOCs의 경우에는 전자빔에 의한 그 분해 과정에서 다양한 가스상의 중간 및 최종생성물이 생성되고 이들이 추가적으로 활성종을 사용하기 때문에 그 제거효율이 충분히 높지 않다고 보고하고 있다 (Hirota et al., 1995b).
4. 9 지방산 (Fatty acids)
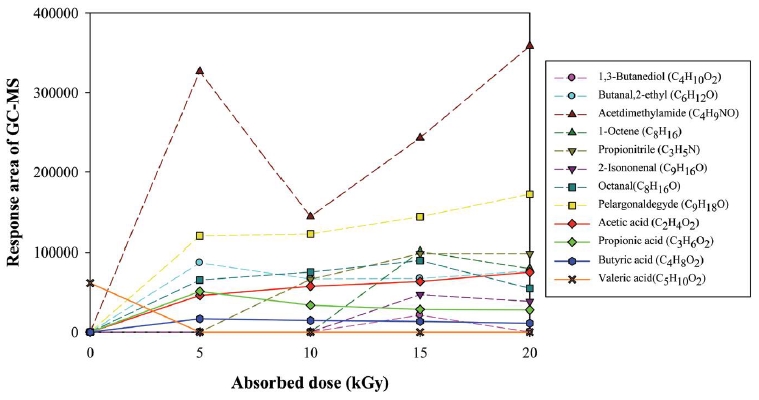
전자빔에 의해서 분해되는 지방산에 대한 연구는 거의 연구가 진행되지 않았다. Seo et al. (2019)의 연구 결과에 따르면, 분자 무게 (molecular weight)가 증가할수록 분해 효율이 증가된다 (acetic acid<propionic acid<butyric acid<isovaleric acid<valeric acid). 또한, 지방산의 분해에 있어서는 다양한 라디칼 중 O 라디칼이 가장 큰 영향을 미친다. 그리고 전자빔으로 valeric acid를 분해하면 더 작은 분자의 지방산으로 분해된다고 보고된다. 현재까지 전자빔에 의한 지방산 분해에서 발생되는 부산물에 대한 연구는 valeric acid를 제외하고는 거의 보고되고 있지 않다. Seo et al. (2019)는 그림 6과 같이GC-MS 분석을 통하여 valeric acid가 전자빔에 의해서 분해될 때, 중간 부산물로 propionic acid와 butyric acid 등이 형성되고, 최종적으로는 acetic acid로 전환된다고 보고했다. 이와 유사한 결과를 기존의 유사 기술을 사용한 연구결과에서도 찾을 수 있었다 (McCollom and Seewald, 2003; Nikolaou et al., 1994).
5. 제안점 및 미래 연구
1990년대부터 현재까지 국내외에서는 전자빔을 이용한 다양한 연구들이 활발히 진행되고 있다. 그러나 전자빔을 이용한 연구는 유사한 원리를 기반으로 한 플라즈마 기술에 비하면 아직도 방사선 발생 등으로 인한 장비에 대한 접근성 및 구축에 필요한 초기 투자비 등의 이유로 많은 연구가 이루어지지 못한 실정이다. 앞에서 언급한 것처럼 국내에서는 악취 및 휘발성유기화합물을 제거하기 위하여 2000년대 초반부터 다양한 연구가 이루어졌지만 여러 이유로 인하여 아직까지 상용화는 이루어지지 않은 실정이다. 그중 대표적인 이유는 본 연구에서 소개한 것과 같이 원하지 않은 다양한 부산물이 생성된다는 것이다. 전자빔 기술은 기본적으로 전자 및 라디칼을 생성하고 이를 이용함으로써 CO2, ozone 및 에어로졸을 비롯한 미량의 다양한 가스 성분들을 발생시킨다. 그러나 이들 생성된 물질들의 일부는 원래 처리하고자 했던 물질 (예: valeric acid)보다 더 높은 독성 (C4H9NO)을 가지고 있는 물질로 전환될 수 있다 (Seo et al., 2019). 따라서 이들 부산물에 대한 독성 평가 및 이들의 배출을 최소화할 수 있는 후단 기술에 대하여 추가적인 연구가 필요하다. 최근 들어, 부산물의 생성을 억제 또는 활용하고자 다양한 후단기술들이 연구되고 있고, 그중 대표적인 기술은 촉매 산화, 마이크로웨이브, 스크러버 기술 등이 있다 (Son, 2017; Son et al., 2015b; Kim et al., 2012, 2005; Calinescu et al., 2009; IAEA, 2005). 전자빔/촉매는 전자빔 조사와 촉매 산화를 결합시킨 기술로서 전자빔 조사를 통하여 발생된 라디칼 및 전자가 악취물질과 반응하여 중간생성물을 생성시키고, 이를 촉매를 사용하여 완전산화시키는 기술이다 (Son, 2017; Park et al., 2005; Kim et al., 2004). 전자빔/마이크로웨이브는 전자빔 운영을 위하여 필연적으로 사용되는 전기 비용을 저감하기 위하여, 마이크로웨이브를 시용하여 자유전자의 수를 증가시켜주고, 적절한 수준에서 에너지를 유지시켜주는 방법이다 (IAEA, 2005). 또한, 보다 최근에는 전자빔/마이크로웨이브의 악취물질 제거효율을 증가시키기 위하여 촉매를 추가로 구성한 전자빔/마이크로웨이브/촉매 기술도 연구되었다 (Calinescu et al., 2009). 전자빔/스크러버 기술은 이러한 하이브리드 기술 중에 가장 늦게 개발된 기술로서 전자빔 조사에 의해서 처리되지 못한 물질 및 부산물을 스크러버를 사용하여 추가로 제거하고, 전자빔 조사 시 발생되는 O3을 폐수처리시설의 공정에 재투입시키는 방법이다 (Son, 2017, 2012; Son et al., 2015b). 그러나 이러한 기술의 접목을 보다 효과적으로 사용하기 위해서는 Scavenger를 활용하여 다양한 물질들에 대한 전자빔 분해 메커니즘이 보다 명확하게 정립되어야 할 것이다. 이와 더불어, 전자빔 기술이 현장에 직접 적용되기 위해서는 장기간의 현장 시운전이 선행되어야 할 것이다. 게다가 전자빔 공정에서는 산화 반응에 의하여 대상물질의 분해가 활발히 이루어지기 때문에, 이 때 생성되는 산성물질의 저감에 대한 연구도 추가적으로 진행되어야 한다 (Park et al., 2019). 그리고 현재 대부분의 전자빔 조사창의 재질로는 티타늄 (Titanium) 박막이 사용되는데, 내산성이 상대적으로 약하기 때문에 산성물질에 대한 내구성이 더 뛰어난 모넬 (Monel) 또는 인코넬 (Inconel) 등을 이용한 연구들이 진행되고 있지만 아직까지는 그 결과가 미비함으로 보다 많은 연구가 수행되어야 한다 (Park et al., 2018).
6. 결 론
본 연구 안에서 우리는 다양한 배출원에서 발생될 수 있는 악취물질을 처리하기 위한 전자빔 기술 내에서 발생할 수 있는 부산물 및 그 분해 메커니즘에 대하여 검토하였다. 여기서 소개한 메커니즘들은 전자빔뿐만 아니라 이와 유사한 기술인 플라즈마에 의한 분해 메커니즘에서도 활용될 수 있을 것이다. 악취물질을 제어하기 위한 전자빔 기술은 1990년대부터 현재까지 실험실 및 현장 규모로 다양하게 연구가 진행되었고, 뛰어난 제어효율 및 다양한 악취물질의 동시 제어라는 측면에서 그 우수성이 있다. 그러나 악취물질을 제어하기 위한 전자빔 기술을 현장에 적용하기 위해서는 장기 시운전을 통한 운전 안정성 확보 및 부산물에 대한 처리 방법 등에 대한 추가적인 연구가 집중적으로 이루어져야 할 것이다. 게다가 전자빔을 구동하기 위해서는 필연적으로 전기에너지가 필요하기 때문에 그 효율을 높이기 위한 전자빔 기술 자체의 개선도 필요하다.
Acknowledgments
This work was supported by the Pukyong National University Research Fund in 2017 (C-D-2017-1503). This research was also supported by the Nuclear R&D program through the National Research Foundation (NRF) of Korea funded by the Ministry of Science and ICT (NRF-2018M2A2B3A06071698).
References
-
Auslender, V.L., Ryazantsev, A.A., Spiridonov, G.A. (2002) The use of electron beam for solution of some ecological problems in pulp and paper industry, Radiation Physics and Chemistry, 63, 641-645.
[https://doi.org/10.1016/S0969-806X(01)00601-6]

-
Bamford, C.H. (1939a) A study of the photolysis of organic nitrogen compounds. Part I. Dimethyl- and diethylnitrosoamines, Journal of the Chemical Society (resumed), 12-17.
[https://doi.org/10.1039/jr9390000012]

-
Bamford, C.H. (1939b) A study of the photolysis of organic nitrogen compounds. Part II. Aliphatic amines, Journal of the Chemical Society (resumed), 17-26.
[https://doi.org/10.1039/jr9390000017]

-
Boumnijel, I., Ben, A.H., Chekir, H., Hajji, N. (2016) Hydrogen sulphide removal from the effluents of a phosphoric acid production unit by absorption into chlorinated seawater under alkaline conditions, Comptes Fendus Chimie, 19, 517-524.
[https://doi.org/10.1016/j.crci.2015.10.010]

-
Buchta, C., Frerichs, H., Stucken, D.-V., Tappe, M., Wagner, H.G.G. (1993) Kinetic and primary product studies of the reaction of O (3P) with styrene in the gas phase, Berichte der Bunsengesellschaft für physikalische Chemie, 97, 658-662.
[https://doi.org/10.1002/bbpc.19930970503]

-
Butkovskaya, N.I., Setser, D.W. (1999) Mechanism for the reaction of hydroxyl radicals with dimethyl disulfide, Chemical Physics Letters, 312, 37-44.
[https://doi.org/10.1016/S0009-2614(99)00862-3]

-
Calinescu, I., Bulearca, A., Ighigeanu, A., Martin, D., Matei, C., Trifan, A. (2009) Hybrid technology with microwaves, electron beams and catalysts for VOCs removals, Journal of Microwave Power and Electromagnetic Energy, 43(3), 4-11.
[https://doi.org/10.1080/08327823.2008.11688615]

-
Callear, A.B., Smith, G.B. (1984) Addition of atomic hydrogen to acetylene. Chain reactions of the vinyl radical, Chemical Physics Letters, 105, 119-122.
[https://doi.org/10.1016/0009-2614(84)80426-1]

-
Callear, A.B., Smith, G.B. (1986) Recurring chains following addition of atomic hydrogen to acetylene, Journal of Physical Chemistry A, 90, 3229-3237.
[https://doi.org/10.1021/j100405a036]

-
Cameron, M., Sivakumaran, V., Dillon, T.J., Crowley, J.N. (2002) Reaction between OH and CH3CHO Part 1. Primary product yields of CH3 (296 K), CH3CO (296 K), and H (237-296 K), Physical Chemistry Chemical Physics, 4, 3628-3638.
[https://doi.org/10.1039/b202586h]

-
Capelli, L., Sironi, S., Del Rosso, R., Centola, P., Rossi, A., Austeri, C. (2011) Olfactometric approach for the evaluation of citizen’s exposure to industrial emissions in the city of Terni, Italy, Science of the Total Environment, 409, 595-603.
[https://doi.org/10.1016/j.scitotenv.2010.10.054]

- Catherine, M.D. (2004) A basic interpretation of the technical language of radiation processing, Radiation Physics and Chemistry, 71, 503-507.
-
Chang, M.B., Tseng, T.D. (1996) Gas-phase removal of H2S and NH3 with dielectric barrier discharges, Journal of Environmental Engineering, 122(1), 41-46.
[https://doi.org/10.1061/(ASCE)0733-9372(1996)122:1(41)]

-
Chmielewski, A.G. (2007) Industrial applications of electron beam flue gas treatment-from laboratory to the practice, Radiation Physics and Chemistry, 76, 1480-1484.
[https://doi.org/10.1016/j.radphyschem.2007.02.056]

-
Chmielewski, A.G., Licki, J., Pawelec, A., Tymiński, B., Zimek, Z. (2004) Operational experience of the industrial plant for electron beam flue gas treatment, Radiation Physics and Chemistry, 71(1-2), 441-444.
[https://doi.org/10.1016/j.radphyschem.2004.03.020]

-
Chmielewski, A.G. (1995) Technological development of EB flue gas treatment based on physics and chemistry of the process, Radiation Physics and Chemistry, 46, 1057-1062.
[https://doi.org/10.1016/0969-806X(95)00320-W]

-
Davoli, E., Gangai, M.L., Morselli, L., Tonelli, D. (2003) Characterization of odorants emissions from landfills by SPME and GC/MS, Chemosphere, 51(5), 357-368.
[https://doi.org/10.1016/S0045-6535(02)00845-7]

-
Deac, I., Almasan, V., Palibroda, N., Indrea, E., Filip, X., Ursu, I. (1996) A low energy source for production of CH3, CN and other free radical: IRMPD of di and trimethylamine molecules, Applied Surface Science, 106, 223-227.
[https://doi.org/10.1016/S0169-4332(96)00426-6]

-
Dean, A.M. (1985) Predictions of pressure and temperature effects upon radical addition and recombination reactions, Journal of Physical Chemistry, 89, 4600-4608.
[https://doi.org/10.1021/j100267a038]

-
Do, W.G., Jung, W.S. (2019) A Study on the Analysis of Contribution Rate by the Odor Emission Sources Using CALPUFF (in Korean with English abstract), Journal of Korean Society for Atmospheric Environment, 35(5), 647-657.
[https://doi.org/10.5572/KOSAE.2019.35.5.647]

-
Doi, Y., Nakanishi, I., Konno, Y. (2000) Operational experience of a commercial scale plant of electron beam purification of flue gas, Radiation Physics and Chemistry, 57(3-6), 495-499.
[https://doi.org/10.1016/S0969-806X(99)00496-X]

- Doutzkinov, N. (2005) Results of the startup operation of a pilot installation in the Maritza 2 thermal plant, International Atomic Energy Agency (IAEA), pp. 35-44.
-
Edwards, D.A., Kerr, J.A., Lloyd, A.C., Trotman-Dickenson, A.F. (1966) Hydrogen-abstraction reactions by methyl radicals from nitrogen-containing compounds, Journal of the Chemical Society A, 621-622.
[https://doi.org/10.1039/j19660000621]

-
Emerson, C.W., Rajagopal, R. (2004) Measuring toxic emissions from landfills using sequential screening, Computers, Environment and Urban Systems, 28(3), 265-284.
[https://doi.org/10.1016/S0198-9715(03)00022-X]

-
Frank, A., Tureček, F. (1999) Study of sulfur oxidation products by pyrolysis high-resolution mass spectrometry, European Journal of Mass Spectrometry, 5(5), 375-384.
[https://doi.org/10.1255/ejms.298]

-
Frank, N.W. (1995) Introduction and historical review of electron beam processing for environmental pollution control, Radiation Physics and Chemistry, 45(6), 989-1002.
[https://doi.org/10.1016/0969-806X(94)00156-E]

- Fukuyama, J. (2004) Odor pollution control for various odor emission sources in Japan, East Asia Workshop on Odor Measurement and Control Review, Office of Odor, Noise and Vibration. Environmental Management Bureau, Ministry of the Environment, Government of Japan, 67-77.
-
Gesser, H., Mullhaupt, J.T., Griffiths, J.E. (1957) The photolysis of trimethylamine, Journal of the American Chemical Society, 79, 4834-4836.
[https://doi.org/10.1021/ja01575a003]

-
Glinski, R.J., Sedarski, J.A., Dixon, D.A. (1981) The chemiluminescent reaction of ozone with methyl mercaptan, Journal of Physical Chemistry, 1981, 85, 2440-2443.
[https://doi.org/10.1021/j150617a005]

-
Gray, P., Jones, A., Thynne, J.C.J. (1965) Kinetics and sites of methyl radical attack on dimethylamine and deuterated dimethylamine, Transactions of the Faraday Society, 61, 474-483.
[https://doi.org/10.1039/tf9656100474]

-
Hakoda, T., Chowdhury, M.A.Z., Shimada, A., Hirota, K. (2009) Oxidation of dimethyl sulfide in air using electron-beam irradiation, and enhancement of its oxidation via a MnO2 catalyst, Plasma Chemistry and Plasma Processing, 29, 549-557.
[https://doi.org/10.1007/s11090-009-9194-y]

-
Hakoda, T., Matsumoto, K., Shimada, A., Narita, T., Kojima, T., Hirota, K. (2008) Application of ozone decomposition catalysts to electron-beam irradiated xylene/air mixtures for enhancing carbon dioxide production, Radiation Physics and Chemistry, 77, 585-590.
[https://doi.org/10.1016/j.radphyschem.2007.09.008]

-
Hakoda, T., Shimada, A., Kimura, A., Taguchi, M., Sugo, Y., Araki, K., Dally, E.B., Hirota, K. (2010) An electron-beam irradiation/catalytic oxidation system for purification of aromatic hydrocarbons/air mixture under practical gas-flow condition, Industrial & Engineering Chemistry Research, 49(2010) 5517-5522.
[https://doi.org/10.1021/ie100278k]

-
Han, D.H., Stuchinskaya, T., Won, Y.S., Park, W.S., Lim, J.K. (2003) Oxidative decomposition of aromatic hydrocarbons by electron beam irradiation, Radiation Physics and Chemistry, 67, 51-60.
[https://doi.org/10.1016/S0969-806X(02)00405-X]

-
Hashimoto, S., Hakoda, T., Hirata, K., Arai, H. (2000) Low energy electron beam treatment of VOCs, Radiation Physics and Chemistry, 57, 485-488.
[https://doi.org/10.1016/S0969-806X(99)00495-8]

-
Hirota, K., Hakoda, T., Arai, H., Hashimoto, S. (2002) Electronbeam decomposition of vaporized VOCs in air, Radiation Physics and Chemistry, 65(4-5), 415-421.
[https://doi.org/10.1016/S0969-806X(02)00353-5]

-
Hirota, K., Matzing, H., Paur, H.R., Woletz, K. (1995a) Analyses of products formed by electron beam treatment of VOC/air mixtures, Radiation Physics and Chemistry, 45, 649-655.
[https://doi.org/10.1016/0969-806X(94)00068-U]

-
Hirota, K., Sakai, H., Washio, M., Kojima, T. (2004) Application of electron beams for the treatment of VOC streams, Industrial & Engineering Chemistry Research, 43, 1185-1191.
[https://doi.org/10.1021/ie0340746]

-
Hirota, K., Woletz, K., Paur, H.R., Mätzing, H. (1995b) Removal of butylacetate and xylene from air by electron beam a product study, Radiation Physics and Chemistry, 46 (4-6) (1995b), 1093-1097.
[https://doi.org/10.1016/0969-806X(95)00329-V]

- International Atomic Energy Agency (IAEA) (1992) Electron beam induced purification of industrial emissions, Applications of isotopes and radiation in conservation of the environment, Proceedings of a symposium, Karlsruhe, Germany, 9-13 Mar 1992, p. 93-104, https://inis.iaea.org/search/search.aspx?orig_q=RN:24006803, .
- International Atomic Energy Agency (IAEA) (1997) Decomposition of volatile organic compounds and polycyclic aromatic hydrocarbons in industrial off gas by electron beams: a review, Radiation technology for conservation of the environment, Proceedings of a symposium held in Zakopane, Poland, 8-12 September 1997, p. 67-85, https://inis.iaea.org/search/search.aspx?orig_q=RN:24006803, .
- International Atomic Energy Agency (IAEA) (2003) Industrial applications of electron beam flue gas treatment, Emerging applications of radiation processing, Proceedings of a technical meeting held in Vienna, 28-30 April 2003, p 153-161, https://inis.iaea.org/search/search.aspx?orig_q=RN:35057931, .
- International Atomic Energy Agency (IAEA) (2004) Process of flue gas desulphuration with electron beam irradiation in China, Radiation treatment of gaseous and liquid effluents for contaminant removal, Proceedings of a technical meeting held in Sofia, Bulgaria, 7-10 September 2004, p 45-51, https://inis.iaea.org/search/search.aspx?orig_q=RN:37062578, .
- International Atomic Energy Agency (IAEA) (2005) VOC removal by combined electron beam and microwave treatment, Electron beam treatment of organic pollutants contained in gaseous streams, 1st RCM Report, Vienna, Austria, 23-27 May, p. 101-113, https://inis.iaea.org/search/search.aspx?orig_q=RN:37026250, .
- Kerr, J.A., Trotman-Dickenson, A.F. (1957) The reactions of methyl radicals with thiols, Journal of the Chemical Society, http://kinetics.nist.gov/kinetics/Detail;jsessionid=DB93951956AE3E07DE06AB0121BB138A?id=1957KER/TRO3322:3, .
-
Khan, F.I., Ghoshal, A.K. (2000) Removal of volatile organic compounds from polluted air, Journal of Loss Prevention in the Process Industries, 13(6), 527-545.
[https://doi.org/10.1016/S0950-4230(00)00007-3]

-
Kim, J., Han, B., Kim, Y., Lee, J.-H., Park, C.R., Kim, J.-C., Kim, J.-C. Kim, K.-J. (2004) Removal of VOCs by hybrid electron beam reactor with catalyst bed, Radiation Physics and Chemistry, 71, 427-430.
[https://doi.org/10.1016/j.radphyschem.2004.04.015]

-
Kim, J.C. (2002) Factors affecting aromatic VOC removal by electron beam treatment, Radiation Physics and Chemistry, 65(4-5), 429-435.
[https://doi.org/10.1016/S0969-806X(02)00341-9]

-
Kim, J.C., Son, Y.S., Kim, K.J., Lim, Y.J., Chung, S.G., Sunwoo, Y., Alsheikhly, M. (2010) Combined radiolytic and catalytic oxidizing method to remove toluene in gas phase, Radiation Physics and Chemistry, 79, 797-802.
[https://doi.org/10.1016/j.radphyschem.2010.01.016]

-
Kim, K.H., Jeon, E.C., Choi, Y.J., Koo, Y.S. (2006) The emission characteristics and the related malodor intensities of gaseous reduced sulfur compounds (RSC) in a large industrial complex, Atmospheric Environment, 40(24), 4478-4490.
[https://doi.org/10.1016/j.atmosenv.2006.04.026]

-
Kim, K.J., Kim, J.C., Kim, J.K., Sunwoo, Y. (2005) Development of hybrid technology using E-beam and catalyst for aromatic VOC control, Radiation Physics and Chemistry, 73(2), 85-90.
[https://doi.org/10.1016/j.radphyschem.2004.06.010]

-
Kim, K.J., Kim, J.H., Son, Y.S., Chung, S.G., Kim, J.C. (2012) Advanced oxidation of aromatic VOCs using a pilot system with electron beam-catalyst coupling, Radiation Physics and Chemistry, 81(5), 561-565.
[https://doi.org/10.1016/j.radphyschem.2012.01.010]

-
Kim, K.M., Seo, S.H., Park, J.H., Kim, T.H., Lee, J.H., Son, Y.S. (2018) A study on additives for improvement of SO2 removal process using an electron beam, Journal of Korean Society for Atmospheric Environment, 34(6), 772-779, (in Korean with English abstract).
[https://doi.org/10.5572/KOSAE.2018.34.6.772]

-
Kozok, P.J., Gesser, H. (1960) The photolysis of triethylamine, and reactions of methyl radicals with triethylamine and diethylamine, Journal of the Chemical Society (resumed), 448-452.
[https://doi.org/10.1039/jr9600000448]

-
Laufer, A.H., Fahr, A. (2004) Reactions and kinetics of unsaturated C2 hydrocarbon radicals, Chemical Reviews, 104, 2813-2832.
[https://doi.org/10.1021/cr030039x]

-
Lee, H.D., Jeon, S.B., Choi, W.J., Lee, S.S., Lee, M.H., Oh, K.J. (2013) A novel assessment of odor sources using instrumental analysis combined with resident monitoring records for an industrial area in Korea, Atmospheric Environment, 74, 277-290.
[https://doi.org/10.1016/j.atmosenv.2013.04.001]

-
Leod, H.M., Jourdain, J.L., Poulet, G., Bras, G.L. (1984) Kinetic study of reactions of some organic sulfur compounds with OH radicals, Atmospheric Environment, 18(12), 2621-2626.
[https://doi.org/10.1016/0004-6981(84)90326-3]

-
Lewkowska, P., Cieślik, B., Dymerski, T., Konieczka, P., Namieśnik, J. (2016) Characteristics of odors emitted from municipal wastewater treatment plant and methods for their identification and deodorization techniques, Environmental Research, 151, 573-586.
[https://doi.org/10.1016/j.envres.2016.08.030]

-
Lindley, C.R.C., Calvert, J.G., Shaw, J.H. (1979) Rate studies of the reactions of the (CH3)2N Radical with O2, NO, and NO2, Chemical Physics Letters, 67(1), 57-62.
[https://doi.org/10.1016/0009-2614(79)87105-5]

-
Machi, S. (1983) Radiation technology for environmental conservation, Radiation Physics and Chemistry, 22(1-2), 91-97.
[https://doi.org/10.1016/0146-5724(83)90196-6]

- Mátzing, H. (1992) Model studies of flue gas treatment by electron beams, IAEA-SM-325/186, 115-123, https://inis.iaea.org/search/search.aspx?orig_q=RN:24006805, .
-
McCollom, T.M., Seewald, J.S. (2003) Experimental study of the hydrothermal reactivity of organic acids and acid anions: II, Acetic acid, acetate, and valeric acid, Geochimica et Cosmochimica Acta, 67(19), 3645-3664.
[https://doi.org/10.1016/S0016-7037(03)00135-2]

-
Na, K., Song, C., Cocker, D.R. (2006) Formation of secondary organic aerosol from the reaction of styrene with ozone in the presence and absence of ammonia and water, Atmospheric Environment, 40(10), 1889-1900.
[https://doi.org/10.1016/j.atmosenv.2005.10.063]

-
Namba, H., Tokunaga, O., Hashimoto, S., Tanaka, T., Ogura, Y., Doi, Y., Aoki, S., Izutsu, M. (1995) Pilot-scale test for electron beam purification of flue gas from coal-combustion boiler, Radiation Physics and Chemistry, 46(4-6), 1103-1106.
[https://doi.org/10.1016/0969-806X(95)00331-Q]

- National Law Information Center (NLIC) (2019) Malodor Prevention Act Enforcement, Ministry of Environment, http://www.law.go.kr/%EB%B2%95%EB%A0%B9/%EC%95%85%EC%B7%A8%EB%B0%A9%EC%A7%80%EB%B2%95%20%EC%8B%9C%ED%96%89%EA%B7%9C%EC%B9%99, .
-
Ni, Z., Liu, J., Song, M., Wang, X., Ren, L., Kong, X. (2015) Characterization of odorous charge and photochemical reactivity of VOC emissions from a full-scale food waste treatment plant in China, Journal of Environmental Science, 29, 34-44.
[https://doi.org/10.1016/j.jes.2014.07.031]

-
Nichipor, H., Dashouk, E., Yacko, S., Sun, Y., Chmielewski, A.G., Zimek, Z., Bułka, S. (2012) Kinetic modeling of benzene and toluene decomposition in air and in flue gas under electron beam irradiation, Radiation Physics and Chemistry, 81(5), 572-579.
[https://doi.org/10.1016/j.radphyschem.2012.01.006]

-
Nichipor, H.V., Dashouk, E.M., Kurbanov, M.A., Salnikov, L.I., Yatsko, S.N. (1995) Chain processes at radiolysis of gaseous mixtures H2S+O2, Radiation Physics and Chemistry, 46(4-6), 1107-1109.
[https://doi.org/10.1016/0969-806X(95)00332-R]

-
Nikolaou, N., Abatzoglou, N., Gasso, S., Chornet, E. (1994) The oxidation of valeric acid in aqueous solution, The Canadian Journal of Chemical Engineering, 72, 1994, 522-533.
[https://doi.org/10.1002/cjce.5450720319]

-
Novoselov, Yu.N., Filatov, I.E. (2003) Elimination of styrene vapor from air by a pulsed electron beam, Technical Physics, 48(12), 1594-1597.
[https://doi.org/10.1134/1.1634684]

-
Ostapczuk, A., Chmielewski, A.G., Honkonen, V., Ruuskanen, J., Tarhanen, J., Svarfvar, B. (1999) Preliminary test in decomposition of styrene by electron beam treatment, Radiation Physics and Chemistry, 56, 369-371.
[https://doi.org/10.1016/S0969-806X(99)00182-6]

-
Park, J.H., Ahn, J.W., Kim, K.H., Son, Y.S. (2019) Historic and futuristic review of electron beam technology for the treatment of SO2 and NOx in flue gas, Chemical Engineering Journal, 355, 351-366.
[https://doi.org/10.1016/j.cej.2018.08.103]

-
Park, J.H., Shin, I.H., Seo, S.H., Choi, C.Y., Son, Y.S. (2018) The optimization of SF6 decomposition process using an electron beam, Radiation Physics and Chemistry, 151, 192-197.
[https://doi.org/10.1016/j.radphyschem.2018.06.027]

- Park, K.N., Kim, K.J., Kim, J.C., Sunwoo, Y., Song, H.N. (2005) Removal Efficiency of Toluene by EBeam-Catalyst Coupling System, Journal of Korean Society for Atmospheric Environment, 21(6), 667-673 (in Korean with English abstract).
-
Parmar, G.R., Rao, N.N. (2009) Emerging control technologies for volatile organic compounds, Critical Reviews in Environmental Science and Technology, 39(1), 41-79.
[https://doi.org/10.1080/10643380701413658]

-
Päur, H.R., Jordan, S., Mätzing, H. (1990) Waste air cleaning with electron beam, Chemie Ingenieur Technik, 62, 321-323.
[https://doi.org/10.1002/cite.330620417]

-
Päur, H.R., Mätzing, H., Woletz, K. (1991) Removal of volatile organic compounds from industrial offgas by irradiation induced aerosol formation, Journal of Aerosol Science, 22, S509-S512.
[https://doi.org/10.1016/S0021-8502(05)80150-8]

-
Qamaruz-Zaman, N., Kun, Y., Rosli, R.N. (2015) Preliminary observation on the effect of baking soda volume on controlling odour from discarded organic waste, Waste Management, 35, 187-190.
[https://doi.org/10.1016/j.wasman.2014.09.017]

-
Qamaruz-Zaman, N., Milke, M.W. (2012) VFA and ammonia from residential food waste as indicators of odor potential, Waste Management, 32(12), 2426-2430.
[https://doi.org/10.1016/j.wasman.2012.06.023]

- Rafson, H.J. (1998) Odor and VOC control handbook, McGraw-Hill, New York.
- Seetula, J., Blomqvist, K., Kalliorinne, K., Koskikallio, J. (1985) Kinetics of reactions between CH3, CH3CO and (CH3)2 N radicals produced by flash-photolysis of N, N-dimethylacetamide in gas-phase, Finnish Chemical Letters, 69, 139-140.
-
Seetula, J., Blomquist, K., Kalliorinne, K., Koskikallio, J. (1986) Kinetics of radical reactions between methyl, acetyl and dimethylamino radicals formed in the flash photolysis of N, N-dimethylacetamide in the gas phase, Acta Chemica Scandinavica, 40(10), 658-663.
[https://doi.org/10.3891/acta.chem.scand.40a-0658]

-
Seo, S.H., Park, J.H., Kim, K., Kim, T.H., Kim, H.W., Son, Y.S. (2019) Decomposition of volatile fatty acids using electron beam irradiation, Chemical Engineering Journal, 360, 494-500.
[https://doi.org/10.1016/j.cej.2018.12.005]

- Son, Y.S. (2012) A technique for removing odorous sulfur compounds using an electron beam hybrid system, Ph. D. Dissertation of Konkuk University.
-
Son, Y.S. (2017) Decomposition of VOCs and odorous compounds by radiolysis: A critical review, Chemical Engineering Journal, 316, 609-622.
[https://doi.org/10.1016/j.cej.2017.01.063]

-
Son, Y.S., Jung, I.H., Lee, S.J., Koutrakis, P., Kim, J.C. (2015a) Decomposition of sulfur compounds by radiolysis: II. By-products and mechanisms, Chemical Engineering Journal, 269, 27-34.
[https://doi.org/10.1016/j.cej.2015.01.079]

-
Son, Y.S., Jung, I.H., Lee, S.J., Kim, J.C. (2015b) Decomposition of sulfur compounds by a radiolysis: III. A hybrid system and field application, Chemical Engineering Journal, 274, 9-16.
[https://doi.org/10.1016/j.cej.2015.03.122]

-
Son, Y.S., Kim, J., Kim, J.C. (2014) Decomposition of acetaldehyde using an electron beam, Plasma Chemistry and Plasma Processing, 34, 1233-1245.
[https://doi.org/10.1007/s11090-014-9540-6]

-
Son, Y.S., Kim, J.C. (2015) Decomposition of sulfur compounds by radiolysis: I. Influential factors, Chemical Engineering Journal, 262, 217-223.
[https://doi.org/10.1016/j.cej.2014.09.070]

-
Son, Y.S., Kim, K.H., Kim, K.J., Kim, J.C. (2013a) Ammonia Decomposition Using Electron Beam, Plasma Chemistry and Plasma Processing, 33(3), 617-629.
[https://doi.org/10.1007/s11090-013-9444-x]

-
Son, Y.S., Kim, P., Park, J.H., Kim, J., Kim, J.C. (2013b) Decomposition of trimethylamine by an electron beam, Plasma Chemistry and Plasma Processing, 33, 1099-1109.
[https://doi.org/10.1007/s11090-013-9479-z]

-
Son, Y.S., Kim, J.C., Kim, K.H., Lim, B.A., Park, K.N., Lee, W.K. (2007) The Composition of Odor Compounds Emitted from Municipal Solid Waste, Journal of Korean Society for Atmospheric Environment, 23(6), 666-674 (in Korean with English abstract).
[https://doi.org/10.5572/KOSAE.2007.23.6.666]

- Son, Y.S., Kim, S.Y., Kim, J.C., Park, K.N., Moon, J.S. (2007a) Evaluation of Stability for Odorous Sulfur Compounds by Sampling Container, Journal of the Korean Society for Environmental Analysis, 10(2), 66-71 (in Korean with English abstract).
-
Son, Y.S., Kim, K.J., Kim, J.C. (2010a) A review on VOCs control technology using electron beam, Asian Journal of Atmospheric Environment, 4(2), 63-71.
[https://doi.org/10.5572/ajae.2010.4.2.063]

-
Son, Y.S., Kim, K.J., Kim, J.Y., Kim, J.C. (2010b) Comparison of the decomposition characteristics of aromatic VOCs using an electron beam hybrid system, Radiation Physics and Chemistry, 79(12), 1270-1274.
[https://doi.org/10.1016/j.radphyschem.2010.07.006]

-
Son, Y.S., Park, K.N., Kim, J.C. (2010c) Control factors and by-products during decomposition of butane in electron beam irradiation, Radiation Physics and Chemistry, 79(12), 1255-1258.
[https://doi.org/10.1016/j.radphyschem.2010.07.050]

-
Son, Y.S., Son, Y.S., Park, J.H., Kim, P., Kim, J.C. (2012) Oxidation of gaseous styrene by electron beam irradiation, Radiation Physics and Chemistry, 81, 686-692.
[https://doi.org/10.1016/j.radphyschem.2012.02.011]

- Spinks, J.W.T., Woods, R.J. (1990) An introduction to radiation chemistry, 3rd, John Wiley & Sons, Inc.
-
Sun, Y., Chmielewski, A.G. (2012) Organic Pollutants Treatment from Air Using Electron Beam Generated Nonthermal Plasma - Overview, Organic Pollutants Ten Years After the Stockholm Convention - Environmental and Analytical Update, Dr. Tomasz Puzyn (Ed.), ISBN: 978-953-307-917-2, InTech, Available from: http://www.intechopen.com/books/organic-pollutants-ten-yearsafter-the-stockholm-conventionenvironmental-andanalytical-update/organic-pollutants-treatmentfrom-air-using-electron-beamgeneratednonthermalplasma-overview, .
[https://doi.org/10.5772/35631]

- Sun, Y., Chmielewski, A.G., Bułka, S., Zimek, Z. (2009a) Decomposition of toluene in air mixtures under electron beam irradiation, NUKLEONIKA, 54(2), 65-70.
-
Sun, Y., Chmielewski, A.G., Licki, J., Bułka, S., Zimek, Z. (2009b) Decomposition of organic compounds in simulated industrial off-gas by using electron beam irradiation, Radiation Physics and Chemistry, 78, 721-723.
[https://doi.org/10.1016/j.radphyschem.2009.03.049]

-
Sun, Y., Chmielewski, A.G., Bułka, S., Zimek, Z. (2013) Toluene and 4-chlorotoluene decomposition in air mixture in electron beam generated non-thermal plasma reactor and their by-products identification, Surface and Coatings Technology, 234, 104-113.
[https://doi.org/10.1016/j.surfcoat.2013.05.011]

-
Tanthapanichakoon, W., Charinpanitkul, T., Chaiyo, S., Dhattavorn, N., Chaichanawoug, J., Sano, N., Tamon, H. (2004) Effect of oxygen and water vapor on the removal of styrene and ammonia from nitrogen by non-pulse corona-discharge at elevated temperatures, Chemical Engineering Journal, 97(2-3), 213-223.
[https://doi.org/10.1016/S1385-8947(03)00212-2]

-
Tarr, A.M., Strausz, O.P., Gunning, H.E. (1966) Reactions of the ethynyl radical. Part 2.-With alkenes, Transactions of the Faraday Society, 62, 1221-1230.
[https://doi.org/10.1039/TF9666201221]

-
Tokmakov, I.V., Park, J., Gheyas, S., Lin, M.C. (1999) Experimental and theoretical studies of the reaction of the phenyl radical with methane, Journal of Physical Chemistry A, 103, 3636-3645.
[https://doi.org/10.1021/jp983140s]

-
Tsai, C.-H., Lee, W.-J., Chen, C.-Y., Liao, W.T. (2001) Decomposition of CH3SH in a RF plasma reactor: reaction products and mechanisms, Industrial & Engineering Chemistry Research, 40, 2384-2395.
[https://doi.org/10.1021/ie0009637]

-
Tsang, W. (1989) Rate constants for the decomposition and formation of simple alkanes over extended temperature and pressure ranges, Combust and Flame, 78(1), 71-86.
[https://doi.org/10.1016/0010-2180(89)90008-4]

-
Tsang, W. (1991) Chemical kinetic data base for combustion chemistry. Part V. Propene, Journal of Physical and Chemical Reference Data, 20, 221-273.
[https://doi.org/10.1063/1.555880]

-
Tsang, W., Hampson, R.F. (1986) Chemical kinetic data base for combustion chemistry. Part I. Methane and related compounds, Journal of Physical and Chemical Reference Data, 15, 1087.
[https://doi.org/10.1063/1.555759]

-
Tuazon, E.C., Arey, J., Atkinson, R., Aschmann, S.M. (1993) Gas-phase reactions of 2-vinylpyridine and styrene with OH and NO3 radicals and O3, Environmental Science and Technology, 27, 1832-1841.
[https://doi.org/10.1021/es00046a011]

-
Wang, L., Erkan, N., Gong, H., Okamoto, K. (2018) Electron beam irradiation effect on critical heat flux in downward-facing flow boiling, International Journal of Heat and Mass Transfer, 120, 300-304.
[https://doi.org/10.1016/j.ijheatmasstransfer.2017.12.055]

-
Wang, X., Xie, B., Wu, D., Hassan, M., Huang, C. (2015) Characteristics and risks of secondary pollutants generation during compression and transfer of municipal solid waste in Shanghai, Waste Management, 43, 1-8.
[https://doi.org/10.1016/j.wasman.2015.07.005]

-
Westmoreland, P.R., Dean, A.M., Howard, J.B., Longwell, J.P. (1989) Forming benzene in flames by chemically activated isomerization, Journal of Physical Chemistry, 93, 8171-8180.
[https://doi.org/10.1021/j100362a008]

- Wittig, S., Spiegel, G., Platzer, K.-H., Willibald, U. (1988) Simultane Rauchgasreinigung durch Elektronenstrahl, Kernforschungszentrum Karlsruhe, KfK-PEF 45(1988) 111p.
-
Woolley, G.R., Cvetanovic, R.J. (1969) Production of hydrogen atoms by photolysis of H2S and the rates of their addition to olefins, Journal of Chemical Physics, 50(11), 4697.
[https://doi.org/10.1063/1.1670958]

-
Wysocka, I., Gebicki, J., Namieśnik, J. (2019) Technologies for deodorization of malodorous gases, Environmental Science and Pollution Research, 26, 9409-9434.
[https://doi.org/10.1007/s11356-019-04195-1]

-
Xia, L., Huang, L., Shu, X., Zhang, R., Dong, W., Hou, H. (2008) Removal of ammonia from gas streams with dielectric barrier discharge plasmas, Journal of Hazardous Materials, 152(1), 113-119.
[https://doi.org/10.1016/j.jhazmat.2007.06.070]

-
Yan, N.-Q., Qu, Z., Jia, J.-P., Wang, X.-P., Wu, D. (2006) Removal characteristics of gaseous sulfur-containing compounds by pulsed corona plasma, Industrial & Engineering Chemistry Research, 45, 6420-6427.
[https://doi.org/10.1021/ie060471f]

-
Yang, J., Shi, Y., Chen, J., Su, Q., Wang, D., Cao, J. (2009) Decomposition of dimethyl sulfide in a wire-cylinder pulse corona reactor, Journal of Zhejiang University-SCIENCE A, 10(1), 127-132.
[https://doi.org/10.1631/jzus.A0820185]

- Yang, S.B., Kim, S.M. (2000) A Comparative Study for Odor Control Regulations, Journal of Korean Society for Atmospheric Environment, 16(1), 79-87 (in Korean with English abstract).
-
Yin, F., Grosjean, D., Seinfeld, J.H. (1990) Photooxidation of dimethyl sulfide and dimethyl disulfide. I: mechanism development, Journal of Atmospheric Chemistry, 11, 309-364.
[https://doi.org/10.1007/BF00053780]

-
Yonghua, D., Degui, Z., Aoshuang, Y., Guanghua, N. (2002) The present status and trend of ionizing-radiation application on environment protection in China, Radiation Physics and Chemistry, 63(3-6), 657-659.
[https://doi.org/10.1016/S0969-806X(01)00602-8]

-
Zhou, Y., Hallis, S.A., Vitko, T., Suffet, I.H. (2016) Identification, quantification and treatment of fecal odors released into the air at two wastewater treatment plants, Journal of Environmental Management, 180, 257-263.
[https://doi.org/10.1016/j.jenvman.2016.05.046]

서서희 (부경대학교 환경연구소 전임연구원)
손윤석 (부경대학교 환경공학과 조교수)