VOx/WO3-TiO2 SCR 촉매의 바나듐 표면밀도 조절에 따른 탈질효율 증진 연구
Copyright © 2019 Korean Society for Atmospheric Environment
Abstract
In this study, we conducted a study to enhance the DeNOX efficiency by optimizing the preparation method of VOx/WO3-TiO2 commercial catalysts for coal-fired power plants. Optimization of catalyst was carried out by controlling vanadium surface density. Through Raman analysis, the structure species according to the surface density of vanadium was identified, and the difference in DeNOX efficiency was verified accordingly.
Keywords:
De-NOX, V/TiO2, NH3-SCR, Surface density, Catalyst1. 서 론
오늘날 에너지 사용 증가에 따른 환경적인 문제가 매우 심각한 상태에 이르고 있다. 런던 스모그 사건, LA 스모그 사건 등과 같은 환경오염 문제는 인류의 생존을 위협할 수 있으므로 세계적으로도 중요한 문제로 인식되고 있다. 이러한 환경문제를 일으키는 대표적인 대기오염물질은 황산화물 (SOx), 질소산화물 (NOX), 암모니아 (NH3), 오존 (O3), 휘발성유기화합물 (VOCs) 등이 있다. 그중 질소산화물은 석탄 화력발전소, 선박, 소각로, 자동차 등 다양한 발생원에서 배출되고 있으며, 대기오염물질 가운데 가장 많은 양이 배출되고 있다. 질소산화물이 대기 중으로 배출될 경우 지구온난화, 산성비, 오존층 파괴 그리고 광학스모그를 유발한다 (Metkar et al., 2012; Qi and Yang, 2003). 뿐만 아니라, 배출된 대기 중 질소산화물은 암모니아 (NH3)와 반응하여 2차적 미세먼지 (PM2.5)인 질산암모늄 (NH4NO3)을 생성한다. 따라서 질소산화물 처리에 대한 필요성은 점차 증가되고 있다. 특히 최근 다양한 질소산화물 배출시설 중 보일러, 대형 발전시설 등의 배출허용기준은 강화되고 있다. 따라서 강화되는 환경법규에 능동적으로 대처하기 위한 경제적인 질소산화물 제거 기술이 요구된다.
발전시설에서 배출되는 질소산화물을 제거하기 위한 최적의 방지기술로는 암모니아를 환원제로 이용한 선택적 촉매 환원법 (Selective Catalytic Reduction; NH3-SCR)이 널리 이용되고 있다. NH3-SCR의 반응식은 다음과 같다 (Forzatti, 2001).
| (1) |
NH3-SCR에서 촉매는 이산화티타늄 (TiO2) 산화물과 바나듐 (V)의 혼합물을 주로 사용하고 있다. 선택적 촉매 환원법에서 촉매의 개발은 기술의 핵심으로 탈질효율에 큰 영향을 미친다. 따라서 이러한 바나듐계 촉매는 세계적으로 광범위하게 연구가 진행되어 왔다. 바나듐계 촉매는 합성방법에 따라서 최종 촉매의 구조와 활성금속의 분산도에 영향을 미친다 (Carrero et al., 2013; Vuurman et al., 1991). 바나듐은 제조된 촉매의 표면에 분산되는 정도에 따라 단량체 (monomeric) 바나듐, 고분자 (polymeric) 바나듐 그리고 결정화된 바나듐 (crystalline V2O5)으로 나뉜다 (Tang et al., 2012; Wu et al., 2012; Tian et al., 2006). 이러한 바나듐의 다양한 구조는 NH3-SCR 탈질효율에 영향을 미칠 수 있다 (Peng et al., 2014). 고분자 바나듐의 형성은 격자 산소의 유동성이 우수하며 높은 가역성을 갖는다 (Nova et al., 2001). 따라서 촉매의 탈질효율은 고분자 바나듐의 반응성이 단량체 바나듐에 비하여 더 큰 것으로 확인되었으며, 바나듐이 담지되기 전 지지체의 비표면적을 제어함에 따라 바나듐의 분산도를 제어하는 방법이 제안되고 있다 (Won et al., 2018; Kwon et al., 2015). 따라서 이러한 바나듐계 탈질촉매의 비표면적 제어에 따른 바나듐의 분산도 제어는 우수한 탈질효율을 나타낼 수 있다. 현재 상용되는 바나듐계 촉매는 V2O5/TiO2에 텅스텐 (W)을 첨가하여 제조되며, 300~400°C의 온도 범위에서 다른 촉매에 비해 우수한 효율을 나타낸다 (Cho, 1994). 텅스텐은 첨가 시 바나듐과 결합하지 않으며, 첨가방법 (함량, 소성온도 등)에 따라 표면 바나듐의 구조에 영향을 미치는 것으로 알려져 있다 (Yuangyuan et al., 2016).
따라서 본 연구에서는 실제 석탄 화력발전소에서 상용 중인 V2O5/WO3-TiO2 촉매의 제조방법 최적화를 위한 연구를 수행하였다. 촉매의 제조방법으로는 바나듐 함량 및 바나듐이 담지되기 전 WO3-TiO2 지지체의 비표면적 (BET)을 제어하였다. 또한 비표면적이 서로 다른 지지체에 바나듐을 담지함에 따라 앞선 선행연구 (Won et al., 2018)에 제시된 식을 이용하여 바나듐의 표면밀도를 계산하였으며, 이에 따른 반응활성의 영향을 확인하였다. 또한 최적 촉매와 상용촉매를 비교하여 석탄 화력발전소 운전온도에서 탈질효율의 차이를 확인하고 이에 따른 영향을 확인하였다.
2. 실 험
2. 1 촉매 제조방법
본 연구에서는 바나듐을 활성금속으로 사용하였으며, 지지체로는 현재 상용되고 있는 TiO2 및 W-TiO2을 이용하여 촉매를 제조하였다. TiO2 및 W-TiO2의 물리적인 특성은 표 1에 자세히 나타내었다.
바나듐 담지 전 지지체의 비표면적을 제어하기 위하여 아래의 두 가지 방법을 이용하였다.
첫 번째는 상용 중인 W-TiO2를 각각 다른 온도로 소성하여 비표면적을 제어하였다. W-TiO2는 400°C부터 100°C 간격으로 700°C까지 4 h 동안 소성하여 각각 비표면적이 다른 지지체를 얻을 수 있었으며, 다양한 온도로 소성한 촉매를 W-TiO2 (WTix00)로 표기하였다. 소성처리를 하지 않은 W-TiO2는 그대로 표기하였다. 두 번째는 TiO2를 미리 다른 온도로 소성하여 비표면적을 제어한 후 텅스텐을 담지하여 제조하였다. TiO2는 500°C부터 100°C 간격으로 700°C까지 4 h 동안 소성하여 비표면적을 제어하였다. 촉매 제조방법은 습윤 함침법 (wet impregnation method)을 이용하여 TiO2에 텅스텐을 담지하였으며, 전구체는 ammonium metatungstate hydrate ((NH4)6H2W12 O40·H2O; Aldrich chemical Co.)를 사용하였다. 텅스텐은 TiO2의 무게 대비 5%만큼 전구체의 양을 계산하여 60°C로 가열된 증류수에 녹이고 30 min 동안 교반시킨다. 혼합된 수용액은 준비된 TiO2에 담지하여 1 h 이상 교반한다. 제조된 슬러리는 65°C, 65 mmHg의 조건으로 회전진공증발기 (N-N series, Eyela Co.)를 이용하여 수분을 1차로 증발시키고, 잔여 수분은 105°C 오븐을 이용하여 24 h 동안 건조시킨다. TiO2에 텅스텐을 결합시키기 위하여 600°C에서 4 h 동안 소성하여 최종 지지체를 얻었다. 또한 해당 지지체로 제조한 촉매를 W/TiO2 (Tix00)로 표기하였다. XRF 분석을 통하여 상용 W-TiO2 및 제조된 W/TiO2 (Tix00)의 텅스텐 담지 함량을 조사하였으며, 표 2의 결과에 따라 오차범위 이내의 함량으로 제조되었음을 확인할 수 있었다.
다음으로 바나듐을 담지하기 위해 전구체는 ammonium metavanadate (NH4VO3; Aldrich chemical Co.)를 사용하였으며, 용해도를 높이기 위해 oxalic acid ((COOH)2; Aldrich chemical Co.)를 사용하였다. 제조방법은 준비된 비표면적이 다른 각각의 지지체의 무게 대비 1~3%만큼 바나듐 전구체량을 계산하고, 계산된 양의 ammonium metavanadate를 60°C로 가열된 증류수에 녹이고 30 min 동안 교반한다. 혼합된 수용액은 온도를 식힌 후 oxalic acid를 pH 값이 2.5가 될 때까지 혼합한다. 준비된 지지체에 혼합된 수용액을 담지하고 1 h 이상 교반한다. 제조된 슬러리는 65°C, 65 mmHg의 조건으로 회전진공증발기 (N-N series, Eyela Co.)를 이용하여 수분을 1차로 증발시키고, 잔여 수분은 105°C 오븐을 이용하여 24 h 동안 건조시킨다. 건조된 촉매는 공기 분위기 하에 500°C까지 10°C/min의 속도로 승온하여 4 h 동안 소성했다. 최종적으로 제조된 촉매는 제조방법에 따라 V[y]/W-TiO2 (WTix00), V[y]/W/TiO2 (Tix00)으로 표기하였다. 또한 열처리가 없는 상용 W-TiO2로 제조한 촉매는 V[y]/W-TiO2로 표기하였으며, 상용촉매는 VOx/WO3-TiO2로 표기하였다.
허니컴에 코팅된 촉매의 실험은 35 cpsi의 코디어라이트 세라믹허니컴 (Ceracomb Co.)을 담체로 사용하였으며, 현재 석탄 화력발전소에서 상용 중인 2% VOx/5% WO3-TiO2 파우더 촉매와 본 연구에서 반응활성이 우수했던 V[2]/W/TiO2 (Ti500) 파우더 촉매를 허니컴 담체에 딥 코팅 (dip-coating)하여 수행하였다. 코팅방법으로는 준비된 증류수와 파우더 촉매를 1 h 교반하여 슬러리를 제조하였다. 실험을 위하여 35 cpsi 허니컴 담체를 10 mm (w)×10 mm (L)×36/25/19 mm (H) 크기로 소분하였으며, 슬러리에 허니컴 담체를 담갔다 뺀 후 파우더가 뭉치지 않도록 공기압축기 (air compressor)를 이용하여 강하게 불어주었다. 코팅된 허니컴 담체는 105°C 오븐에서 건조하여 수분을 제거하였으며, 코팅 후 무게에서 코팅 전 무게를 빼서 허니컴 담체에 담지된 파우더 촉매의 양을 확인하였다. 파우더 촉매는 허니컴 담체의 부피에 100 g/L 만큼 담지하여 제조하였고, 목표 담지량이 담지될 때까지 3 회 이상 반복하여 코팅하였다. 이 때 순수 촉매의 전환율을 고려하기 위하여 코팅 슬러리에는 바인더를 별도로 첨가하지 않았다. 촉매가 목표 담지량 만큼 코팅된 허니컴 촉매는 공기 분위기로 400°C에서 4 h 동안 소성하였다.
2. 2 실험장치 및 방법
가스는 N2, O2, NH3, NO로 MFC (Mass Flow Controller)를 이용하여 유량을 조절하였다. 이 중 jacket 형태의 bubbler는 circulator를 이용하여 물을 순환시켜 40°C로 일정하게 유지하였고, N2를 폭기시켜 수분을 일정량 공급하였다. 폭기된 수분이 응축되지 않고, NO와 NH3가 반응하여 NH4NO3 또는 NH4NO2와 같은 염이 생성되는 것을 방지하기 위해 반응기로 유입되는 가스온도를 180°C로 일정하게 유지시켰다. 실험 장치의 반응기는 파우더 촉매의 경우 내경 6 mm, 높이 600 mm인 석영관을 사용하였으며, 허니컴 코팅 촉매는 내경 11 mm, 높이 600 mm인 석영관을 사용하였다. 반응기의 온도는 220~400°C로 유지하면서 실험을 수행하였다. 사용된 파우더 촉매는 균일성을 유지하기 위하여 유압프레스를 사용하여 40~50 mesh로 체가름하여 펠렛화한 후 석영관에 0.6 cc를 충진시켰다. 반응물과 생성물의 정확한 농도를 측정하기 위해서 NO 농도는 cold trap을 거쳐 수분을 완전히 제거하였으며, 비분산 적외선 가스분석기 (Uras10E, Hartman & Braun Co.)로 측정하였다. N2O 가스의 농도는 비분산 적외선 가스분석기 (ULT RAMAT 6, Sie-mens)로 측정하였다. NO2 가스의 농도는 검지관 (9 L, Gas Tec. Co.)을 사용하였고, NH3 가스는 검지관 (3 M, 3 La, 3 L, Gas Tec. Co.)을 이용하여 측정하였다.
실험 조건은 표 3에 나타내었고, N2 분위기 하에 NOX 농도를 800 ppm으로 고정하였다. 주입되는 NH3는 NOX와 1 : 1의 비로 주입하였고, 반응가스 내 산소 농도를 3 vol.%로 주입하였다. 또한 수분은 6 vol.%로 주입하여 총 가스량을 600 cc/min로 유지하였다.
실험 방법은 제조된 촉매를 반응기에 충진하고, 촉매의 산화상태를 균일하게 유지하기 위하여 400°C에서 1시간 동안 전처리를 수행했다. 반응기의 온도가 정상상태에 도달하면 O2, N2, NO, NH3, 가스를 반응기 내로 투입하여 생성물의 농도가 일정해질 때까지 실험을 지속시켰으며, 이때의 농도를 기록했다. 촉매의 활성은 NOX의 전환율로 나타내었고, 식 (2)과 같이 정의하였다.
| (2) |
2. 3 촉매 특성분석
촉매의 비표면적 측정은 ASAP 2010C (Micro meritics Co.) 장비를 사용하였고, 비표면적은 BET (Brunauer-Emmett-Teller) 식을 이용하여 구하였다. 이때 각각의 시료는 300°C에서 2 h 동안 진공상태로 가스를 제거하여 분석하였다.
XRD 분석은 X’Pert PRO MRD (PAN analytical Co.)에 의하여 분석을 수행하였다. Radiation source는 Cu Ka (λ=1.5056 Å) 사용하였고, X-ray generator는 30 kW, monochromator는 사용하지 않았다. 2θ는 10~90°의 범위를 6°/min 주사속도로 측정하였다.
Raman spectra 분석은 light source를 argon laser로 하며, multichannel CCD detector가 장착되어 있는 Yvon T64000 (France Jobin Co.)을 사용하여 분석을 수행하였다. Laser multiline power는 5 W (457.8~514.5 nm), resolution은 0.72 cm-1에서 측정하였다.
XRF 분석은 ZSX Primus II (Rigaku Co.) 장비를 이용하여 수행하였다.
3. 결과 및 고찰
3. 1 VOx/WO3-TiO2의 바나듐 표면밀도 최적화에 따른 반응활성 영향
바나듐계 촉매는 활성금속의 구조에 따라 탈질효율에 큰 영향을 받는다 (Pneg et al., 2014). 바나듐계 촉매에서 표면 바나듐의 구조를 제어하는 방법은 다양하다. Won et al. (2018)은 바나듐이 담지될 TiO2의 비표면적 및 바나듐 함량을 달리하여 제어하였으며, 최적의 바나듐 표면밀도에서 우수한 탈질효율을 나타내는 것을 확인하였다. 따라서 본 연구에서는 서론에서 언급한 바와 같이 실제 석탄 화력발전소 선택적 촉매 환원반응 (SCR)에 사용되고 있는 VOx/WO3-TiO2 상용촉매의 바나듐 표면밀도 최적화 연구를 수행하였다. 그러나 최적화 실험 시 350~370°C 온도에서 물질전달속도가 높기 때문에 탈질효율을 비교하기 어렵다. 따라서 250°C를 기준으로 파우더 샘플을 이용하여 탈질효율을 비교하고, 3.3절에서 허니컴을 이용하여 최적촉매와 상용촉매의 탈질효율 차이를 확인하였다.
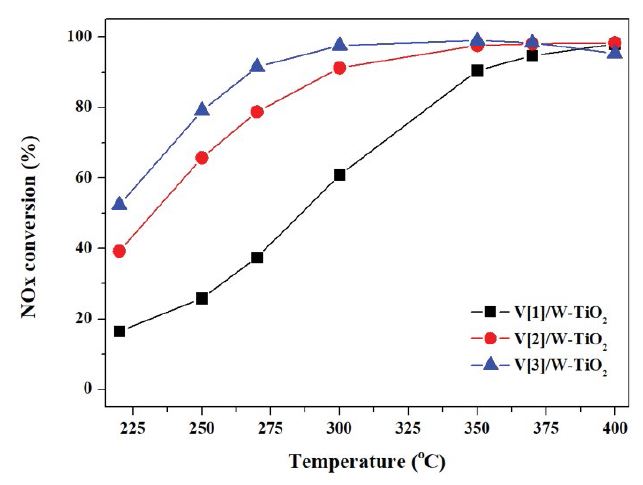
최적의 바나듐 표면밀도를 확인하기 위하여 가장 먼저 바나듐의 함량을 1~3%로 조절하여 W-TiO2에 담지하였으며, 그 결과를 그림 1에 나타내었다. 반응활성 실험 조건은 공간속도 180,000 h-1, NOX 800 ppm, NH3/NOX ratio : 1, O2 3 vol.%, H2O 6 vol.%, N2 balance, 반응온도 범위는 220~400°C에서 수행하였다.
NOX 전환율을 나타내는 그림 1의 결과를 살펴보면, 바나듐의 함량이 증가할수록 NOX 전환율은 증가하는 경향을 나타내었다. V[3]/W-TiO2 촉매의 경우 250°C에서 79.125%를 나타내었고, V[2]/W-TiO2는 65.75%, V[1]/W-TiO2는 25.875%로 지지체의 비표면적이 일정할 때 바나듐 함량에 따른 탈질효율이 크게 차이 나는 것을 확인할 수 있었다. 최적의 바나듐 표면밀도를 확인하기 위한 또 다른 방법으로 바나듐을 담지하기 전 지지체의 비표면적을 제어하였다. 지지체의 비표면적을 제어하기 위한 방법으로는 첫 번째로 상용되고 있는 W-TiO2를 400~700°C의 온도로 소성하였으며, 이때의 비표면적을 표 4에 나타내었다. 두 번째로 상용되고 있는 TiO2를 우선적으로 500~700°C 소성하여 비표면적을 제어하고 난 후 텅스텐을 담지하여 W/TiO2 (Tix00)를 제조하였으며, 해당 지지체를 600°C에서 4 h 소성 후의 비표면적을 표 5에 나타내었다.
그 결과 상용되고 있는 W-TiO2의 경우 소성온도가 증가함에 따라 비표면적이 109.28 m2/g에서 39.567 m2/g까지 감소하는 것을 확인할 수 있었다. 또한 TiO2의 비표면적을 500~700°C로 소성하여 미리 제어했을 때 각각 69.622, 48.851, 38.866 m2/g을 나타내었다. 해당 TiO2에 텅스텐을 담지하고 결합시키기 위하여 600°C에서 4 h 동안 소성한 후에 비표면적을 확인한 결과 소성온도가 높아짐에 따라 비표면적이 크게 변하지 않는 것을 확인하였다. 이러한 결과는 우선적으로 TiO2를 소성함에 따라 불순물이 제거되고, 이에 따라 텅스텐 담지 후에는 비표면적의 감소가 작은 것으로 판단된다. 따라서 W/TiO2 (Tix00)의 비표면적은 각각 59.76, 45.71, 37.48 m2/g을 나타내었다. 이를 통해 지지체의 소성온도에 따른 비표면적이 확실히 제어되었음을 확인하였다. 따라서 비표면적이 서로 다른 지지체의 무게 대비 바나듐을 2% 담지하여 촉매를 제조하였으며, 결과를 그림 2에 나타내었다. 그림 2(a)는 상용되고 있는 W-TiO2를 400~700°C로 소성하였을 때 바나듐을 담지한 촉매의 탈질효율이며, 그림 2(b)는 TiO2를 우선적으로 500~700°C까지 소성하여 비표면적을 우선적으로 제어한 후 바나듐을 담지한 촉매의 탈질효율을 나타낸 그래프이다.
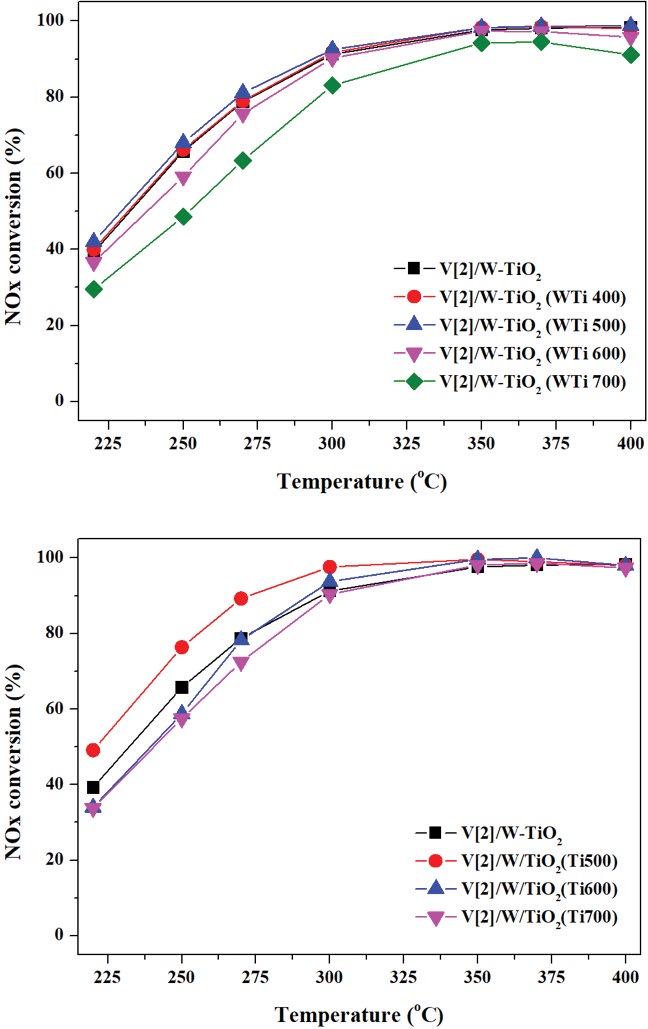
The effects of specific surface area over VOx/WO3-TiO2 catalysts on NH3-SCR reaction. (a) : V[2]/W-TiO2 (WTix00), (b) : V[2]/W/TiO2 (Tix00).
W-TiO2의 비표면적을 제어한 바나듐계 촉매의 탈질효율 결과를 나타낸 그림 2(a)를 살펴보면, 250°C를 기준으로 V[2]/W-TiO2 (WTi400) 및 V[2]/W-TiO2 (WTi500) 촉매의 탈질효율은 최대 68%로 약간 증가하는 경향을 보였으나, 기존 탈질효율인 65.75%와 큰 차이가 나타나지는 않았다. 또한 V[2]/W-TiO2 (WTi600) 및 V[2]/W-TiO2 (WTi700) 촉매의 탈질효율은 48.625%까지 감소하는 경향을 나타내었다. 그림 2(b)에서 TiO2를 우선적으로 제어하고 텅스텐을 담지한 촉매의 탈질효율을 확인한 결과 V[2]/W/TiO2 (Ti500)는 250°C에서 76.375%로 우수한 활성을 나타내었다. 그러나 V[2]/W/TiO2 (Ti600) 및 V[2]/W/TiO2 (Ti700) 촉매는 57.5%로 오히려 반응활성이 감소하는 것을 확인하였다. 따라서 그림 2의 결과를 토대로 바나듐의 함량이 일정할 때 지지체의 비표면적에 따라 탈질효율의 차이를 나타내는 것을 확인할 수 있었다. 이러한 결과는 지지체의 비표면적에 담지되는 바나듐의 표면밀도 차이에 의하여 나타날 수 있다. 따라서 바나듐이 담지되기 전 지지체의 비표면적에 따른 바나듐의 표면밀도를 식 (3)을 통하여 계산하였으며, 이에 대한 결과를 표 6에 나타내었다. 식 (3)에서 Cw는 촉매의 바나듐 농도 (g/g), NA는 아보가드로의 상수 (6.02×1023 mol-1), Mw는 바나듐 원자량 (50.94 gmol-1) 그리고 SBET는 바나듐을 담지하기 전 지지체의 비표면적 (m2/g)을 나타낸다.
| (3) |
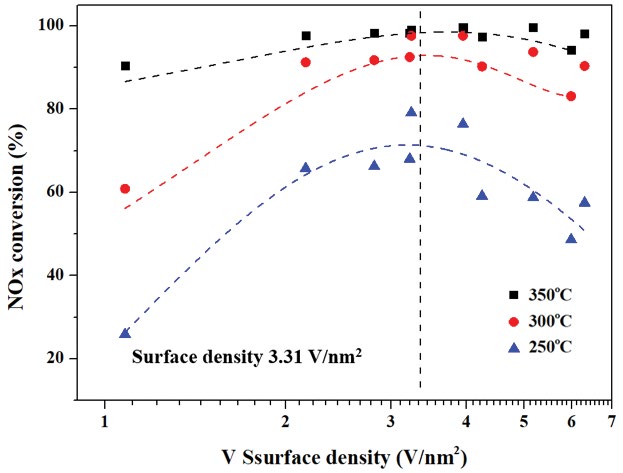
또한 그림 1과 그림 2에 사용된 촉매들의 바나듐 표면밀도와 탈질효율의 상관관계를 확인하기 위한 그래프를 그림 3에 나타내었다.
바나듐의 표면밀도를 계산한 표 6의 결과를 살펴보면, 비표면적이 일정한 상태에서 바나듐의 함량을 1~3%로 조절하였을 때 바나듐 표면밀도는 1.08 V/nm2에서 3.24 V/nm2로 증가하는 것을 확인할 수 있었다. 또한 W-TiO2 및 TiO2를 다양한 소성온도로 제조하여 바나듐을 담지한 경우 바나듐 표면밀도는 소성온도가 증가함에 따라서 증가하는 것을 확인하였다. 따라서 그림 3에서 바나듐의 표면밀도와 탈질효율의 상관관계를 확인하였다. 그 결과 바나듐의 표면밀도가 1.08 V/nm2에서 약 3.31 V/nm2까지 증가함에 따라 탈질효율은 증가하는 경향을 나타내었다. 그러나 바나듐의 표면밀도가 3.31 V/nm2에서 6.30 V/nm2으로 증가하는 경우 오히려 탈질효율이 감소하는 경향이 나타났다. 따라서 본 연구에서 사용된 V[y]/W-TiO2 (WTix00) 및 V[y]/W/ TiO2 (Tix00) 촉매의 최적 바나듐 표면밀도는 약 3.31 V/nm2으로 판단 된다.
3. 2 VOx/WO3-TiO2의 바나듐 표면밀도 최적화에 따른 구조적 특성 영향
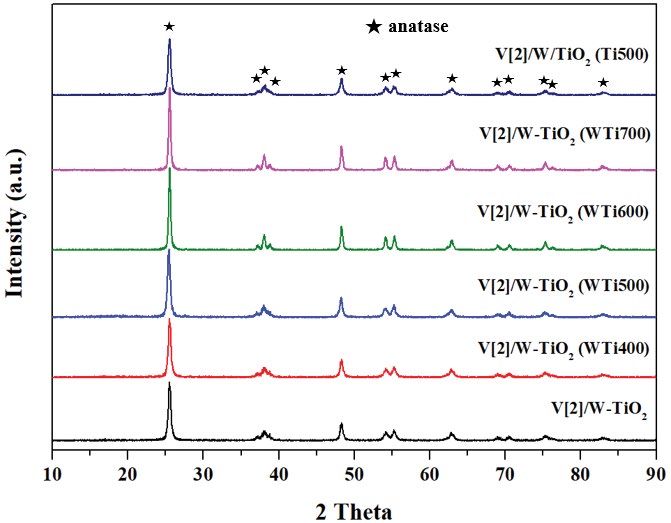
Kwon et al. (2015)은 VOx/TiO2 촉매의 바나듐 표면밀도에 따른 표면에 형성된 바나듐 종 (species)의 변화를 확인하였으며, UV-vis 분석을 통하여 확인하였을 때 바나듐이 낮은 표면 밀도를 갖을 때는 단량체 (monomeric) 바나듐이 주로 존재하고, 최적의 바나듐 표면밀도에 가까울수록 고분자 (polymeric) 바나듐이 주로 존재하며, 높은 표면밀도를 가질 때에는 주로 결정화된 (crystallite) 바나듐이 존재한다고 언급하였다. 따라서 본 절에서는 제조방법에 의한 바나듐 표면밀도 제어에 따른 촉매의 구조적인 변화를 XRD, Raman 분석을 통하여 확인하였으며, 바나듐의 구조와 탈질효율과의 관계를 확인하였다. 그림 4는 동일한 바나듐 함량을 담지했을 때 V[2]/W-TiO2 (WTix00) 및 V[2]/W/TiO2 (Ti500)의 촉매의 XRD 결과를 나타내었다.
Lee et al. (2012)에 따르면 TiO2는 700°C 이상의 온도에서 아나타제 (anatase)에서 루타일 (rutile)상으로 전환이 가능하다고 언급하였다. 또한 Kompio et al. (2012)에 따르면 결정화된 V2O5 및 WO3의 생성이 가능하다고 하였다. 그러나 그림 4의 결과를 확인해 본 결과 W/TiO2 (WTi700)는 700°C에서 소성되었음에도 불구하고 상 (phase) 변이는 관찰되지 않았으며, 결정화된 V2O5 및 WO3의 peak 또한 관찰되지 않았다. Vuurman et al. (1991)에 따르면 촉매 표면 바나듐의 구조는 Raman spectroscopy 분석을 이용하여 확인 가능하다고 하였다. 따라서 TiO2 표면에 분산된 바나듐 구조를 명확하게 확인하기 위하여 Raman spectroscopy 분석을 수행하였으며, 그림 5에 나타내었다.
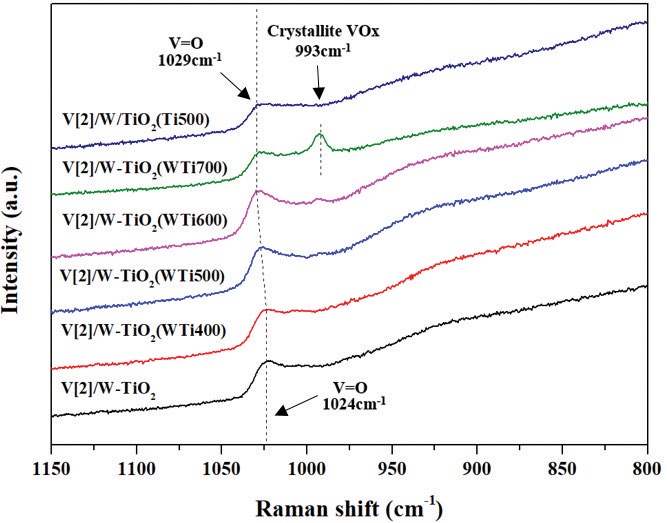
그림 5에서 바나듐 표면밀도의 차이를 나타내는 V[2]/W-TiO2 (WTix00) 및 V[2]/W/TiO2 (Ti500)의 Raman spectroscopy 분석 결과를 확인해 본 결과 V[2]/W-TiO2의 경우 1024 cm-1에서 피크를 나타내었으며, W-TiO2의 소성온도가 증가함에 따라 1029 cm-1 까지 이동하였다. 또한 V[2]/W/TiO2 (Ti500)의 피크는 1029 cm-1에서 관찰되었다. 992 cm-1에서 관찰되는 피크는 V[2]/W-TiO2 (WTi600) 촉매부터 생성되기 시작하였으며, V[2]/W-TiO2 (WTi700) 촉매는 해당 피크가 명확하게 확인되었다. Lai and Wachs (2018)은 바나듐계 촉매에서 텅스텐이 첨가됨에 따라 표면 V=O 밴드 (band)를 나타내는 피크가 1027 cm-1에서 1030 cm-1로 이동하는 것을 확인하였으며, 이러한 현상은 텅스텐이 첨가됨에 따라 단량체 바나듐이 고분자 바나듐으로 전환되는 현상에 의하여 발생하는 것으로 언급하였다. 또한 바나듐이 과량으로 담지되었을 때 994 cm-1에서 피크를 확인하였으며, 이는 바나듐의 결정화 (crystallite)에 따른 결과라고 언급하였다. 그림 5의 결과로 V=O 밴드를 나타내는 V[2]/W-TiO2 촉매의 1024 cm-1 피크가 소성온도가 증가함에 따라 1029 cm-1로 이동하는 이유는 줄어든 비표면적에 의하여 바나듐이 담지될 때 고분자 형태를 나타내기 때문에 발생하는 현상으로 판단된다. 또한 V[2]/W-TiO2 (WTi600)부터 993 cm-1에서 피크가 나타나는데, 이는 줄어드는 비표면적에 의해 바나듐이 고분자 형태로 존재할 수 있는 한계를 넘어서 결정화 (crystallite)되는 것으로 판단된다. 결정화된 바나듐 종은 촉매의 산화·환원 반응을 억제하여, SCR 효율을 감소시킬 수 있다[14]. 따라서 바나듐계 촉매 제조 시 바나듐을 담지하기 전 지지체의 비표면적은 바나듐의 구조 종에 영향을 미치며, 바나듐의 구조 종이 고분자 형태로 존재할 때 반응활성이 가장 우수하다는 것을 확인할 수 있었다.
3. 3 바나듐 표면밀도 최적화에 따른 석탄 화력발전 운전온도에서의 탈질효율 영향
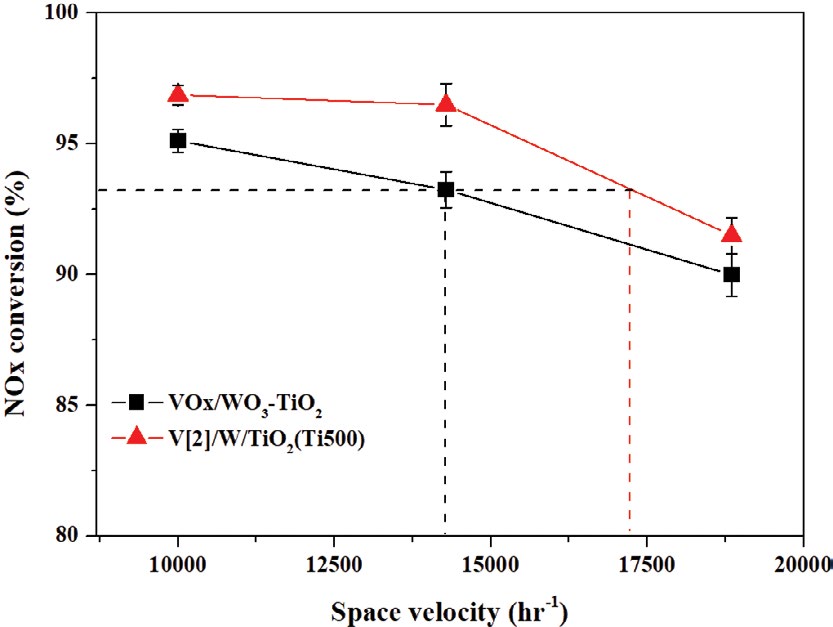
실제 석탄 화력발전소에서 상용되는 VOx/WO3-TiO2 촉매는 350~370°C 사이에서 운전되고 있다. 따라서 운전온도에서 제조방법이 최적화된 촉매와 상용촉매의 탈질효율을 비교하기 위한 실험이 필요하다. 파우더 형태의 촉매 실험은 350°C 이상에서 물질전달속도가 높기 때문에 탈질효율을 비교하는 데 있어서 어려움이 있으며, 공간속도를 높이는 방법에도 한계가 있다. 그러나 낮은 cpsi를 갖는 허니컴에 촉매를 코팅하여 실험하는 경우 이러한 반응활성의 차이를 확인할 수 있다. 그림 6은 370°C에서 제조방법이 최적화된 촉매 (V[2]/W/TiO2 (Ti500))와 바나듐 및 텅스텐이 동일 함량으로 담지되어 있는 SCR 상용촉매 (VOx/WO3-TiO2)를 35 cpsi 허니컴에 100 g/L만큼 코팅하여 공간속도에 따른 탈질효율을 나타낸 그래프이다.
그림 6의 결과 상용촉매의 경우 공간속도 10,000 h-1에서 95.125%의 탈질효율을 나타내었으며, 공간속도가 증가함에 따라 탈질효율은 감소하여 18,850 h-1에서 90%의 탈질효율을 나타내었다. 반면에 촉매제조 최적화 촉매의 경우 공간속도 10,000 h-1에서 96.875%를 나타내었으며, 18,850 h-1에서 91.5%로 탈질효율이 증가하는 것을 확인하였다. 또한 공간속도 14,285 h-1에서 상용촉매의 탈질효율 (93.3%)을 기준으로 제조방법이 최적화된 촉매가 동일한 활성을 갖는 공간속도는 대략 17,210 h-1에서 나타내는 것을 확인할 수 있었다. 이러한 결과를 바탕으로 V[2]/W/TiO2 (Ti500) 촉매는 고분자 바나듐 종으로 존재하여 가장 우수한 탈질효율을 나타내며, 이러한 바나듐의 구조는 촉매제조 시 지지체의 비표면적 제어를 통하여 조절 가능하다는 것을 확인하였다.
4. 결 론
본 연구에서는 실제 석탄 화력발전소에서 상용 중인 V2O5/WO3-TiO2 촉매의 제조방법 최적화 연구를 수행하였다. 촉매의 최적화는 지지체의 비표면적 제어를 통하여 바나듐의 표면밀도를 제어하였으며, 이에 따른 탈질효율을 확인하여 최적의 바나듐 표면밀도를 확인하였다. 또한 석탄 화력발전소 운전온도에서 최적의 탈질효율을 갖는 촉매와 상용촉매를 비교하여 경제적인 효과를 확인하였다. 위의 결과는 다음과 같다.
1. V[2]/W-TiO2 (WTix00) 및 V[2]/W/TiO2 (Tix00) 촉매의 바나듐 표면밀도에 따른 탈질효율 영향을 확인해 본 결과 약 3.31 V/nm2에서 최적의 바나듐 표면밀도를 나타내었으며, 이때 바나듐의 구조는 고분자 (polymeric) 바나듐 종으로 존재하는 것을 확인하였다.
2. 석탄 화력발전소 운전온도에서 상용촉매와 제조방법 최적화 촉매의 탈질효율을 동일 공간속도에서 비교한 결과 제조방법 최적화 촉매의 활성이 상용촉매에 비하여 반응활성이 증진되었다. 이러한 결과는 두 촉매가 93.3%의 탈질효율을 갖는 공간속도 (hr-1)에서의 허니컴 코팅촉매 부피 기준으로 기존 상용촉매에 비하여 약 17%만큼의 부피 절감을 통한 경제적인 효과를 얻을 수 있을 것으로 판단된다.
Acknowledgments
본 연구는 산업통상자원부 (MOTIE)와 한국에너지기술평가원 (KETEP)의 지원을 받아 수행한 연구 과제입니다 (No. 20181110200060).
References
-
Carrero, C.-A., Keturakis, C.-J., Orrego, A., Schomacker, R., Wachs, I.-E., (2013) Anomalous reactivity of supported V2O5 nanoparticles for propane oxidative dehydrogenation: influence of the vanadium oxide precursor, Dalton Transactions, 42(35), 12644-12653.
[https://doi.org/10.1039/c3dt50611h]

- Cho, S.-M. (1994) Properly apply selective catalytic reduction for NOX removal, Chemical Engineering Progress, 90(1), 39-45.
-
Forzatti, P. (2001) Present status and perspectives in de-NOX SCR catalysis, Applied Catalysis A: General, 222(1-2), 221-236.
[https://doi.org/10.1016/S0926-860X(01)00832-8]

-
Kompio, P.G.W.-A., Bruckner, A., Hipler, F., Auer, G., Loffler, E., Grunert, W. (2012) A new view on the relations between tungsten and vanadium in V2O5-WO3/TiO2 catalysts for the selective reduction of NO with NH3, Journal of Catalysis, 286, 237-247.
[https://doi.org/10.1016/j.jcat.2011.11.008]

-
Kwon, D.-W., Park, K.-H., Hong, S.-C. (2015) Influence of VOx surface density and vanadyl species on the selective catalytic reduction of NO by NH3 over VOx/TiO2 for superior catalytic activity, Applied Catalysis A: General, 499(25), 1-12.
[https://doi.org/10.1016/j.apcata.2015.04.005]

-
Lai, J.K., Wachs, I.E. (2018) A perspective on the selective catalytic reduction (SCR) of NO with NH3 by supported V2O5-WO3/TiO2 catalysts, ACS Catalysis, 8(7), 6537-6551.
[https://doi.org/10.1021/acscatal.8b01357]

-
Lee, S.-M., Park, K.-H., Kim, S.-S., Kwon, D.-W. Hong, S.-C. (2012) Effect of the Mn oxidation state and lattice oxygen in Mn-based TiO2 catalysts on the low-temperature selective catalytic redcution of NO by NH3, Journal of Air Waste Management Association, 62(9), 1085-1092.
[https://doi.org/10.1080/10962247.2012.696532]

-
Metkar, P.-S., Harold, P., Balakotaiah, V. (2012) Selective catalytic reduction of NOX on combined Fe- and Cu-zeolite monolithic catalysts: Sequential and dual layer configurations, Applied Catalysis B: Environmental, 111-112, 67-80.
[https://doi.org/10.1016/j.apcatb.2011.09.019]

-
Nova, I., dall’Acqua, L., Lietti, Li., Giamello, E., Forzatti, P. (2001) Study of thermal deactivation of a deNOX commercial catalyst, Applied Catalysis B: Environmental, 35(1), 31-42.
[https://doi.org/10.1016/S0926-3373(01)00229-6]

-
Peng, Y., Wang, C., Li, J. (2014) Structure-activity relationship of VOx/CeO2 nanorod for NO removal with ammonia, Applied Catalysis B: Environmental, 144, 538-546.
[https://doi.org/10.1016/j.apcatb.2013.07.059]

-
Qi, G., Yang, R.-T. (2003) Performance and kinetics study for low-temperature SCR of NO with NH3 over MnOXCeO2 catalyst, Journal of Catalysis. 217(2), 434-441.
[https://doi.org/10.1016/S0021-9517(03)00081-2]

-
Tian, H., Ross, E.-I., Wachs, I.-E. (2006) Quantitative determination of the speciation of surface vanadium oxides and their catalytic activity, The Journal of Physical Chemistry B, 110(19), 9593-9600.
[https://doi.org/10.1021/jp055767y]

-
Tang, F., Zhuang, K., Yang, F., Yang, L., Xu, B., Qiu, J., Fan, Y. (2012) Effect of dispersion state and surface properties of supported vanadia on the activity of V2O5/TiO2 catalysts for the selective catalytic reduction of NO by NH3, Chinese Journal of Catalysis, 33(4-6), 933-940.
[https://doi.org/10.1016/S1872-2067(11)60365-3]

-
Vuurman, M.-A., Wachs, I.-E., Hirt, A.-M. (1991) Structural determination of supported V2O5-WO3/TiO2 catalysts by in situ Raman spectroscopy and X-ray photoelectron spectroscopy. The Journal of Physical Chemistry, 95(24), 9928-9937.
[https://doi.org/10.1021/j100177a059]

-
Won, J.-M., Kim, M.-S., Hong, S.-C. (2018) Effect of vanadium surface density and structure in VOx/TiO2 on selective catalytic reduction by NH3, Korean Journal of Chemical Engineering, 35(12), 2365-2378.
[https://doi.org/10.1007/s11814-018-0158-x]

-
Wu, Z., Schwartz, V., Li, M., Rondinone, A.-J., Overbury, S.-H. (2012) Support shape effect in metal oxide catalysis: Ceria-nanoshapesupported vanadia catalysts for oxidative dehydrogenation of isobutane, The Journal of Physical Chemistry Letters, 3(11), 1517-1522.
[https://doi.org/10.1021/jz300513u]

-
Yuanyuan, H., Michael, E.-F., Minghui, Z., Qingcai, L., Uma, T., Zili, W., Israel, E.-W. (2016) Influence of catalyst synthesis method on selective catalytic reduction (SCR) of NO by NH3 with V2O5-WO3/TiO2 catalysts, Applied Catalysis B: Environmental, 193(15), 141-150.
[https://doi.org/10.1016/j.apcatb.2016.04.022]

신중훈 (경기대학교 일반대학원 박사과정)
최경륜 (경기대학교 일반대학원 석사과정)
홍성창 (경기대학교 환경에너지 공학과 교수)