배기가스 조성에 따른 활성탄의 수은 흡착 특성
Copyright © 2019 Korean Society for Atmospheric Environment
Abstract
Activated carbon injection upstream of a particulate matter control device is a widely applied method for the control of mercury emission from the coal-fired plant and waste incinerator. Performance of activated carbon in mercury control depends on various factors such as flue gas composition, physical and chemical properties of fly ash and activated carbon, etc. This study was designed to investigate the effect of flue gas composition on the mercury adsorption efficiency of activated carbon. Commercial activated carbon was obtained, and a fixed-bed reactor system was used for the tests of its mercury adsorption at various simulated flue gas conditions. A baseline gas consists of 12% carbon dioxide (CO2), 5% oxygen (O2), 7% water vapor (H2O), 60∼70 μg mercury (Hg)/m3 and balance nitrogen (N2). Each of acidic gases such as sulfur dioxide (SO2), nitrogen monoxide (NO) and hydrogen chloride (HCl) was added to the baseline gas and injected for the test to investigate the effect of each acidic gas on the mercury adsorption efficiency of activated carbon. In addition, the mercury adsorption efficiency of activated carbon was examined at the conditions of simulated flue gas (1) before air pollution control (2) after desulfurization and (3) after nitrogen oxides (NOx) control.
Keywords:
Mercury, Adsorption, Activated carbon, Flue gas1. 서 론
전 세계 인위적 수은 배출원에서 발생하는 수은은 2015년 기준 2220톤이고, 그 중 석탄 연소로 인한 발생량은 전체의 24%에 이른다 (UNEP, 2018). 석탄에 함유된 수은은 석탄의 연소 과정에서 기화한다. 연소 영역의 높은 온도에서는 원소수은 (Hg0)의 형태로 존재하지만, 연소 가스의 온도가 낮아지면서 산화수은 (Hg2+)으로 전환되거나, 비산재에 흡착되어 입자수은 (Hgp)으로 전환될 수 있다. 입자수은은 집진설비에서 대부분 포집되지만, 산화수은은 집진설비와 탈황설비에서 일부만이 포집되고, 원소수은은 기존의 대기방지설비에서 거의 포집되지 않는다 (Park and Lee, 2018; Zhang et al., 2016; Min et al., 2015). 따라서 집진설비 이전에 흡착제를 분사하여 수은을 제거하는 방법이 널리 사용되고 있다 (Sjostrom et al., 2010; Carey et al., 1998).
수은 제거용 흡착제로 보편적으로 사용되는 물질은 활성탄이다 (De et al., 2013). 활성탄의 수은 흡착특성에 대해서는 많은 연구가 수행되고 있다. 그중에서 배기가스의 조성이 활성탄의 수은 흡착효율에 미치는 영향에 대하여 많은 연구가 이루어졌으며 그 결과를 요약하면 다음과 같다. 질소 (nitrogen, N2) 배경가스에 산소 (oxygen, O2)를 추가 주입하는 경우, 활성탄의 수은 흡착효율이 크게 증가하는 결과를 보였다 (Diamantopoulou et al., 2010; Yan et al., 2003). 이산화탄소 (carbon dioxide, CO2) 70%와 질소의 조성에서도 산소 6%가 추가된 경우에는 초기 흡착효율이 8%에서 39%로 증가하였다 (Li et al., 2017). 그러나 이 결과들은 산소가 활성탄의 수은 흡착성능에 미치는 영향을 알아보기 위한 연구적인 목적일 뿐, 산소가 대략 3∼10%의 범위에서 존재하는 실제 배기가스에 적용할 수 있는 연구 결과는 아니다.
다음으로는 일산화질소 (nitrogen monoxide, NO)와 이산화질소 (nitrogen dioxide, NO2)의 영향을 조사한 연구들이 있다. 일산화질소와 이산화질소는 활성탄의 수은흡착효율을 증가시키는 역할을 하는 반면에, 이산화황 (sulfur dioxide, SO2)을 함께 추가하면 활성탄의 초기 흡착효율이 감소하는 결과를 나타내었다 (Li et al., 2017; Miller et al., 2000). 염화수소의 영향을 조사한 연구 결과에서는 질소가스에 염화수소 50 ppm을 추가 주입하면 초기 수은 흡착효율이 10%에서 90%까지 증가하였다 (Diamantopoulou et al., 2010). 또한, 이산화탄소 10%, 산소 5%, 수증기 16%, 이산화황 500 ppm, 질소 조성에서는 수은 흡착효율이 0∼20%인 반면, 염화수소를 1 ppm 정도만 추가해도 수은 흡착효율이 60~80%로 크게 증가했다 (Ochiai et al., 2009).
기존의 연구 결과들을 통해 배기가스를 구성하는 각 가스 성분이 활성탄의 수은 흡착효율에 큰 영향을 미침을 알 수 있다. 특히 이산화황 (sulfur dioxide, SO2), 일산화질소 (nitrogen monoxide, NO), 염화수소 (hydrogen chloride, HCl) 등의 산성가스 성분이 활성탄의 수은 흡착성능에 큰 영향을 주는 것으로 나타났다. 그러나 배기가스 조성의 영향은 활성탄의 물리화학적 특성에 따라서도 다르게 나타나므로, 배기가스 각 성분의 영향을 일반화하기는 여전히 어렵다. 또한 기존의 연구들은 배기가스 각 성분의 영향을 조사하기 위하여 주입한 모사가스의 조성이 실제 연소 배기가스의 조성과는 거리가 먼 경우가 많아, 논문의 결과를 실제 현장에 적용하는 데 어려움이 있다.
따라서 본 연구에서는 대기방지설비 적용 전후의 배기가스 조성 범위에서 활성탄의 수은 흡착효율을 조사하였다. 또한 흡착 진행시간에 따라 구분하여 수은 종분석을 실시함으로써, 배기가스의 조성이 흡착시간에 따라 미치는 영향도 함께 조사하였다.
2. 실험장치 및 방법
2. 1 시료
본 연구에서 사용한 흡착제는 수은 흡착용으로 판매되고 있는 활성탄 (GL-50, Norit, USA)이다. 비표면적 분석기 (BELSORP-mini, BEL Japan, Inc., Japan)를 사용하여 이 활성탄의 BET (Brunauer-Emmett-Teller) 비표면적 및 기공부피를 표 1과 같이 측정하였다. 이 활성탄 시료 0.03 g을 실리카 6 g과 혼합하여 수은 흡착실험을 수행하였다. 실리카는 이전 연구로부터 반응온도에서 수은과의 반응성이 없음을 확인하였다 (Park and Lee, 2018; Min et al., 2017; Min et al., 2015). 활성탄 시료와 실리카의 양은 고정층 흡착공정의 파과곡선이 구현될 수 있으면서 활성탄 시료를 최소화할 수 있는 양으로 예비실험을 통해 결정하였다.
2. 2 실험장치
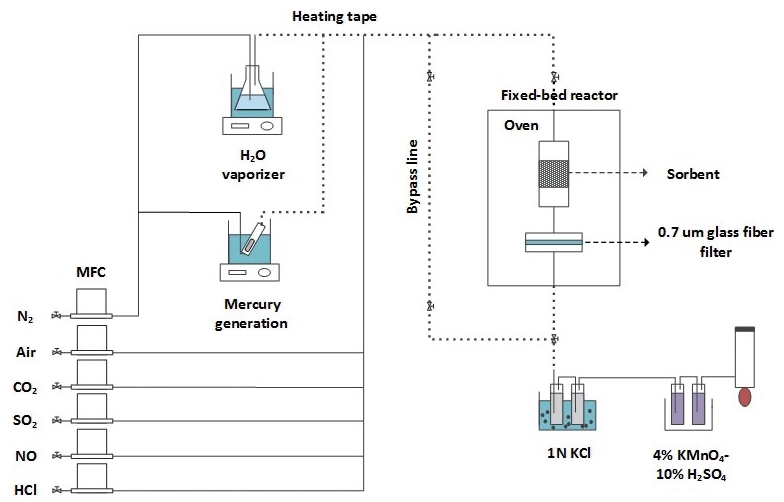
수은 흡착실험을 위한 장치는 그림 1과 같다. 모사가스를 주입할 때 각 실린더의 가스 유량은 질량유량조절기 (mass flow controller, Model 5850E, Brooks Instrument, USA)를 사용하여 조절하였다. 수증기는 일정 온도의 수조에 들어있는 플라스크 안의 증류수에 질소 가스를 흘려주어 주입하였다. 수증기가 응축되는 것을 방지하기 위하여 가스가 흐르는 관에 열 테이프 (heat tape)를 감아주었다. 원소수은은 일정 온도의 수조에 들어있는 컬럼 안의 수은 튜브 (dynamical permeation tube, VICI Metronics, USA)에 질소 가스를 흘려주어 주입하였다. 직경 1.27 cm인 고정층 반응기는 강제순환오븐 (forced convection oven, OF-22GW, Jeio Tech, Korea) 안에 넣어 140°C 온도를 일정하게 유지하였다. 140°C의 흡착온도는 석탄 화력발전소나 폐기물 소각로 집진설비의 온도를 모사하였으며, 모사가스의 조성 또한 석탄 화력발전소와 폐기물 소각로의 배기가스 조성 범위로 구성하였다. 흡착 후 배출되는 가스는 온타리오 하이드로법 (Ontario Hydro Method)을 적용하여 수은에 대한 종분석을 실시하였다. 온타리오 하이드로법은 산화수은과 원소수은을 분리하여 각 농도를 결정할 수 있는 습식 분석법으로, 배출가스 중 산화수은과 원소수은을 액상으로 포집하여 각각의 농도를 결정하였다.
2. 3 실험방법
본 연구의 목적은 배기가스 조성에 따른 활성탄의 수은 흡착특성을 조사하는 것으로 표 2와 같이 다양한 조성의 모사가스를 구성하여 활성탄에 주입하였다. CO2 12%, O2 5%, H2O 7%, Hg 60∼70 μg/m3, N2 balance를 기본 가스조건 (baseline gas condition)으로 하고, 여기에 SO2, NO, HCl을 추가로 주입하여 모사가스를 구성하였다. 연료가 연소한 직후의 배기가스 조성을 SO2 500 ppm, NO 200 ppm, HCl 20 ppm으로 가정하였고, 대기방지설비에서 90% 저감하였음을 가정하여 SO2 50 ppm, NO 20 ppm, HCl 2 ppm을 선택적으로 주입하는 모사가스도 구성하였다.
표 1에 나타나 있는 활성탄 시료 0.03 g을 실리카 6 g과 혼합한 후 고정층 반응기에 위치시켰다. 고정층 반응기는 강제순환오븐 안에 넣어 140°C 반응온도를 일정하게 유지하였다. 오븐의 온도를 승온하는 동안, 모사가스를 우회라인 (bypass line)으로 흘려준 후 4% 과망간산칼륨 (KMnO4)/10% 황산 (H2SO4)에 흡수하여 유입되는 수은의 농도가 60∼70 μg/m3 범위로 흐르고 있는지 확인하였다. 이후에 모사가스를 고정층 반응기로 주입하여 수은 흡착실험을 시작하였다. 수은흡착실험 동안 배출되는 수은에 대해서는 온타리오 하이드로법으로 종분석을 실시하였다. 흡착 후 배출되는 산화수은은 그림 1과 같이 1 N 염화칼륨 (KCl) 수용액에 포집되었고, 원소수은은 4% 과망간산칼륨-10% 황산수용액에 포집되었다. 각 수용액에 포집된 수은의 양은 액상 수은분석기 (RA-3, Nippon Instruments Corporation, Japan)를 이용하여 결정한 후, 배출가스 중 산화수은농도 ([Hg2+]out)와 원소수은농도 ([Hg0]out)를 각각 구하였다. 수은 흡착실험은 대부분의 모사가스 조건에서 일정한 수은 흡착효율에 도달하는 40분간 진행되었다. 수은 흡착실험을 마친 후에는 다시 모사가스를 우회라인으로 흘려준 후 4% 과망간산칼륨-10% 황산수용액에 흡수하여 유입 수은농도를 결정하였다. 수은 흡착실험 동안의 유입 원소수은농도 ([Hg0]in)는 수은 흡착실험 전후로 측정한 유입 수은농도의 평균값과 동일하다고 가정하였다. 각 조건에서 결정되는 유입 원소수은농도, 배출 산화수은농도, 배출 원소수은농도로부터 수은 흡착효율을 결정하였다.
| (1) |
활성탄에서 산화만 되고, 흡착은 되지 않은 채 배출되는 산화수은의 농도 변화를 조사하는 것도 본 연구의 수행 목적 중 하나였으나, 본 연구에서 수행한 모든 실험결과에서 매우 적은 농도의 산화수은만이 배출되는 것으로 나타났다. 각 조건에서 수은 흡착실험 시간은 총 40분이고, 시간에 따른 수은 흡착효율의 변화를 조사하기 위하여, 5분, 5분, 10분, 10분, 10분 간격으로 임핀져 수용액을 새 것으로 교체하였다. 수은 흡착실험 초기에 배출가스 포집 시간이 짧은 이유는 그 시점에 수은 흡착효율의 변화가 상대적으로 크기 때문이다. 각 실험조건에서 최소 2회 반복 실험을 수행하였고, 결과의 표준편차가 큰 경우에는 추가 실험을 수행하였다.
3. 결과 및 고찰
3. 1 산성가스 농도에 따른 수은 흡착효율
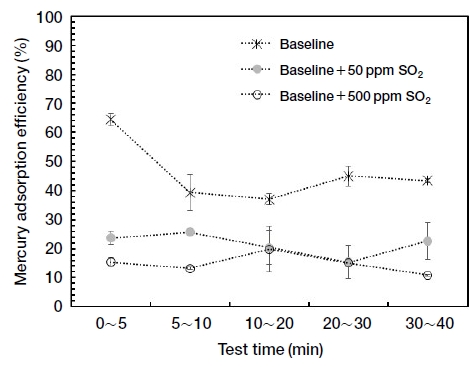
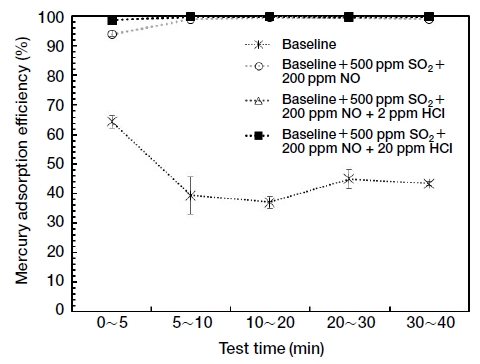
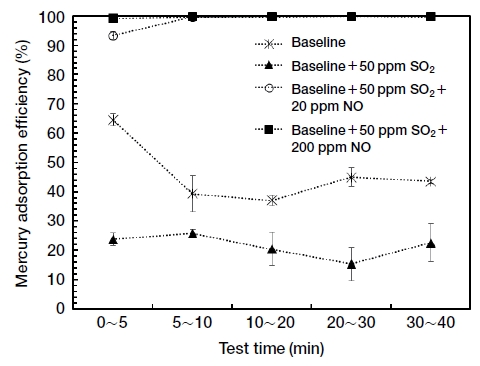
먼저 각 산성가스가 활성탄의 수은 흡착효율에 미치는 영향을 조사하기 위하여 기본 가스조건에 SO2, NO, HCl을 각각 추가하여 실험을 수행하였다. 그림 2는 기본 가스조건에 SO2 50 ppm, SO2 500 ppm을 각각 추가로 주입하였을 때, 흡착시간에 따른 수은 흡착효율을 나타내고 있다. 각 조건에서 실험은 2회 이상 반복 실험하였으며, 각 흡착시간 구간에서 수은 흡착효율의 평균과 표준오차를 보여주고 있다. 그림에서 보는 바와 같이 SO2를 기본 가스조건에 추가로 주입하면 활성탄의 수은 흡착능력이 저하되었는데, SO2 50 ppm을 주입하였을 때는 대략 절반 수준으로 수은 흡착효율이 감소하였고, SO2 500 ppm을 주입하였을 때는 이보다도 낮은 수은 흡착효율을 보였다. 수은 흡착 초기부터 낮은 수은 흡착효율을 보이고, 이것이 지속적으로 유지되는 것으로 보아, SO2 주입에 따른 활성탄의 수은 흡착효율 감소 효과는 즉각적으로 나타나는 것으로 판단된다.
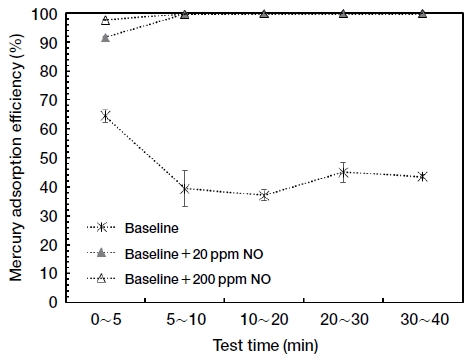
다음은 NO의 영향을 조사하기 위하여 기본 가스조건에 NO 20 ppm, NO 200 ppm을 각각 주입하였다. 그림 3의 결과에서 보는 바와 같이 NO를 주입함에 따라 수은 흡착효율이 급격히 증가하였다. 또한 NO 20 ppm을 주입한 경우와 NO 200 ppm을 주입한 경우 모두 수은 흡착 초기인 5분 이내에는 다른 흡착시간에 비하여 상대적으로 낮은 수은 흡착효율을 보여 NO가 활성탄의 수은 흡착효율을 향상시키기 위해서는 일정 시간이 필요한 것으로 판단된다. 그리고 NO 20 ppm을 주입하였을 때, 초기 수은 흡착효율이 91%였던 반면에 NO 200 ppm을 주입하였을 때에는 97%로 증가하여, NO의 농도가 높을수록 활성탄의 수은 흡착효율이 빠르게 증가하는 것으로 나타났다.
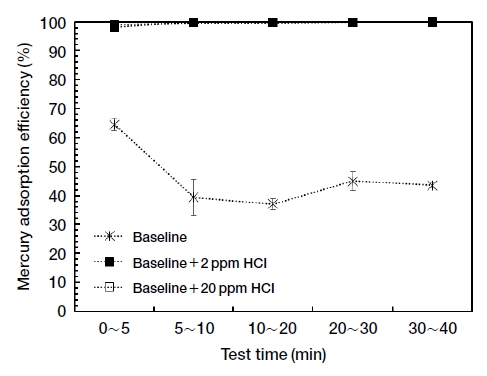
그림 4는 HCl을 추가로 주입하였을 때, 시간에 따른 수은 흡착효율의 변화를 기본 가스조건과 비교하여 나타내었다. 그림에서 NO와 마찬가지로 HCl도 활성탄의 수은 흡착효율을 급격히 향상시키는 것을 볼 수 있다. 또한 HCl은 2 ppm의 농도에서도 NO 200 ppm을 주입하였을 때 수준의 수은 흡착효율을 보였다. 따라서 HCl은 매우 저농도에서도 활성탄의 수은 흡착효율을 급격히 향상시킴을 알 수 있다.
3. 2 배기가스 조성에 따른 수은 흡착효율
3.1 절에서는 SO2, NO, HCl 각각의 가스가 활성탄의 수은 흡착효율에 미치는 영향을 살펴보았다. 이 단원에서는 석탄 화력발전소와 폐기물 소각로 실공정의 배기가스 조성 범위에서 활성탄의 수은 흡착효율을 살펴보고자 한다. 먼저 대기방지설비에 도달하기 전 연소가스의 조성일 때 시간에 따른 수은 흡착효율을 조사하였다. 이는 실공정에서 집진설비가 첫 번째 대기방지설비로 설치되어 있을 때, 집진설비 이전에 활성탄을 분사하는 경우를 모사한다. 연료 또는 폐기물의 연소과정에서 SO2 500 ppm, NO 200 ppm이 발생하였다고 가정하였고, 연료의 염소 (Cl) 함량에 따라 변하는 HCl 농도의 영향을 조사하였다.
그림 5에서 보는 바와 같이 HCl이 존재하지 않는 상태에서 SO2 500 ppm, NO 200 ppm의 조건에서도 높은 수은 흡착효율을 보여주고 있다. 이는 앞서 단원에서 SO2는 활성탄의 수은 흡착효율을 감소시키고, NO는 활성탄의 수은 흡착효율을 향상시키는 역할을 하였지만, 동시에 주입하였을 때에는 수은 흡착효율을 향상시키는 역할이 더 큰 것으로 나타났다. 다만, 그림 3에서 SO2를 주입하지 않고, NO 200 ppm만을 주입한 경우보다는 흡착 초기에 조금 낮은 효율을 나타내었다. 그리고 연소가스 조성에 HCl을 2 ppm, 20 ppm 주입한 경우는 모두 매우 높은 수은 흡착효율을 보여, 연소가스 조성에서도 HCl의 농도의 영향이 매우 큼을 보여준다.
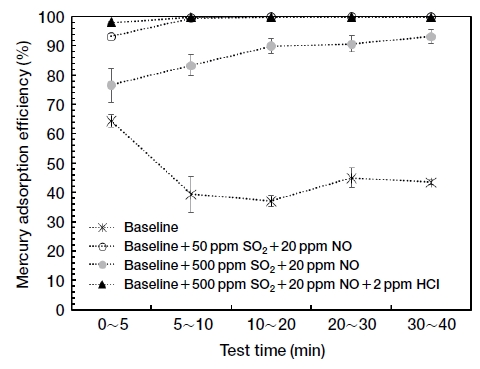
배기가스 탈황이 이루어진 후의 조성에서 활성탄의 수은 흡착효율을 조사하였다. 집진설비 이전에 탈황이 이루어지는 폐기물 소각로의 경우에는 SO2의 농도가 낮은 조건에서 수은 흡착이 이루어진다. 탈황 후의 SO2 농도를 50 ppm으로 가정하고, NO의 농도에 따른 수은 흡착효율을 그림 6에 나타내었다. 탈황설비에서는 HCl 가스도 함께 제거되므로, HCl은 주입하지 않는 조건으로 구성하였다. 기본 가스조건에 SO2 50 ppm만 추가할 경우는 수은 흡착효율이 20% 수준으로 감소하지만, NO 20 ppm만 존재하여도 활성탄의 수은 흡착효율이 크게 증가하였다. 그리고 NO 200 ppm을 주입하면 초기 흡착효율도 99%까지 증가하는 것으로 나타났다. 따라서 탈황과 탈질이 모두 이루어졌을 때보다 탈황만 이루어졌을 때 활성탄의 수은 흡착효율은 더 높을 것으로 예상된다.
배기가스 탈질이 이루어진 후의 조성에서 활성탄의 수은 흡착효율을 조사하였다. 석탄 화력발전소에서 집진설비 이전에 선택적 촉매환원 (SCR) 설비가 설치되어 있는 경우, 폐기물 소각로에서 집진설비 이전에 선택적 비촉매환원 (SNCR) 설비가 설치되어 있는 경우 등이 이에 해당된다. 탈질이 이루어진 후의 NO 농도를 20 ppm으로 가정하였고, 탈황도 함께 이루어진 후의 조건으로 NO 20 ppm, SO2 50 ppm을 함께 주입하였다. 탈황은 이루어지지 않고, 탈질만 이루어진 경우로 SO2 500 ppm이 존재하는 경우와 SO2 500 ppm과 HCl 2 ppm이 함께 존재하는 경우를 구성하였다. 그림 7에서 보는 바와 같이 NO 20 ppm, SO2 50 ppm이 존재하는 경우는 높은 수은 흡착효율을 보이지만, NO 20 ppm, SO2 500 ppm이 존재하는 경우에는 SO2에 따른 활성탄의 수은 흡착효율 감소효과가 크게 작용하여 낮은 수은 흡착효율을 보였다. 그러나 NO 20 ppm, SO2 500 ppm이 존재하는 경우라도 HCl 2 ppm이 함께 존재하면, 수은 흡착효율은 NO 20 ppm, SO2 50 ppm이 존재하는 경우보다도 증가하는 것으로 나타났다. 이를 통하여 활성탄의 수은 흡착효율 향상에는 배기가스 중 HCl 가스의 영향이 매우 큼을 알 수 있다.
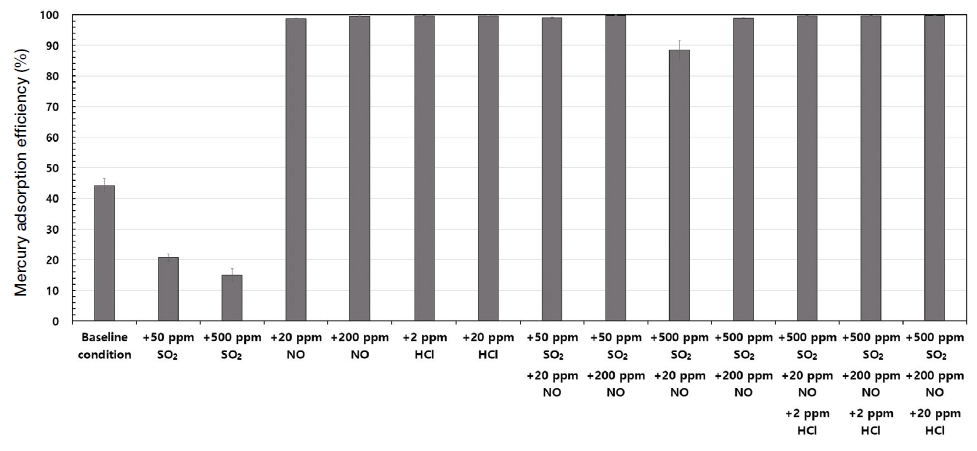
각 배기가스 조건에서 40분 동안의 수은 흡착효율을 평균하여 그림 8과 같이 나타내었다. 기존 문헌의 연구결과와 같이 산성가스 성분이 활성탄의 수은 흡착성능에 큰 영향을 주었다. NO와 HCl은 활성탄의 수은 흡착효율을 향상시켰고, SO2는 활성탄의 수은 흡착효율을 대체로 감소시키는 역할을 하였다. 그러나 그림 8에서 보는 바와 같이 SO2가 NO 또는 HCl과 함께 존재하는 경우에는 대체적으로 높은 수은 흡착효율을 나타내었다. 다만, NO 20 ppm, SO2 500 ppm의 예처럼 다른 산성가스에 비하여 SO2 농도가 월등히 높은 경우에 대해서는 눈에 띄는 수은 흡착효율 감소가 발견되었다. 이는 대기방지설비의 배열에서 탈황설비가 마지막에 위치하는 경우 연료의 염소 함량이 낮을 때, 활성탄의 수은 흡착효율이 감소될 수 있음을 나타낸다.
4. 결 론
석탄 화력발전소와 폐기물 소각로 실공정의 배기가스 조성 범위에서 활성탄의 수은 흡착특성을 조사하기 위하여 고정층 반응기에서 수은 흡착실험을 수행하였다. CO2 12%, O2 5%, H2O 7%, Hg 60∼70 μg/m3, N2 balance로 구성된 기본 가스조건에 SO2, NO, HCl 중 하나의 산성가스를 추가로 주입한 결과 SO2는 활성탄의 수은 흡착효율을 크게 감소시켰고, NO와 HCl은 크게 증가시켰다. HCl은 2 ppm의 낮은 농도를 주입하여도 NO 200 ppm을 주입하였을 때 수준의 수은 흡착효율을 나타내었다. 각 산성가스의 영향에 이어 실공정의 배기가스 조성 범위에서 활성탄의 수은 흡착효율을 조사하였다. 먼저 대기방지설비에서 제거되기 전의 배기가스 조성을 모사하는 조건에서는 SO2에 의한 활성탄의 수은 흡착효율 감소 효과보다 NO와 HCl에 의한 활성탄의 수은 흡착효율 향상 효과가 훨씬 크게 나타났다. 특히 이 조건에서도 HCl은 흡착 초기를 포함하여 활성탄의 수은 흡착효율 향상에 큰 역할을 하였다. 그리고 탈황 이후의 배기가스 조성을 모사하는 조건에서는 낮은 SO2 농도로 인하여 HCl이 존재하지 않아도 높은 수은 흡착효율을 나타내었다. 다만, 탈황과 함께 탈질까지 이루어진 경우는 활성탄의 수은 흡착효율이 초기에 특히 감소하는 것으로 나타났다. 탈질 이후의 배기가스 조성을 모사하는 조건에서는 탈황이 되지 않았을 경우 높은 SO2 농도로 인한 수은 흡착효율 감소효과가 크게 작용하였다. 따라서 활성탄의 수은 흡착효율을 예측하기 위해서는 배기가스 조성에 대한 사전 분석이 이루어져야 하겠다.
Acknowledgments
이 성과는 정부 (과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구임 (NRF-2018R1D1A1A09083083).
References
-
Carey, T.R., Hargrove, O.W.Jr., Richardson, C.F., Chang, R. (1998) Factors affecting mercury control in utility flue gas using activated carbon, Journal of the Air & Waste Management Association, 48(12), 1166-1174.
[https://doi.org/10.1080/10473289.1998.10463753]

-
De, M., Azargohar, R., Dalai, A.K., Shewchuk, S.R. (2013) Mercury removal by bio-char based modified activated carbons, Fuel, 103, 570-578.
[https://doi.org/10.1016/j.fuel.2012.08.011]

-
Diamantopoulou, I., Skodras, G., Sakellaropoulos, G.P. (2010) Sorption of mercury by activated carbon in the presence of flue gas components, Fuel Processing Technology, 91(2), 158-163.
[https://doi.org/10.1016/j.fuproc.2009.09.005]

-
Li, X., Huang, Q., Luo, C., Zhou, D., Xu, Y., Zhang, L., Zheng, C. (2017) Effect of acid gases on elemental mercury removal in an oxy-fuel CO2 compression process, Energy & Fuels, 32(4), 4334-4340.
[https://doi.org/10.1021/acs.energyfuels.7b03105]

-
Miller, S.J., Dunham, G.E., Olson, E.S., Brown, T.D. (2000) Flue gas effects on a carbon-based mercury sorbent, Fuel Processing Technology, 65, 343-363.
[https://doi.org/10.1016/S0378-3820(99)00103-4]

-
Min, H., Ahmad, T., Park, M., Lee, S. (2015) Physical property with the manufacturing conditions of activated carbon for mercury adsorption, Journal of Korean Society for Atmospheric Environment, 31(3), 302-314, (in Korean with English abstract).
[https://doi.org/10.5572/KOSAE.2015.31.3.302]

-
Min, H., Ahmad, T., Lee, S. (2017) Mercury adsorption characteristics as dependent upon the physical properties of activated carbon, Energy & Fuels, 31, 724-729.
[https://doi.org/10.1021/acs.energyfuels.6b02246]

-
Ochiai, R., Uddin, M.A., Sasaoka, E., Wu, S. (2009) Effects of HCl and SO2 concentration on mercury removal by activated carbon sorbents in coal-derived flue gas, Energy & Fuels, 23(10), 4734-4739.
[https://doi.org/10.1021/ef900057e]

-
Park, J., Lee, S. (2018) Adsorption of mercury by activated carbon prepared from dried sewage sludge in simulated flue gas, Journal of the Air & Waste Management Association, 68(10), 1077-1084.
[https://doi.org/10.1080/10962247.2018.1468364]

-
Sjostrom, S., Durham, M., Bustard, C.J., Martin, C. (2010) Activated carbon injection for mercury control: Overview, Fuel, 89(6), 1320-1322.
[https://doi.org/10.1016/j.fuel.2009.11.016]

- United Nations Environment Programme (UNEP) (2018) global mercury assessment, https://wedocs.unep.org/bitstream/handle/20.500.11822/27579/GMA2018.pdf, .
-
Yan, R., Ng, Y.L., Liang, D.T., Lim, C.S., Tay, J.H. (2003) Bench-scale experimental study on the effect of flue gas composition on mercury removal by activated carbon adsorption, Energy & Fuels, 17(6), 1528-1535.
[https://doi.org/10.1021/ef030041r]

-
Zhang, L., Wang, S., Wu, Q., Wang, F., Lin, C., Zhang, L., Hui, M., Yang, M., Su, H., Hao, J. (2016) Mercury transformation and speciation in flue gases from anthropogenic emission sources: A critical review, Atmospheric Chemistry and Physics, 16(4), 2417-2433.
[https://doi.org/10.5194/acp-16-2417-2016]

최신앙 (충북대학교 환경공학과 석사과정 학생)
이상섭 (충북대학교 환경공학과 교수)