전자빔을 이용한 SO2 제어공정 개선을 위한 첨가제 연구
Copyright © 2018 Korean Society for Atmospheric Environment
Abstract
Various influencing factors for SO2 removal using an electron beam technique were investigated. In order to obtain optimal removal efficiency, various influencing factors such as additives (NH4OH, NaCl, NaOH, Ca(OH)2, and CaCl2), absorbed dose, and initial concentration were estimated. As a result, the removal efficiencies of SO2 were improved when additives were injected in a electron beam process. NaOH and Ca(OH)2 showed the highest SO2 removal efficiency among diverse additives. It means that the OH radical is more effective than the Cl radical. The removal efficiency of SO2 increased when the absorbed dose increased and initial concentration decreased.
Keywords:
Electron beam, SO2, Radiation, Additives, OH radical1. 서 론
전 세계적으로 산업화 및 도시화로 인하여 화력발전소, 소각장, 해양선박, 차량 등에 의한 화석 연료의 사용량이 증가하고 있다(WBG, 2014). 이에 따라, 대기오염 물질인 이산화황(SO2), 질소산화물(NOx)의 배출량이 증가하고 있다. 2014년 우리나라에서는 한 해 동안 SO2가 343,161톤 배출된 것으로 보고되고 있다(MOE, 2017). 또한 세계 주요 도시지역에서 대기오염 물질로 인한 환경오염 문제들이 발생되고 있다(Chaloulakou et al., 2008). 따라서 전 세계적으로 SO2와 NOx의 배출량을 저감하기 위한 연구가 활발히 진행되고 있다.
그 중에서도 SO2는 사람의 호흡기에 큰 영향을 미치며, 환경에도 다양한 영향을 미친다(EPA, 2018). 또한, 수용성임으로 인체의 호흡작용에 의해서 대부분이 흡수되어 호흡관 내벽, 눈, 코 등에 자극을 주며, 만성노출 시 호흡기계 질환을 유발한다(Cheng and Zhang, 2018). SO2는 주로 난방용, 발전용, 산업용 연소시설, 금속의 용융 및 제련, 석유정제 및 화학비료 제조, 석탄 및 석유의 연소과정에서 발생한다. 또한, H2SO4, O3 및 초미세먼지(PM2.5)를 생성하는 전구물질로서 대기질에 큰 영향을 미친다(Cheng and Zhang, 2018; Kim, 2006).
기존 SO2 저감기술은 크게 배연탈황방법(Flue Gas Desulfurization: FGD), 중유탈황방법, 전자빔을 이용한 처리방법 등이 있다. 배연탈황법(FGD)은 현재 가장 많이 쓰는 방법으로 건식석회석주입법, 암모니아흡수법 등이 있다(Ye et al., 2014). 그 중 암모니아흡수법은 NH3 수용액과 반응시켜 회수하는 방법이다. 암모니아의 경우 설비비가 많이 들고 암모니아의 증기압이 높아 흡수액의 손실이 많다는 단점을 가지고 있다. 중유탈황방법은 특징에 따라 직접탈황법, 간접탈황법, 중간탈황법으로 나뉘며 직접탈황법은 내독성 촉매(Co-Ni-Mo)를 이용하여 수소와 반응시켜 S, H2S로 제거한다. 하지만 대기로 H2S가 배출될 우려가 있다.
전자빔을 이용한 대기오염물질처리는 최근 많이 연구되고 있다. 특히 배가스를 처리하는 공정에서 높은 제거 효율과 폐기물을 생산하지 않는다는 장점을 가지고 있다(Park et al., 2019; Son, 2017; Son and Kim, 2015; Sun et al., 2015; Son et al., 2010). 전자빔을 이용한 SO2 처리기술은 기존기술들의 단점을 보완한 유망한 기술로서 타 기술들과 비교하였을 때, 상대적으로 저렴한 운영비와 높은 제거효율을 나타내는 것으로 알려져 있다(Chmielewski et al., 2012). 전자빔을 이용한 SO2 처리기술은 중유 연소 과정 중 배출되는 오염물질을 제거하기 위하여 연구되었다. 그들은 SO2의 초기농도가 700~800 ppm일 때, 2~12 MeV, 1.2 KW 전자빔을 사용하여 17 kGy에서 약 88%의 제거효율을 얻었다(Kawamura and Aoki, 1972). 전자빔 기술은 진공상태에서 전자총에서 방출되는 전자가 고전압에 의해 빛의 속도로 가속되어 높은 에너지의 전자빔을 생성하는 장치로서, 에너지를 흡수한 대상물질과의 반응을 통하여 다양한 자유라디칼을 생성한다. 전자빔 조사를 통한 반응 메커니즘은 식(1)~(4)와 같이 나타낼 수 있다(Ryu et al., 2013; Hwang and Chang, 2011).
| (1) |
| (2) |
| (3) |
| (4) |
생성된 OH 라디칼은 SO2의 제거를 촉진시키며 반응식은 식(5)~(7)과 같다(Park et al., 2019). 이후 생성된 H2SO4는 첨가제 (NH3)와 반응을 통하여 (NH4)2SO4를 부산물로 생성하고 이는 비료로 사용할 수 있다고 보고되고 있다(식(8)~(12)) (Park et al., 2019; Zwolinska et al., 2017; Sun et al., 2015; Chmielewski, 2011).
| (5) |
| (6) |
| (7) |
| (8) |
| (9) |
| (10) |
| (11) |
| (12) |
그러나, 이 때 생성되는 부산물은 그 순도 등의 문제로 인하여 현재까지 비료로서 그 가치를 인정받지 못하고 있다. 또한, 그 생성된 물질의 크기적인 측면에 있어서도 전자빔 후단에 설치된 전기집진기에서 효율적으로 포집할 수 없다. 그럼에도 불구하고, Kikuchi and Pelovski (2009)의 연구에서는 첨가제(NH3) 분사를 통한 전자빔 조사는 전도유망한 기술로 간주하고 있다. 하지만 현재 첨가제로 사용되고 있는 NH3의 경우 폭발로 인한 위험성과 누출 시 독성 피해가 심각할 것으로 보고된다(Yoon, 1993). 따라서 보다 안전하고 효율적인 첨가제의 개발이 필요한 실정이다. 본 연구에서는 다양한 첨가제를 활용하여 전자빔에 의한 SO2 제거효율을 개선하기 위하여 연구를 수행하였다. 더 나아가, SO2의 제어효율이 가장 높게 나온 첨가제와 기존 공정에서 많이 사용한 NH4OH를 사용하여 SO2의 초기농도 및 흡수선량에 따른 SO2의 제거효율을 비교 평가하였다.
2. 연구 방법
2. 1 제어 시스템
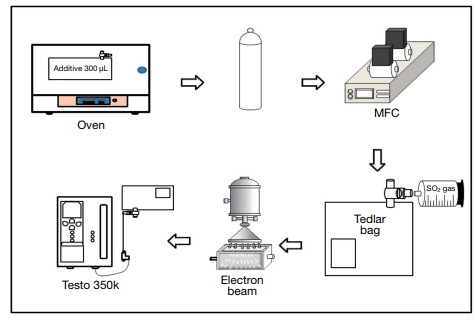
본 연구에서는 전자빔 공정에서 첨가제가 SO2의 제어효율에 미치는 영향을 평가하였다. 이를 위하여 0.6 MeV, 33 mA 전자빔 가속기(Korea Atomic Energy Research Institute, Korea)를 사용하였다. 제어특성을 확인하기 위한 제어인자로는 첨가제의 종류, 흡수선량, 초기농도 등을 사용하였다. 본 연구를 수행하기 위한 실험조건은 표 1과 같다.
첨가제는 기존의 전자빔 공정에서 NH3를 생성하기 위해 사용되는 NH4OH와 더불어 NaCl, NaOH, Ca(OH)2, CaCl2을 이용하였다. 먼저, 첨가제는 실린지(Hamilton co, Model S-500, RENO, Nevada)를 이용해 Tedlar bag (PVP film, C-type, 3 L, Top Trading ENG, Korea)에 주입한 후 오븐에 넣어 기화하였다. 이 때 주입된 첨가제량은 SO2 200 ppm (1 mole) 당 첨가제 100 μL를 기준으로 계산하였으며 실린지를 이용하여 3 L Tedlar bag에 첨가제를 300 μL 주입하였고 기화를 시키기 위하여 오븐에서 65°C로 120분간 두었다. 이 후, 첨가제가 기화된 Tedlar bag에 표준 SO2 2,000 ppm (Sulfur dioxide, N2 balance, 한국특수가스, Korea)을 Air(99.999%, 한국특수가스, Korea)와 MFC(Mass Flow Controller MPR-3000, MKP, Korea)를 사용하여 SO2가스의 농도를 200 ppm으로 희석하여 주입하였다. 이후 첨가제와 SO2가 혼합된 Tedlar bag를 반응기에 넣고 전자빔을 조사하는 방식으로 실험을 진행하였다. 각각의 첨가제별 제어효율의 평가는 10 kGy 흡수선량에서 실시하였다. 추가적으로 전자빔 흡수선량 및 초기농도에 따른 SO2 제어효율을 평가하였다. 이를 위하여, 흡수선량은 5, 10, 15, 20 kGy로 증가시켰다. 또한, SO2가스의 초기농도를 각각 100, 200, 500 ppm으로 조절 후, 위와 같은 흡수선량으로 조절하여 제어효율을 확인하였다. Tedlar bag을 반응기 안에 넣고 전자빔을 조사하는 방식으로 실험과정을 구축하였으며 전체적인 실험 장치의 구성도는 그림 1로 나타내었다. SO2의 제거효율(Removal efficiency: RE)은 아래의 식으로 표현된다.
2. 2 전자빔 흡수선량 측정
흡수선량은 전자빔 공정에서 에너지에 따른 운전조건을 결정하는 주요 인자이며, 방사선이 피폭하는 조사대상물질에 흡수되는 단위질량당 전리방사선 에너지양을 의미한다(Chmielewski et al., 2002).
본 연구에서는 흡수선량을 측정하기 위하여 고체상태의 선량계 중 하나인 CTA (cellulose triacetate) 필름(FTR=125, Fuji Photo Film, Japan)을 사용하여 흡수선량을 측정하였다. 전자빔가속기의 전압과 전류를 각각 0.6 MeV, 1 mA로 유지하여 반응기 내에 CTA 필름을 넣고 전자빔 조사창과 CTA 필름 사이의 거리를 15 cm로 유지하고 흡수선량을 측정하였다. CTA 필름은 반응기 내 총 9개 지점에 설치하였고, 전자빔을 10 mA로 조사한 후 암실에 90분간 보관 후 흡광도의 변화를 UV/VIS 분광광도계(UVIKONxs, SECOMAN, France)의 파장 280 nm에서 측정하였을 때, ΔOD 값은 0.100으로 나왔다. 전자빔 조사선량은 다음과 같이 ADfilm (kGy)식에 대입한 결과 평균 흡수선량은 1 kGy/s의 선량이 흡수되었다(Choi et al., 2014; Chmielewski et al., 2002).
∆OD: 조사 전후에 CTA 필름의 흡수율 차이
k-value: 필름의 단위선량 당 흡광도 차이
2. 3 분석 방법
전자빔 조사에 의한 SO2 제어효율을 확인하기 위하여 전자빔 조사 전·후의 농도를 국립환경과학원의 형식승인을 받은 휴대용 연소가스측정장치 Testo 350k (Testo, Flue gas analyzer, Germany)를 이용하여 측정하였다. 다양한 조건에서 조사된 Tedlar bag을 Testo 350k 가스 프로브를 이용하여 30초간 측정하였다. 본 연구에서 사용된 Testo 350k의 펌프 유량은 1 L/mim이었고, 측정범위는 0~5,000 ppm, 정확도는 ±5 ppm이었다.
3. 결과 및 고찰
3. 1 첨가제
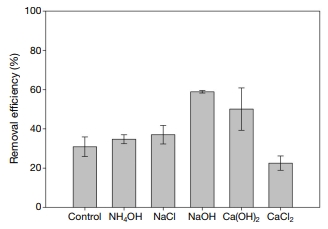
그림 2는 전자빔을 이용하여 SO2를 제어할 때 첨가제가 제어효율에 미치는 영향을 파악하기 위하여 200 ppm의 SO2에 다양한 첨가제를 투입한 후 10 kGy로 조사했을 때 제어효율을 나타내고 있다. 이 때, 모든 결과는 3번의 반복 실험을 통하여 평균값과 표준편차로 나타내었다. 첨가제로 NaOH를 넣었을 경우 58.8%로 가장 높은 제어효율을 나타냈으며, 그 다음으로는 Ca(OH)2가 약 50%로 두 번째로 높은 제어효율을 나타내었다. 첨가제를 사용하지 않고 전자빔만을 사용하였을 때 제어효율은 30.9%였으나, 첨가제로 NaOH를 사용하였을 때에는 첨가제를 사용하지 않았을 경우보다 제어효율이 약 27.9% 만큼 증가하는 것을 확인할 수 있었다. 또한, 4가지 첨가물질(NH4OH, NaCl, NaOH, Ca(OH)2)을 사용했을 때 제거효율이 전자빔만을 사용했을 때보다 더 높게 나타나는 것을 확인할 수 있었다. Dong et al. (1994)은 다양한 첨가제를 이용한 분무흡수건조 실험을 수행하였다. 흡수제로 NaOH와 Ca(OH)2를 사용하여 SO2의 제어효율을 확인한 결과, NaOH (당량비: 1.0~1.2)와 Ca(OH)2 (당량비: 1.0~1.3)의 제거효율은 각각, 94~98.5%와 61~75%로 나와 NaOH를 이용했을 때 제어효율이 월등히 향상되는 것을 확인할 수 있었다. 이와 같은 결과를 통하여, 동일한 Na와 Ca로 구성된 첨가제의 경우에도, Cl보다는 OH로 이루어진 첨가제가 더 높은 SO2 제거효율을 나타내는 것을 알 수 있었다. 즉 OH 라디칼이 SO2와 반응하는 것이 Cl 라디칼과 반응하는 것보다 더 효율적이라는 것을 알 수 있다. 게다가, 다양한 첨가제를 사용하여 반복 실험을 수행한 결과, NaOH의 경우 제어효율의 오차범위가 ±0.6%였고, NH4OH (±2.2%), CaCl2 (±3.6%), NaCl (±4.7%), Ca(OH)2 (±10.7%) 순으로 제거효율의 오차범위가 증가하는 것을 볼 수 있었다. 이는 NaOH를 사용했을 때 그 제어효율의 안정성이 가장 높다는 것을 의미한다.
3. 2 흡수선량
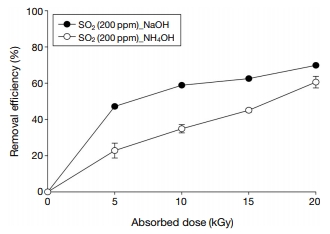
그림 3은 흡수선량 변화(5~20 kGy)에 따른 SO2 제어효율을 나타내고 있다. 사용된 첨가제는 기존의 전자빔 공정에서 사용되는 NH4OH와 본 연구에서 가장 높은 제거효율을 나타낸 NaOH를 이용하였다. 그리고 첨가제 종류에 따른 연구와 동일하게 200 ppm SO2에 첨가제를 투입하여 전자빔을 조사하였다. NaOH 같은 경우 반응메커니즘은 식(13)~(16)과 같이 규명될 수 있다.
| (13) |
| (14) |
| (15) |
| (16) |
NH4OH의 반응메커니즘은 앞에서 언급한 식(6)~(9)와 같다. 선행 연구의 결과를 보면 식(8)에서 첨가제 NH3를 사용하였을 때 생성된 (NH4)2SO2의 입자의 성장속도(Growth factor: G.F.)와 응결핵의 생성속도(Cloud Condensation Nuclei: CCN) 값은 0.53과 0.61이며, 식(16)에서 첨가제 NaOH를 사용하였을 때의 생성된 Na2SO4의 G.F.와 CCN 값은 0.68, 0.80이다. 이는 기존에 사용하였던 첨가제 NH3 혹은 NH4OH를 첨가하였을 때 생성되는 (NH4)2SO4보다 NaOH를 첨가하였을 때 생성되는 Na2SO4의 G.F.는 0.15, CCN의 경우 0.19가 증가하는 것을 확인할 수 있었다(Petters and Kreidenweis, 2007). 이와 같은 결과는 NaOH에서 생성된 물질이 NH3 또는 NH4OH에 의해서 생성된 물질보다 더 빠르고 크게 성장할 수 있다는 것을 의미한다. 또한 기존의 NH4OH와 NaOH의 제어효율을 비교했을 때, 흡수선량이 5 kGy에서 20 kGy로 증가함에 따라 5 kGy에서 24.3%로 가장 큰 차이를 보이며, 20 kGy에서도 9.3%만큼 향상된 결과를 얻을 수 있었다.
두 가지 첨가제 모두 5 kGy에서 20 kGy로 흡수선량이 증가함에 따라 최대 37.7%, 최소 17.5%가 증가하였다. Namba et al. (1993) 연구에서는 파일럿 규모의 소규모 유동 시스템(0.9 Nm3/hr)에서 SO2 농도 500 ppm과 800 ppm을 기준으로 하여 전자빔을 조사 횟수를 증가함에 따라 SO2의 제어효율이 증가하는 것으로 나타났다. 이와 유사한 결과는 Machi et al. (1977) Removal efficiency (%)에서도 확인할 수 있었다. 이와 같은 연구 결과들을 토대로 볼 때, 첨가제의 종류와 상관없이 전자빔을 이용한 SO2의 제어공정에서는 흡수선량이 증가할수록 제어효율이 향상되는 것을 볼 수 있었다. 그러나 흡수선량의 증가에 따른 제어효율의 증가율은 고흡수선량보다는 저흡수선량에서 상대적으로 높게 나타나는 것을 확인할 수 있었고, 이는 전자빔을 사용할 때 저흡수선량이 SO2를 제어하는 데 있어서 에너지 측면에서 더욱 효율적이라는 것을 의미한다.
3. 3 초기농도
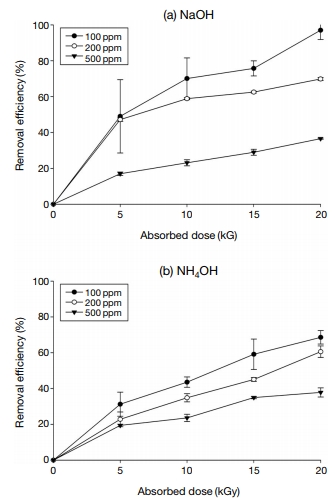
초기농도에 따른 SO2의 제어효율을 확인하기 위하여 첨가제 중 가장 높은 제어효율을 나타낸 NaOH와 기존 공정에서 첨가제로 많이 사용하는 NH4OH를 대상으로 SO2의 초기농도를 100, 200, 500 ppm으로 조절하여 연구를 수행하였다. 그 결과, 두 가지 첨가제 모두 SO2의 초기농도가 낮을수록 제어효율이 높게 나타나는 것을 확인할 수 있었다(그림 4). 20 kGy에서 첨가제 NaOH의 제어효율은 SO2의 초기농도가 100 ppm (97%), 200 ppm (69%), 500 ppm (36%) 순으로 높게 나타났다. NH4OH의 경우에는 100 ppm (68%), 200 ppm (60%), 500 ppm (37%)로 나타났다. 반응식 식(13)~(16)에서 보는 것처럼 SO2 1 mole과 NaOH 2 mole이 반응하여 Na2SO4 1 mole을 생산하는데, 초기 SO2 농도가 100 ppm에서 500 ppm으로 증가하면 반응에 필요한 NaOH가 더 필요하므로 SO2의 제어효율이 감소하는 것으로 판단된다. 이는 SO2의 초기농도가 증가하면 이들 물질을 분해하는 데 요구되는 에너지량도 증가되는 것을 의미한다. 이와 같은 경향은 초기농도가 낮을수록 제거효율이 증가하는 Chmielewski et al. (2018)의 연구와 유사한 것을 확인할 수 있다. 하지만 100, 200 ppm에서는 NaOH가 NH4OH보다 제어효율이 월등히 높았으나 500 ppm에서 흡수선량이 20 kGy일 경우 NH4OH와 NaOH가 유사한 제어효율을 나타내었다. 이는 배출 SO2 농도가 상대적으로 저농도일 때, 낮은 에너지를 이용하면 NaOH가 NH4OH보다 훨씬 유용하다는 것을 의미한다.
4. 결 론
본 연구에서는 전자빔을 이용한 SO2 저감에 있어서 제어효율을 향상시키기 위한 다양한 조건들(첨가제, 흡수선량, 초기농도)에 대하여 연구를 수행하였다. 그 결과, 전자빔만을 단독으로 이용했을 때보다 첨가제를 주입했을 때 제어효율이 월등히 향상되는 것을 확인하였고, NaOH가 가장 높은 제어효율 나타내는 것을 알 수 있었다. 또한, SO2의 제어효율은 흡수선량이 증가하고 초기농도가 감소함에 따라 증가하는 것으로 나타났다. 본 연구는 기존의 NH3를 활용한 전자빔 제거공정의 한계점을 극복하기 위하여 NH3를 대체하기 위한 첨가제를 선정하기 위하여 연구를 수행하였다. 그 결과 NaOH를 위시한 다양한 물질들에서 그 가능성을 확인하였다. 하지만 본 연구는 회분식반응기에서 이루어졌기 때문에 바로 현장적용이 불가능하므로 향후 연속식 및 파일럿 연구를 통하여 현장적용 가능성을 검토해야 한다. 그리고 발생된 부산물들의 성상 및 크기 등의 특성을 파악하는 연구를 추가적으로 진행하여야 한다.
Acknowledgments
This research was supported by the Nuclear R&D program through National Research Foundation of Korea (NRF) funded by the Ministry of Science and ICT (NRF-2018M2A2B3A06071698).
References
-
Chaloulakou, A., Mavroidis, I., Gavriil, I., (2008), Compliance with the annual NO2 air quality standard in Athens. Required NOx levels and expected health implications, Atmospheric Environment, 42(3), p454-465.
[https://doi.org/10.1016/j.atmosenv.2007.09.067]

-
Cheng, G., Zhang, C., (2018), Desulfurization and denitrification technologies of coal-fired flue gas, Polish Journal of Environmental Studies, 27(2), p481-489.
[https://doi.org/10.15244/pjoes/75959]

-
Chmielewski, A.G., Sun, Y., Zimek, Z., Bulka, S., Licki, J., (2002), Mechanism of NOx remocal by electron beam process in the presence of scavengers, Radiation Physics and Chemistry, 65(4-5), p397-403.
[https://doi.org/10.1016/s0969-806x(02)00340-7]

-
Chmielewski, A.G., (2011), Electron accelerators for environmental protection, Reviews of Accelerator Science and Technology, 4(1), p147-159.
[https://doi.org/10.1142/s1793626811000501]

-
Chmielewski, A.G., Sun, Y., Pawelec, A., Licki, J., Dobrowolski, A., Zimek, Z., Witman, S., (2012), Treatment of off-gases containing NOx by electron beam, Catalyst Today, 191(1), p159-164.
[https://doi.org/10.1016/j.cattod.2012.03.043]

-
Chmielewski, A.G., Zwolinska, E., Licki, J., Suna, Y., Zimek, Z., Bulka, S., (2018), A hybrid plasma-chemical system for high-NOx flue gas treatment, Radiation Physics and Chemistry, 144, p1-7.
[https://doi.org/10.1016/j.radphyschem.2017.11.005]

- Choi, C.-Y., Kim, J.-B., Jo, J.-G., Jang, S.-H., Son, Y.-i., Ryu, J.-Y., (2014), Characteristics of NF3 gas decomposition using electron-beam with H2, Journal of Korea Society of Waste Management, 31(3), p243-249, (in Korean with English Abstract).
- Dong, J., Lim, D., Hong, J., Na, J., Jeong, I., (1994), Effects of Type of Absorbents and Additives on Sulfur Dioxide Removal Efficiencies in a Spray Absorption/Drying Reactor, Proceedings of Korean Society of Environmental Engineers, p51-54, (in Korean with English Abstract).
- Environmental Protection Agency, (2018), Sulfur Dioxide (SO2) Pollution, www.epa.gov/so2-pollution/sulfur-dioxide-basics.
- Hwang, H.-Y., Chang, S.-W., (2011), Decomposition characteristics of 1,4-dioxane in an E-beam process and toxicity assessment, Jourmal of the Korean Geoenvironmental Society, 12(2), p63-68, (in Korean with English Abstract).
-
Kawamura, K., Aoki, S., (1972), Application of ionizing radiation to desulfurization of flue gas, Journal of the Atomic Energy Society of Japan, 14(11), p597-599.
[https://doi.org/10.3327/jaesj.14.597]

-
Kikuchi, R., Pelovski, Y., (2009), Low-dose irradiation by electron beam for the treatment of high-SOx flue gas on a semi-pilot scale-Consideration of by-product quality and approach to clean technology, Process Safety and Environmental Protection, 87(2), p135-143.
[https://doi.org/10.1016/j.psep.2008.10.003]

- Kim, Y.P., (2006), Air pollution in Seoul caused by aerosols, Journal of Korean Society for Atmospheric Environment, 22(5), p535-553, (in Korean with English Abstract).
-
Machi, S., Tokunaga, O., Nishimura, K., Hashimoto, S., Kawakami, W., Washino, M., Kawamura, K., Aoki, S., Adachi, K., (1977), Radiation treatment of combustion gases, Radiation Physics and Chemistry, 9(1-3), p371-388.
[https://doi.org/10.1016/0146-5724(77)90091-7]

- Ministry of Environment, (2017), Environmental Statistics Yearbook.
-
Namba, H., Tokunaga, O., Tanaka, T., Ogura, Y., Aoki, S., Suzuki, R., (1993), The study of electron beam flue gas treatment for coal-fired thermal plant in Japan, Radiation Physics and Chemistry, 42(4-6), p669-672.
[https://doi.org/10.1016/0969-806x(93)90349-y]

-
Park, J.H., Ahn, J.W., Kim, K.H., Son, Y.S., (2019), Historic and futuristic review of electron beam technology for the treatment of SO2 and NOx in flue gas, Chemical Engineering Journal, 355, p351-366.
[https://doi.org/10.1016/j.cej.2018.08.103]

-
Petters, M.D., Kreidenweis, S.M., (2007), A single parameter representation of hygroscopic growth and cloud condensation nucleus activity, Atmospheric Chemistry and Physics, 7, p1961-1971.
[https://doi.org/10.5194/acp-7-1961-2007]

- Ryu, J.Y., Kim, J.B., Choi, C.Y., Jang, S.H., Son, Y.I., (2013), A study on Destruction and Removal Efficiency (DRE) and by-products of Sulfur Hexafluoride (SF6) using high ionization energy with conditioning agents (O2, H2O, and H2), Journal of Korea Society of Waste Management, 30(6), p592-599, (in Korean with English Abstract).
-
Son, Y.S., (2017), Decomposition of VOCs and odorous compounds by radiolysis: A critical review, Chemical Engineering Journal, 316, p609-622.
[https://doi.org/10.1016/j.cej.2017.01.063]

-
Son, Y.S., Kim, J.C., (2015), Decomposition of sulfur compounds by radiolysis: I. Influential factors, Chemical Engineering Journal, 262, p217-223.
[https://doi.org/10.1016/j.cej.2014.09.070]

-
Son, Y.S., Kim, K.J., Kim, J.C., (2010), A review on VOCs control technology using electron beam, Asian Journal of Atmospheric Environment, 4(2), p63-71.
[https://doi.org/10.5572/ajae.2010.4.2.063]

- Sun, Y., Zwolińska, E., Chmielewski, A., (2015), Abatement technologies for high concentrations of NOx and SO2 removal from exhaust gases: a review, Critical Reviews in Environmental Science and Technology, 46, p119-142.
- World Bank Group (WBG), (2014), Data for fossil fuel energy consumption, www.worldback.org.
-
Ye, J.h., Shang, J., Li, Q., Xu, W., Liu, J., Feng, X., Zhu, T., (2014), The use of vacuum ultraviolet irradiation to oxidize SO2 and NOx for simultaneous desulfurization and denitrification, Journal of Hazardous Materials, 271, p89-97.
[https://doi.org/10.1016/j.jhazmat.2014.02.011]

- Yoon, J.K., (1993), Explosion Phenomena & Combustion, Proceedings of The Korean Society of Automotive Engineers, p34-39, (in Korean with English Abstract).
- Zwolińska, E., Gogulancea, V., Sun, Y., Lavric, V., Chmielewski, A., (2017), A kinetic sensitivity analysis for the SO2 and NOx removal using the electron beam technology, Radiation Physics and Chemistry, 138, p29-36.
김경목(한국원자력연구원 공업환경연구부 석사과정연구생/충남대학교 환경공학과 석사과정연구원)
서서희(한국원자력연구원 공업환경연구부 석사과정연구생)
박준형(FITI 시험연구원 전주사무소 연구원)
김탁현(한국원자력연구원 공업환경연구부 책임연구원)
이진홍(충남대학교 환경공학과 교수)
손윤석(부경대학교 환경공학과 조교수)