부하변동이 큰 화장시설 SCR 공정에서 NOx/N2O 및 NH3 동시 저감 특성 연구
Copyright © 2017 Korean Society for Atmospheric Environment
Abstract
Efficient simultaneous reduction conditions for NOx and NH3-slip was investigated in SCR (Selective Catalytic Reduction) process with load variation by applying dual catalysts (SCR catalyst, NH3 decomposition catalyst) system. N2O formation characteristics were analyzed to look into possible undesirable reaction pathways.
In the experiments of catalyst characteristics, various operational variables were tested for the combined catalytic system, such as NH3/NOx ratio, temperature, oxygen concentration and H2O. The reaction characteristics of NOx, NH3 and N2O were analyzed and optimal conditions could be evaluated for the combustion facility with varied load. In terms of NOx/NH3 simultaneous reduction and N2O formation suppression, optimal condition was considered NSR 1.2 and temperature 300℃. At this operational condition, NOx conversion was 98%, NH3 reduction efficiency was 95%, generated N2O concentration 9.5 ppm with inlet NOx concentration of 100 ppm.
In NH3-SCR process with NH3 decomposition catalyst, NOx and NH3 can be considered to be reduced simultaneously at limited conditions. The results of this study may be utilized as basic data at facilities requiring simultaneous NOx and NH3 reduction for facilities with load variation.
Keywords:
Load variation, Selective catalytic reduction, NOx, NH3, N2O, Simultaneous reduction1. 서 론
최근 연소시설은 다양한 형태로 발전되어 왔으며 연소특성 및 연소조건 등에 따라 유량, 온도 또는 대기오염물질 발생량이 급변하는 중·소규모 연소시설이 크게 증가하는 추세에 있다. 그러나 기존의 대기오염물질 방지시설 관련 연구의 경우 시설이 가동되고 있는 정상상태를 가정하여 수행한 연구가 주를 이루고 있어, 위와 같이 부하변동의 폭이 큰 시설에 대한 연구는 다소 미흡한 실정이다 (Lee et al., 2016). 또한 대부분의 연구가 대기환경보전법에서 규제하고 있는 NO2로서의 제거효율에 주로 관심을 가지고 연구가 되었으며, N2O 등의 다른 형태의 질소산화물과 연계한 연구는 미미하다 (Lee et al., 2010).
대표적인 부하변동이 큰 시설로는 화장시설, 기력발전시설, 소규모 생산 공정, 후처리설비, 소형 소각시설 등이 포함되며 특히, 화장시설의 경우 그 수요가 급격히 증가하고 있는 추세이다 (SMBA, 2015). 국내의 경우 1970년대까지의 화장률은 10% 미만이었으나 급속한 산업발전과 도시화 정책에 따라 화장률은 큰 폭으로 증가하여 2016년에는 수요가 70% 이상으로 증가하였다 (SMBA, 2015). 이러한 증가 추세로 인해 유럽에서는 화장로에서 발생하는 NOx, CO, SO2, PM, PCDD/Fs, 중금속 등 다양한 오염물질에 대한 모니터링 및 연구가 증가하고 있다 (Mari et al., 2010).
대부분의 시설에서는 질소산화물 제어의 목적으로 선택적 촉매 환원 (Selective Catalytic Reduction) 공정을 주로 적용하고 있으나 SCR의 경우 온도 및 유량 등의 변화폭이 크고 가동의 주기가 잦아 질소산화물 배출농도가 급변하는 문제점을 가지고 있다. 또한 탈질공정에서 환원제로 사용되는 암모니아, 요소수 등이 미반응으로 인해 배출되어 암모니아 슬립 (NH3-slip) 현상이 발생되고, 이는 2차적으로 배기가스 중의 SO3와 반응하여 ABS (Ammonium Bi-sulfate, NH4HSO4)와 AS (Ammonium Sulfate, (NH4)2SO4)를 생성시켜 후단설비 부식 또는 악취를 유발하여 인근 지역 주민들에게 환경피해 및 민원문제를 일으키는 것으로 보고되고 있다 (Kim, 2014b). 상용 SCR 탈질시스템의 설계에 있어서 최우선적으로 고려할 사항은 90% 이상의 요구탈질성능과 탈질설비 바로 후단에서 3~5 ppm의 미반응 NH3 Slip농도를 보증할 수 있느냐이다 (Forzatti, 2001, 2000). 이를 달성하기 위한 방안으로 SCR 공정에 관한 대부분의 연구는 NH3 Slip과 NOx 저감율을 고려하여 다양한 촉매를 개질하여 새로운 촉매를 개발하는 연구가 국내·외에서 진행되고 있다 (Salazar et al., 2017).
본 연구에서는 NH3를 환원제로 사용하는 NH3-SCR 공정에서 배기가스 중 질소산화물을 처리하는 SCR 촉매와 암모니아 분해 촉매를 동시에 적용한 2단 촉매장치를 Lab-scale 규모로 구현하여 부하변동이 큰 조건에서 질소산화물과 미반응 암모니아를 효율적으로 동시에 처리하는 것을 목적으로 하였다. 본 연구에서는 부하변동 조건에 적합하다고 판단되는 Cordierite를 지지체로 한 촉매를 사용하였으며 (Yates et al., 2005), SCR 촉매로 V2O5 - WO3 - TiO2/Cordierite와 NH3-slip 제거 촉매로 Pt-TiO2/Cordierite를 사용하였다. 다양한 촉매들이 시중에 유통되지만 SCR 촉매로서는 처리효율이 뛰어나고 배가스에 포함된 이산화황에 강한 저항성을 가지는 V2O5 - TiO2계 촉매가 가장 많이 사용되고 있다 (Heck et al., 1999).
실험방법으로는 SCR 촉매만을 사용하였을 때와 SCR 촉매와 NH3 분해 촉매를 2단으로 설치하였을 때의 반응 특성을 비교·분석하고, 실제 측정데이터를 바탕으로 다양한 운전조건들을 변수로 설정하여 2단 촉매장치의 성능을 분석하였으며, 실험조건으로는 SCR의 주 영향 인자인 NH3/NOx비, 반응온도, 산소 농도 등을 고려하였다 (Yates et al., 2005). 또한 변수가 되는 대표 실험조건을 선정하여 질소산화물, 암모니아, 아산화질소의 반응 특성을 다양한 관점에서 분석하여 부하변동이 큰 연소시설에 적용 가능한 최적의 운전조건 도출하고자 하였다.
2. 실험내용 및 방법
2. 1 화장로 시설 현장 분석
본 연구의 대상이 되는 부하변동이 큰 연소시설의 실험조건을 설정하기에 앞서 대상 시설의 운전조건 및 오염물질 배출특성을 파악하기 위해 A시 화장로 주연소로 후단과 방지시설 후단의 연돌에서 현장 측정 분석을 통해 실험조건을 검토하였다. 본 실험의 검토대상인 A시 화장로의 경우 하루 평균 30건 이상의 화장을 진행하고 있었으며 총 10개의 대차식 구조의 화장장에 1, 3, 5, 7, 9호와 2, 4, 6, 8호를 교대로 운영하고 있었다. 화장에 대한 운영계획은 보건복지부 ‘e하늘 장사종합정보’ 프로그램을 통해 화장계획을 확인 후 현장 분석을 실시하였다 (보건복지부, e하늘 장사정보).
2. 2 실험촉매의 선정
시중에서 이용되는 상용촉매의 지지체인 TiO2의 특성 중에는 열적 불안정성이 있기 때문에 본 연구에서 대상으로 하는 온도의 변동이 큰 연소시설에 적용하기 충분하지 않을 것으로 판단되었다 (Yates et al., 2005). 또한 부하변동이 큰 연소시설 중에는 소형 소각시설 등 규모가 작은 배출시설이 다수 포함되므로 촉매 설치 및 교체가 비교적 용이하도록 경제성을 고려하여 급변하는 온도 영역에 최적화된 촉매 지지체를 참고문헌을 통해 고찰하였다 (Busca et al., 1998).
결과적으로 Cordierite Ceramics (2MgO·2Al2O3· 5SiO2)가 요구조건을 만족하였다. Cordierite는 내화제, 촉매 담체 등에 널리 사용되고 있으며 넓은 비표면적, 우수한 기계적 특성, 낮은 열 팽창률로 인한 내구성이 뛰어나다는 장점을 가지고 있다 (Busca et al., 1998). 낮은 열팽창 특성은 (AlSi)O4 사면체 구조의 (AlSi)-O 간 결합이 강하기 때문으로 사료된다 (Kim, 2014a, 2014b, 2007).
일반적으로 약한 결합인 M-O 간의 열팽창을 6원환상의 결정층이 역회전하여 흡수한다. 이 흡수에 의해 A축의 낮은 열팽창을 나타낸다. 또한 M-O 합거리의 열팽창으로 C축의 (-)팽창이 가능하기 때문에 Cordierite는 낮은 열팽창 계수를 가지게 된다. 연소로 운전변화에 따른 급속한 온도 변화에 적용 가능한 높은 열충격 강도를 가지는 촉매가 요구되고, Cordierite를 지지체로 사용하는 경우, 기존 촉매에 사용되는 원료의 사용량을 획기적으로 줄일 수 있으며 성형성이 우수하고 다공성인 재료를 활용하므로 고강도 담체로 사용할 수 있다.
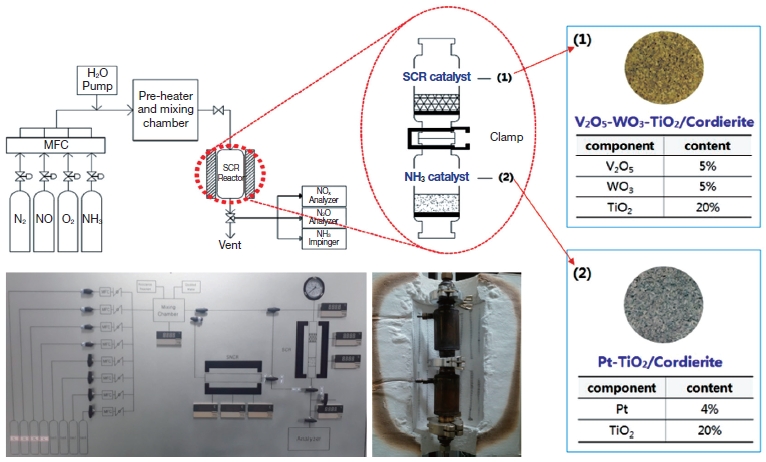
SCR 촉매는 상용촉매 구성 성분인 V2O5와 WO3를 함유하고 상용촉매 지지체로 사용되는 TiO2를 사용하되 함량을 줄여 높은 비표면적의 특성을 유지하도록 하였다. 암모니아 촉매의 활성 성분으로는 Pt (4 wt%)를 사용하였다 (Blauwens et al., 1977).
또한 실험에 사용된 SCR 촉매와 NH3 분해 촉매의 실제 구성 성분 및 함량, 그리고 기공특성을 파악하기 위하여 BET (Micromeritics ASAP 2000)와 XRF (Rigaku D/Max-2000) 분석을 실시하였다.
2. 3 실험장치의 구성
본 연구에서는 발생되는 NOx와 NH3-slip의 동시 저감 실험을 아래 그림 1과 같은 lab-scale 규모의 장치를 제작하여 실험을 수행하였으며, 실험장치는 크게 가스 공급 및 혼합기, 반응기, 가스 분석기의 세 부분으로 구성하였다. 혼합가스를 예열할 수 있도록 예열기를 설치하였으며, 예열기 내부에 직경 2 mm의 glass beads를 삽입하여 mixing chamber로서의 역할을 하도록 하였다. 실험장치의 개요도와 촉매의 구성 성분을 포함하여 그림 1에 나타내었다.
반응기는 1,000℃ 이상의 고온에서도 내식성, 내산성 및 내열성을 가지는 stainless steel을 사용하였으며, 두 개의 반응기를 clamp로 연결하여 시스템으로부터 분리가 가능하도록 제작하였다. 실험촉매는 honeycomb 형태의 촉매를 20~40 mesh 크기로 분쇄하여 사용하였으며, 촉매를 지지할 수 있도록 반응기 내에 반응기와 동일한 재질의 다공성 지지대를 설치하였다. 배출 가스의 측정은 혼합된 모사가스를 촉매가 충진된 반응기에 흘려주고 반응기 내부의 온도가 안정화되었을 때 장치 후단에서 배출되는 가스의 농도를 gas analyzer (Bacharach ECA 450)를 이용하여 가스상물질 (O2, CO2, CO, SOx, NOx)의 농도를 측정하였다. 이와 함께 N2O의 농도는 NDIR 방식을 사용한 실시간 연속 모니터링 측정기 (Hymeth Kimso Co. Ltd)를 이용하여 측정하였으며 암모니아의 경우 대기오염공정시험기준에 따라 인도페놀법으로 가스 중 암모니아를 정량화 하였다.
2. 4 운전특성 분석을 통한 실험조건의 설정
본 실험에서의 실험조건은 현장 조건을 반영하여 설정하였다. 실제 A시의 화장로에서의 현장 분석 데이터를 표 1에 나타내었다.
시설 유량 변화폭은 30~67 Nm3/min이었으며, 열 교환시설을 거친 배기가스의 온도가 150~250℃ 정도로 낮으므로 SCR 전단에는 예열장치를 설치하여 연소 중의 SCR 온도를 약 250℃로 일정하게 유지한 상태로 가동 중이었다. 질소산화물을 저감하기 위한 SCR 공정의 환원제로는 암모니아를 사용하고 있었으며, NH3 소요량을 통해 표준당량비 (NSR)를 계산한 결과, 평균적으로 대상 시설에서는 NSR 0.64의 조건으로 운전하고 있었다. NH3는 연소 초기와 연소로 가동 시 질소산화물이 다량 생성되는 경우에 한하여 부분적으로 관리자의 판단에 의존하여 투입되고 있었으며 현장 측정 대상 화장로의 경우, 하루 평균 3 Cycle이 운행되었고 연소 구간 (1시간)과 냉각 구간 (50분)으로 운전되고 있었다.
본 연구에서는 현장 측정 데이터를 바탕으로 변수에 따라 크게 두 부분으로 구분하여 (1) SCR 촉매와 NH3 분해 촉매를 함께 장착하였을 때의 반응 특성 실험, (2) 부하변동 조건을 반영한 실험을 수행하였다. 이때 다양한 운전조건 변수로는 환원제의 표준 당량비 (NSR), 유량, 온도, 산소 농도로 구분하였으며 이에 따른 질소산화물, 암모니아, 아산화질소의 반응 특성을 고찰하고자 하였다.
본 실험에서의 실험조건은 현장 분석 데이터 (표 1)를 고려하여 선정하였으며 표 2에 나타내었다.
유량은 실험장비의 크기를 고려하여 1.0~2.0 L/min으로 조절하였고, 온도 및 NSR의 경우 현장 조건을 고려하여 200~400℃, 0.64~2.0으로 조절하여 수행하였다.
또한 부하변동의 조건을 적용하기 위해 운전조건을 대표할 수 있도록 현장 측정값을 고려하여 8가지로 운전조건을 구분하고 앞선 실험으로 도출된 효율에 큰 영향을 미치는 변수인 온도 및 NSR을 적용하여 대표 Mode를 설정하였다. Mode는 총 3가지로 구분하였고, Mode 1은 NOx와 NH3의 동시 저감 측면에서 최적 운전온도라고 판단되는 300℃를 적용, Mode 2는 최적 NSR이라고 판단되는 1.2, Mode 3은 Mode 1, 2를 반영한 300℃, NSR 1.2로 실험을 수행하였다. 실험의 기본 운전조건은 다음 표 3에 나타내었으며, 8가지로 운전조건을 구분하여 보다 다양한 현장의 운전조건을 본 실험에 적용하고자 하였다.
3. 결과 및 고찰
3. 1 실험 촉매 특성 분석 결과
실험에 사용된 촉매의 특성 분석을 분석하였다. 분석방법으로는 기공 특성을 알아보기 위한 BET (Micromeritics ASAP 2000) 분석과 촉매의 화학적 조성을 알아보기 위해 XRF (Rigaku D/Max-2000) 분석을 실시하였다.
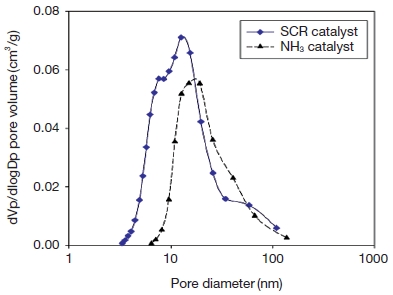
BET 분석 결과 SCR 촉매의 평균 기공 크기는 11.9582 nm, NH3 분해 촉매의 평균 기공 크기는 19.9251 nm로 측정되었다. 모두 Mesopore size 크기의 촉매로 구분할 수 있었으며, SCR 촉매에 비해 NH3 분해 촉매의 평균 기공 크기가 큰 편이나, 두 촉매 모두 기존 연구에서 사용된 촉매들의 기공 범위에 포함된다.
또한 촉매의 화학적 조성을 알아보기 위해 XRF 분석을 실시하고 표 5에 3번의 분석 값을 평균한 값으로 나타내었다. SCR 촉매 분석 결과를 살펴보면 V2O5 (2.12 wt%), WO3 (1.25 wt%), TiO2 (22.50 wt%)로 나타났으며, NH3 촉매는 PtO2 (4.26 wt%), TiO2 (13.86 wt%)로 나타났다. Cordierite 구성 성분으로는 MgO, Al2O3, SiO2가 구성되어 있으며, SCR 촉매는 78.25 wt%, NH3 분해 촉매는 77.50 wt%를 함유하고 있다. XRF로 측정된 촉매 성분의 함량이 제조 함량과 다르게 낮은 수치를 보이는 이유는 촉매 제조 과정 중 건조 과정에서 활성 성분이 촉매 특정 부분 (특히 바깥쪽)으로 이동하였기 때문으로 판단된다.
3. 2 SCR 촉매와 NH3 분해 촉매의 비교·분석 결과
SCR 촉매 후단에 암모니아 분해 촉매를 설치하여 2개의 촉매가 하나의 시스템에 존재할 경우에 기존 SCR 촉매만을 사용할 경우와 비교하여 NSR에 따른 반응 특성을 비교·분석하였고, 2단 촉매 시스템에 대해서 온도, O2의 양과 같은 변수를 고려하여 NOx, NH3, N2O 반응 특성을 고찰할 목적으로 수행하였다.
NOx, NH3, N2O의 반응 특성을 그림 3에 나타내었으며, SCR 촉매 단독으로 실험한 결과와 비교해보면 NSR 1.2까지는 비슷한 경향을 보였으나 NSR 1.2 이후부터는 NOx 저감효율이 점차 감소하는 측정값을 나타내었다. NSR 1.2일 때는 SCR 공정의 주반응 (1)~(3)에 따라 96%의 고효율로 측정되었으나, NSR 1.8부터는 90%에 미치지 못하였고 NSR 2.0일 경우에는 82%로 NSR 0.8일 경우보다 낮은 효율을 보였다. 이는 암모니아 분해 촉매인 Pt 성분의 N2 선택도와 관련되는데, 암모니아를 분해하는 과정에서 주입하는 NH3의 양이 많아짐에 따라 (NSR이 높아질수록) 혼합가스 내의 O2와 반응하는 NH3도 증가하므로 SCR 반응의 부반응 중 (4), (5)에 따라 NOx가 생성되는 것으로 판단된다. 이 결과로 O2 농도가 SCR 효율에 영향을 미치는 것을 확인하였다.
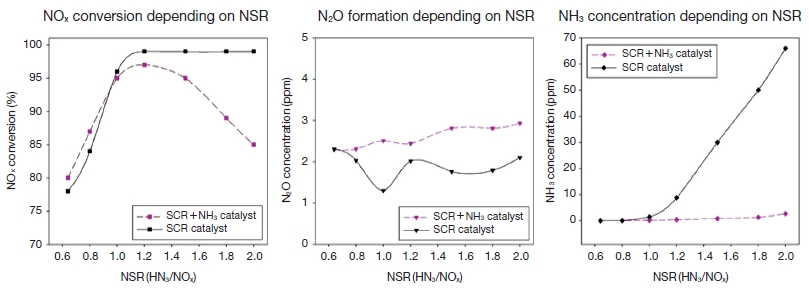
NOx conversion, NH3 concentration, N2O formation depending on NSR (NO: 100 ppm, O2: 10 vol.%, Temp.: 250°C).
| (1) |
| (2) |
| (3) |
| (4) |
| (5) |
동일한 조건하에 NH3 분해 촉매를 추가 설치한 후의 NH3-slip 농도를 SCR 촉매만 단독 적용한 결과와 비교하여 그림 3에 나타내었다. SCR 촉매만을 적용하였을 때, NSR 1.2 이후부터 NH3-slip이 급격하게 증가하는 경향을 보이는 반면, NH3 분해 촉매를 설치한 후의 NH3 배출 농도는 NSR 1.2일 때 0.5 ppm, NSR 1.5일 때 0.8 ppm, NSR 1.8일 때 1.3 ppm, NSR 2.0일 때 2.7 ppm으로 급격히 저감되었다. 이때 평균 암모니아 저감효율은 95%로 상당히 높은 수준을 보였다.
NSR에 따른 N2O 농도는 2.3~2.9 ppm으로 NSR에 따른 차이가 크지 않으며, 소량이 생성되었으므로 경향성이 있다고 판단하기 어렵다. 이 결과는 SCR 촉매만을 사용하는 경우와 동일하게 실험에 사용된 촉매에서 환원제의 투입량은 N2O 생성에 큰 영향을 주지 않는다고 판단된다.
SCR 촉매와 NH3 분해 촉매를 하나의 시스템으로 설치할 경우 200~400℃ 범위에서 50℃ 간격으로 온도를 증가하며 NOx, NH3, N2O를 분석하였다. 그림 4에 나타난 온도에 따른 NSR별 NOx 저감 특성을 살펴보면 모든 NSR 조건에서 NOx 저감효율이 유사한 경향을 나타낸다. SCR 촉매 실험 결과와 비교해 보면 200~300℃까지 NOx 저감효율이 증가하다가 300℃에서 최적의 효율을 보이고 그 이상의 온도에서는 저감효율이 둔화되는 경향이 유사한 측정값을 보였다.
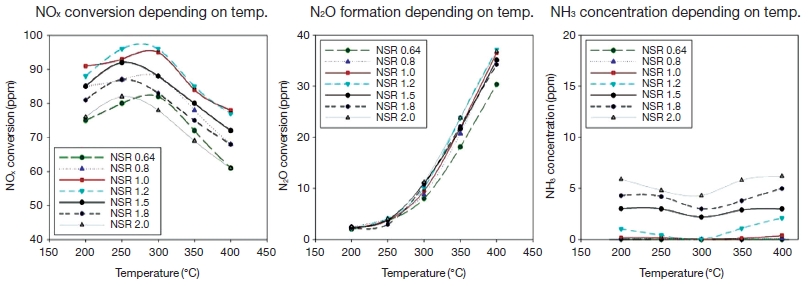
NOx conversion, NH3 concentration, N2O formation depending on Temp. (NO: 100 ppm, O2: 10 vol.%, NSR.: 0.64 ~ 2.0).
NH3-slip의 경우, NOx의 저감효율과 비례하여 저감되는 경향을 보이며, 온도범위 250~300℃ 부근에서 가장 낮은 농도를 나타났고 모든 NSR 조건에서 NH3 농도는 6 ppm 이하로 측정되었다. SCR 촉매만을 단독으로 사용할 경우와 비교할 때 2단 촉매 시스템을 구축할 경우 NH3의 농도가 줄어드는 것을 확인할 수 있었다.
N2O는 온도가 증가함에 따라 급격하게 증가하는 경향을 보이며, 이는 SCR 촉매만으로 실험한 결과와 유사하다. 250℃ 이하에서는 모든 NSR 범위에서 5 ppm 이하로 생성되었으나 300℃ 부근에서 약 10 ppm 수준으로 증가하였으며, 350~400℃에서는 약 20~35 ppm에 도달하였다. 이 결과는 여러 부반응 중 350℃ 이상에서 주가 되는 반응인 (6)과 (7)반응에 의한 것으로 판단된다.
| (6) |
| (7) |
NOx 저감효율과 비교해보면, 온도 증가에 따른 N2 선택도 저하가 N2O의 생성 증가와 밀접한 관계를 보이는 것을 알 수 있다. 따라서 고온에서 진행되는 암모니아 산화반응에 따른 주 생성물은 N2와 N2O라고 판단된다.
산소는 SCR 반응에 참여하여 효율에 영향을 주는 중요한 인자이며, 특히 활성화 에너지가 낮은 저온 영역에서는 산소의 농도가 중요한 역할을 하는 것으로 알려져 있다. 실험 촉매 중 NH3 산화촉매로 사용한 Pt 촉매의 경우, 산소 존재 시 200℃의 저온에서도 90%의 NOx가 제거되나 무산소 조건에서는 260℃ 이상이 되어야 90%의 제거효율을 갖는다는 연구결과가 보고된 바 있다 (Blauwens et al., 1977). 따라서 산소의 농도가 실험 결과에 어떠한 영향을 미치는지 알아보기 위하여 유입 NOx 농도 100 ppm, NSR 1.0으로 고정하고 O2 농도 0 vol.%, 5 vol.%, 10 vol% 조건에서 실험을 수행하여 결과를 그림 5에 나타내었다. 실험 결과, 혼합가스의 O2 농도가 증가할수록 NO의 산화반응은 활성화되고, 따라서 모든 온도 영역에서 촉매 출구에서의 NO2 농도는 증가하였으며, 실험 촉매 상에서 무산소 조건에서도 NOx가 제거됨을 알 수 있었다. 이때 산소가 존재하지 않는 경우보다 산소가 존재하는 경우에 활성이 증가하는 경향을 보였으며, SCR 활성 온도인 200~300℃에서 최대 NOx 전환효율은 10 vol.% O2에서 나타났다. 200~350℃까지는 O2가 고농도일수록 NOx 제거율이 증가하다가 400℃에서는 5 vol.% O2 일 때 최고 효율을 나타냈다. 이는 고농도 산소조건 하에서 반응식 (8)~(11)에 따라 350℃ 이상에서 암모니아와 NO의 반응인 SCR 주반응 ((1)~(3))보다 암모니아와 산소의 반응이 활발하게 진행되기 때문에 NOx 및 N2O의 농도가 증가하여 전환효율이 감소한 것으로 판단된다.
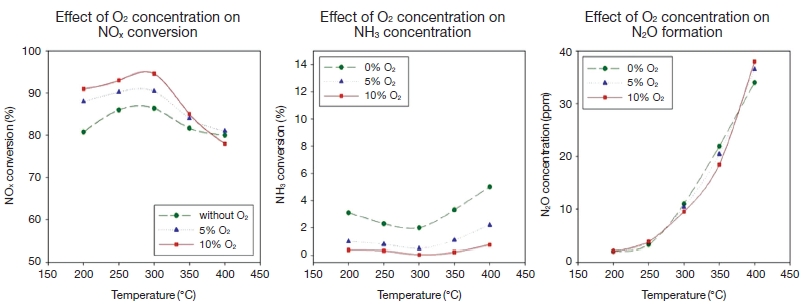
NOx conversion, NH3 concentration, N2O formation depending on O2 (NO: 100 ppm, O2: 10 vol.%, NSR.: 0.64 ~ 2.0).
| (8) |
| (9) |
| (10) |
| (11) |
3. 3 부하변동 조건을 적용한 Simulation
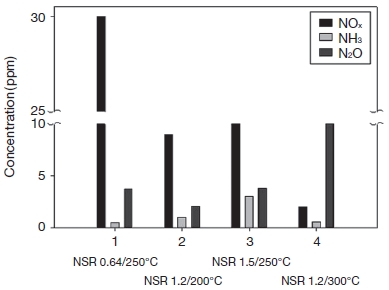
촉매 반응 특성 실험을 통해 효율에 큰 영향을 미치는 운전변수를 도출하였으며, NSR과 온도에 따라 NOx, NH3 및 N2O의 배출특성이 민감하게 변화하는 것을 알 수 있었다. 앞서 실험한 결과를 바탕으로 현장 조건을 고려하여 2단 촉매 공정을 구축하여 사용할 경우 대기오염물질 배출특성을 그림 6에 요약하여 나타내었다. 그림 6에서 ①은 현장에서의 가동조건, ②와 ③은 90%이상의 NOx 저감효율을 보이는 조건 ④는 이론적 최대 저감조건을 나타내며, 그림 7에 Input NOx 100 ppm, 10 vol.% O2일 때 ①~④ 운전조건을 적용한 결과를 나타내었다.
실제 시설에서 적용되는 운전조건인 ①조건 적용 시 30 ppm으로 NOx가 가장 많이 배출되었으며, NH3를 가장 많이 투입하는 ③조건에서 NH3가 가장 높게 측정되었다. N2O는 온도가 가장 높은 ④조건에서 약 10 ppm으로 가장 높게 나타났다. 질소산화물과 암모니아의 동시 저감 측면에서 ④조건인 NSR 1.2, 300℃에서 가장 큰 저감효과를 기대할 수 있었다. 그러나 N2O의 생성 측면에서는 ④조건이 가장 높은 값을 보이고 있으므로 실 공정 적용 시 가동 온도를 고려할 필요가 있다.
또한, 최적의 효율을 보인 조건인 NSR 1.2, 300℃를 최적 운전조건으로 적용하여, Mode 1 (최적 온도조건 300℃), Mode 2 (최적 NSR 1.2), Mode 3 (300℃, NSR 1.2)를 적용하여 실제 측정 데이터와 비교·분석하였다. 부하변동이 큰 연소시설의 대표 운전조건은 현장 측정을 통한 자료를 기반으로 8개를 선정하여 표 3에 나타내었으며, 최적운전 Mode를 적용한 모사실험 결과를 통해 실 공정에 적용 시 최적 효율을 나타내는 운전조건을 검토할 수 있었다. 그림 8에 8개의 운전조건에 따른 Mode별 질소산화물, 아산화질소, 암모니아의 배출농도를 나타내었다.
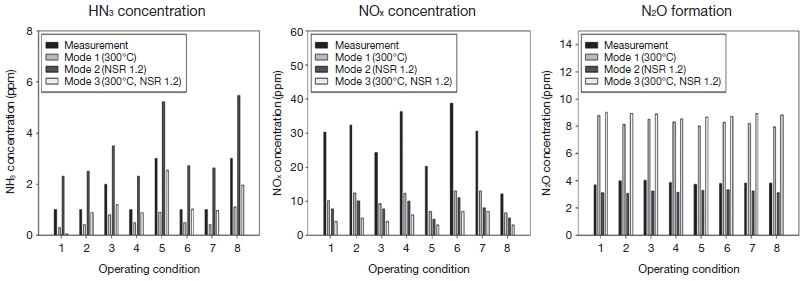
Each efficiency of NOx conversion, NH3 concentration, N2O formation depending on operating conditions.
분석 결과 현장 측정>Mode 1>Mode 2>Mode 3 순으로 NOx가 배출되었다. 측정값을 기준으로 했을 때 평균 NOx 저감효율은 Mode 1의 경우에 약 67%, Mode 2는 약 77%, Mode 3는 약 87%로 나타났다. 이 결과로 미루어보아 온도를 300℃로 올리거나 NSR을 1.2로 증가시켜 운전하는 것만으로도 질소산화물의 뚜렷한 저감효과를 기대할 수 있을 것으로 사료된다. 각 Mode에 따른 암모니아 배출 농도는 Mode 2>현장 측정> Mode 3>Mode 1 순으로 높게 측정되었다. 현장 측정보다 Mode 2에서 NH3가 많이 생산되는 이유는 현장 투입 NSR 0.64보다 많은 양의 NH3 주입량과 낮은 반응온도에 의해 NOx가 N2로 전환되는 SCR 공정의 주반응 (1)~(3)이 미반응으로 인해 NH3가 다량 생성된 것으로 사료된다. 그림 8의 내용을 비교해보면 NH3가 가장 적게 배출되는 Mode 1의 경우에 NOx가 비교적 높게 배출되었으며, NOx 농도가 가장 낮게 배출되는 Mode 3에서 약 3 ppm 이하로 적은 암모니아가 측정되었다. 따라서 질소산화물과 암모니아의 동시 저감 측면에서는 Mode 3이 가장 효과적일 것으로 예상된다.
N2O의 생성은 온도에 가장 큰 영향을 받으므로 250 ℃ 조건인 현장 측정과 Mode 1에서 3~4 ppm 정도로 N2O가 생성되었으며, 300℃ 조건인 Mode 2와 Mode 3에서는 약 8~9 ppm로 비교적 높은 수준의 N2O가 생성되었다.
4. 결 론
본 연구에서는 NH3-SCR 시스템에서 질소산화물과 암모니아의 동시 저감을 목적으로 SCR 촉매와 NH3 분해 촉매를 동시적용하였으며 NSR, 온도, 산소 농도를 변수로 하여 NOx, NH3 및 N2O의 배출 경향을 고찰하였다. 이를 통해 얻은 결론은 다음과 같다.
(1) SCR 촉매와 NH3 분해 촉매를 동시에 적용하는 경우, 평균 NH3 저감효율이 95%로 상당히 높은 수준을 보였다. NOx의 경우, SCR 촉매 단독 실험결과와 달리 NSR 1.2에서 최고 효율을 보였으며, 그 이후부터는 효율이 점차 감소했다. 이는 NH3 분해 촉매인 Pt 성분의 N2 선택도와 관련하여 NSR이 증가할수록 혼합가스 내의 O2와 반응하는 NH3가 증가함에 따라 NOx 선택도가 감소함을 시사한다.
(2) 실험 촉매는 300℃ 부근에서 최고 NOx 및 NH3 저감효율을 보이나 온도가 증가함에 따라 그 효율이 감소하였고 N2O가 급격하게 증가하였다. 이러한 결과는 고온에서 NH3가 NO보다는 O2와 반응하여 N2와 질소산화물로서 NO, NO2, N2O를 생성하기 때문으로 사료된다.
(3) 200~350℃ 범위에서는 10 vol.% O2 조건에서 NOx 저감효율이 높았으나 400℃ 이상에서는 5 vol.% O2 조건에서 최고 효율을 보였다. 이는 350℃ 이상의 고온에서는 혼합가스 내의 O2가 NH3 산화반응에 의해 N2O를 생성하기 때문이며, O2가 반응에 참여하여 효율에 영향을 미치므로 SCR 공정 가동 시에 적정량이 주입될 필요가 있다고 판단된다.
(4) 질소산화물과 암모니아의 동시 저감 및 N2O의 생성 저감 측면에서 온도 300℃와 NSR 1.2가 최적 운전조건이라고 판단하였으며, 각각의 최적 운전조건을 대표 Mode로 설정하여 실 공정의 운전조건에 따라 Simulation한 결과 NSR 1.2 또는 300℃ 조건에서 NOx의 저감효과를 예상할 수 있었다. 향후 강화되는 질소산화물 배출허용기준을 고려한다면 NSR을 높여 운전하는 것이 더 효과적인 방법이라고 사료된다.
본 연구를 통해 NH3-SCR 공정에 NH3 분해 촉매 적용 시 질소산화물과 암모니아의 동시 저감을 확인할 수 있었다. 고찰한 변수별 각 오염물질의 배출특성 및 최적 운전조건의 도출을 통해 부하변동이 배출시설에서 시설 설계등에 활용할 수 있을 것으로 기대하며 본격적 시설 설치를 위한 추가적 연구가 필요할 것으로 사료된다.
Acknowledgments
본 연구는 시흥녹색기술개발센터의 2017년도 연구개발사업 지원에 의해 이루어진 것이며, 이에 감사드립니다.
References
- Amblard, M., Burch, R., Southward, B.W.L., (1999), The selective conversion of ammonia to nitrogen on metal oxide catalysts under strongly oxidising conditions, Applied Catalysis B: Environmental, 22, p159-166.
-
Blauwens, J., Smets, B., Peeters, J., (1977), Mechanism of prompt no formation in hydrocarbon flames, Symposium (International) on Combustion, 16, p1055-1064.
[https://doi.org/10.1016/s0082-0784(77)80395-0]

- Buscaa, G., Liettib, L., Ramisa, G., Bertic, F., (1998), Chemical and mechanistic aspects of the selective catalytic reduction of NOx by ammonia over oxide catalysts: A review, Applied Catalysis B, 18, p1-36.
-
Djerad, S., Tifouti, L., Crocoll, M., Weisweiler, W., (2004), Effect of vanadia and tungsten loadings on the physical and chemical characteristics of V2O5 - WO3/TiO2 catalysts, Journal of Molecular Catalysis A: Chemical, 208, p257-265.
[https://doi.org/10.1016/j.molcata.2003.07.016]

-
Forzatti, P., (2000), Environmental Catalysis for Stationary Applications, Catalysis Today, 62, p51-65.
[https://doi.org/10.1016/s0920-5861(00)00408-9]

-
Forzatti, P., (2001), Present status and perspectives in de-NOx SCR catalysis, Applied Catalysis A, 222, p221-236.
[https://doi.org/10.1016/s0926-860x(01)00832-8]

-
Heck, R.M., (1999), Catalytic Abatement of Nitrogen Oxides-Stationary Applications, Catalysis Today, 53, p519-523.
[https://doi.org/10.1016/s0920-5861(99)00139-x]

- Kim, K.H., (2007), Denitrification Technology (SCR) Trend and Nano-catalyst, Korean Industrial Chemistry News, 10, p45-59.
- Kim, K.W., (2014a), A study on the selective oxidation study of Pt catalysts for ammonia removal, Department of Environmental energy systems engineering, Kyongki University.
- Kim, N.R., (2014b), Preparation and Thermal Properties of Mullite/Cordierite Nano-Composite, Department of Environmental engineering, Chungbuk University.
- Kobylinski, T.P., Taylor, B.W., (1974), The catalytic chemistry of nitric oxide: Ⅱ. Reduction of nitric oxide over noble metal catalysts, Journal of Catalysis, 33, p376-384.
-
Lee, M.S., Lee, J.B., (2010), Investigation of Elemental Mercury Oxidation on Commercial SCR Catalysts in Flue Gas of Fossil Fired Power Plant, Journal of Korean Society for Atmospheric Environment, 26(3), p245-252.
[https://doi.org/10.5572/kosae.2010.26.3.245]

- Lee, H.Y., (2016), The Reaction Characteristics of NOx/N2O and NH3 in SCR Process with Load Variation, Department of Environmental engineering, University of Seoul.
-
Liuqing, T., Daiqi, Y., Hong, L., (2003), Catalytic performance of a novel ceramic-supported vanadium oxide catalyst for NO reduction with NH3, Catalysis Today, 78, p159-170.
[https://doi.org/10.1016/s0920-5861(02)00322-x]

- Lu, W., Jia, Y., Lv, W., Zhao, Q., You, H., (2014), Color tunable emission and energy transfer in Eu2+, Tb3+, or Mn2+-activated cordierite for near-UV white LEDs, Royal Society of Chemistry, 38, p2884-2889.
-
Mari, M., Domingo, J.L., (2010), Toxic emissions from crematories: A review, Environment International, 36, p131-137.
[https://doi.org/10.1016/j.envint.2009.09.006]

-
Nova, I., Acqua, L.D., Lietti, L., Giamello, E., Forzatti, P., (2001), Study of thermal deactivation of a de-NOx commercial catalyst, Applied Catalysis B: Environmental, 35, p31-42.
[https://doi.org/10.1016/s0926-3373(01)00229-6]

-
Salazar, M., Hoffmann, S., Tillmann, L., Singer, V., Becker, R., Grunert, W., (2017), Hybrid catalysts for the selective catalytic reduction (SCR) of NO by NH3: Precipitates and physical mixtures, Applied Catalysis B: Environmental, 218, p793-802.
[https://doi.org/10.1016/j.apcatb.2017.06.079]

- Yates, M., Martin, J.A., Mariin-Luengo, M.A., Suarez, S., Blanco, J., (2005), N2O formation in the ammonia oxidation and in the SCR process with V2O5 - WO3 catalysts, Catalysis Today, 107-108, p120-125.