제조방법에 따른 NH3-SCR용 V/TiO2의 구조적 특성 제어 및 반응활성 영향 연구
Copyright © 2017 Korean Society for Atmospheric Environment
Abstract
In this study, the activity and structural properties of catalysts prepared by mechanochemical method under dry condition were studied. A dry milling was used as a mechanochemical method. The precursors of vanadium were NH4VO3 and V2O5. The activity and characterization of the catalysts prepared by dry milling were compared with those prepared by impregnation. In addition, the correlation between the catalytic activity and the structural characteristics was observed through XRD, Raman, and H2-TPR analysis. As a result, the monomeric vanadate species exhibited excellent redox characteristics, which were confirmed to be related to the catalytic activity.
Keywords:
De-NOx, V/TiO2, Ball mill, SCR, Mechanochemical method1. 서 론
오늘날 경제가 성장함에 따라 에너지의 사용이 급증하면서 오존층 파괴, 지구의 온난화, 초미세먼지 등의 환경문제가 매우 심각한 상태에 이르고 있다. 이는 인간의 일상생활에 큰 피해를 입힐 뿐만 아니라, LA 스모그 사건, 런던 스모그 사건 등과 같이 환경오염이 인류의 생존을 위협할 수 있기 때문에 세계적으로 중요한 사회문제로 인식되고 있다. 대기오염물질로는 질소산화물 (NOx), 황산화물 (SOx), 휘발성유기화합물 (VOCs), 오존 (O3), 암모니아 (NH3) 등이 있다. 그중 질소산화물 (NOx)은 석탄 화력 발전소, 자동차, 선박, 소각로 등 다양한 시설에서 배출되고 있으며, 대기오염물질 중 가장 많은 양을 배출하고 있다. 질소산화물의 배출은 시정장애 (NO2), 온실효과 (N2O), 산성비의 원인이 될 뿐만 아니라 자외선 존재 하에 산소와 반응하여 광화학 스모그 물질인 PAN, 오존 등의 2차 오염물질을 유발한다 (Koebel et al., 2001; Armor, 1995). 또한 최근 국내에서 문제가 되고있는 초미세먼지 (PM2.5)의 경우 질소산화물이 대기중의 수산화기 (OH), 오존 (O3)과 반응하여 중간생성물인 질산 (HNO3)을 생성하고 암모니아 (NH3)와 한번 더 반응하여 2차적 미세먼지인 질산암모늄 (NH4NO3)을 생성한다. 이처럼 질소산화물이 대기환경에 미치는 영향은 매우 심각하며 이는 인접 국가에도 영향을 미치기 때문에 우리나라 뿐만 아니라 각국의 환경당국은 엄격한 질소산화물 배출 억제를 위한 다양한 정책을 시행하고 있다. 유럽 (EU)의 경우 2030년까지 초미세먼지 (PM2.5), 이산화황 (SO2), 질소산화물 (NOx), 암모니아 (NH3), 휘발성유기화합물 (NMVOC)의 5가지 주요 대기오염물질의 배출규제를 강화한다고 하였으며, 그중 질소산화물은 63% 감축을 목표로 하고 있다. 또한 국내의 경우 환경부에서 발표한 수도권 대기환경관리 기본계획에 따르면 2024년까지 질소산화물 배출량을 ‘24년 전망 배출량’의 37%까지 줄이는 것을 목표로 하고 있다. 따라서 강화된 환경법규에 대해 능동적으로 대처하기 위하여 질소산화물 배출원에서는 경제적인 질소산화물 제거 기술이 요구되고 있는 실정이다.
질소산화물을 제거하는 방법에는 크게 배연가스 처리기술 (연소 후 대책), 연소방식의 제어 (연소기술 개선), 저질소 함유 연료 사용 (연소 전 대책)이 있다 (Cooper and Alley, 2002). 그중 배연가스 처리기술은 다른 제어 방법보다 더 큰 제어효율을 갖는다. 배연가스 처리기술 중 활성이 우수하며 널리 적용되고 있는 기술은 요소수 (Urea)를 사용하여 질소산화물을 제어하는 선택적 촉매 환원법 (Selective Catalytic Reduction; SCR)이다. 선택적 촉매 환원법은 촉매와 더불어 NH3, CO, H2S, H2 가스가 환원제로 사용될 수 있으며, 그중 환원제는 암모니아, 촉매는 TiO2와 바나듐 (Vanadium, V) 산화물의 혼합물을 보편적으로 사용하고 있다 (Kwon et al., 2013). 선택적 촉매 환원법에서 촉매개발은 기술의 핵심이라 할 수 있다. SCR 공정에서 V/TiO2는 대표적 촉매이며 (Bulushev et al., 2001; Suryanarayana, 2001; Gaffet et al., 1995; Radinski et al., 1991; Odenbrand et al., 1986), 물질의 표면·구조·결정에 따라 반응속도 및 선택성의 차이를 나타낸다. 이러한 촉매의 구조적인 특성은 촉매를 제조하는 방법에 따라 크게 달라질 수 있다. 촉매를 제조하는 방법은 매우 다양하고 제조방법에 따라서 촉매의 표면·구조·결정이 달라지기 때문에 적절한 촉매의 제조방법을 선정하여야 높은 활성을 갖는 촉매를 제조할 수 있다. 다양한 촉매 제조방법 중 mechanical milling은 1960년대 상업공정에서 nikel을 기초로 한 산화물 분산 강화합금의 생산을 위해 사용되기 시작하였다 (Artz and Schult, 1991). 또한 2003년에는 분말의 mechanical milling을 통한 공정시간 단축과 산화를 줄일 수 있다고 하였다. 또한 분말의 분쇄 및 metal oxide의 합성을 위한 mechanical milling은 nanocrystalline 물질을 생산하는 방법으로, 이를 통하여 분말의 입자크기를 크게 줄이고 lattice strain이 증가될 수 있다고 하였다 (Weeber and Pradhan, 2003).
따라서 본 연구에서는 기계·화학적 방법을 적용하여 V/TiO2 촉매 제조 시 구조해석을 통하여 미세구조 변화에 따른 활성의 변화를 연구하였다. 이를 위하여 지지체는 동일 TiO2를 사용하였고, 다양한 기계·화학적 방법으로 제조한 V/TiO2 촉매와 함침법으로 제조한 촉매의 반응활성 및 물리화학적 특성을 비교하였다. 또한 활성이 우수한 촉매를 이용하여 또 다른 기계·화학적 방법인 attrition mill과 반응활성의 차이 및 활성 차이의 원인을 나타내었다.
2. 실 험
2. 1 촉매 제조방법
본 연구에 사용된 촉매는 vanadium (V)을 활성금속으로 사용하였으며, 지지체로는 상용 TiO2 (millennium Co. DT51)로 제조하였다. 촉매 제조방법은 습윤 함침법 (wet impregnation method)을 사용하였다. 활성금속의 양은 지지체에 대한 무게비로 담지를 하였고 wt.%로 나타내었으며, 활성금속의 무게비는 2 wt.%로 담지하였다. 활성금속의 전구체는 ammonium metavanadate (NH4VO3; Aldrich Chemical Co.)를 사용하였으 며, NH4VO3의 용해도를 높이기 위하여 oxalic acid ((COOH)2; Aldrich Chemical Co.)을 사용하였다. 제조방법은 먼저 지지체인 TiO2에 대한 vanadium의 함량만큼 조성비에 따라 계산하고, 계산된 양만큼의 NH4VO3를 60℃로 가열된 증류수에 녹인다. 가열된 NH4VO3 수용액이 식을 때까지 교반한 후 oxalic acid ((COOH)2)를 조금씩 주입하여 pH값이 2.5가 될 때까지 혼합한다. 혼합된 수용액을 30 min 교반 후 준비된 TiO2에 oxalic acid가 혼합된 NH4VO3 수용액을 혼합하고 1 h 이상 교반한다. 이렇게 제조된 slurry를 70℃, 65 mmHg의 조건으로 회전진공증발기 (Eyela Co. N-N series)를 이용하여 수분을 증발시켰으며, 미세기공에 포함된 수분을 완전히 제거하기 위하여 105℃ dry oven에서 24 h 건조시켰다. 건조된 촉매는 공기분위기에서 10℃/min의 속도로 400℃까지 승온한 후 air 분위기에서 4 h 동안 소성하였다. 이와 같이 함침법으로 제조한 촉매는 (NH4VO3) Impregnation으로 표기하였다.
본 연구에서는 촉매를 제조하는 공정에서 촉매의 고른 혼합과 활성금속의 분산도 증가를 위한 ball mill, attrition mill을 이용하였다.
Ball mill의 경우 장치는 크게 ball과 support disk로 구성되어 있다. 본 연구에서는 삼화제도사의 2단 ball mill 장치를 이용하였으며, zirconia 재질의 5 mm, 10 mm, 20 mm 크기의 ball과 2 L 용량의 jar를 사용하였다. BPMR (ball powder mass ratio)은 ball mill의 최대효율을 위해 50 : 1의 비율로 고정하였으며, 350 rpm의 속도로 유지하였다. 활성금속의 전구체는 NH4VO3와 vanadium (V) oxide (V2O5; Aldrich Chemical Co)를 사용하였다. 제조방법은 지지체인 TiO2에 대한 vanadium의 함량은 2 wt.%만큼 계산하고, 계산된 양만큼의 활성금속 전구체를 계산된 TiO2와 함께 jar에 넣고 3 h 동안 분쇄하였다. Ball mill된 powder 혼합물은 10℃/min의 속도로 400℃까지 승온한 후 air 분위기에서 4 h 동안 소성하였다.
Attrition mill 장치는 크게 ball, support disk 그리고 impeller로 구성되어 있으며, 원리상 ball mill에 비하여 높은 energy를 전달할 수 있다. 본 연구에서는 고려소재기술개발(주)의 KMD-1B의 attrition mill 장치를 사용했고, sus 재질의 jar 그리고 zirconia 재질의 ball을 사용했다. BPMR은 50 : 1로 고정하였으며, 500 rpm의 속도로 유지하였다. 활성금속의 전구체는 V2O5를 사용하였다. 제조방법은 지지체인 TiO2에 대한 vanadium의 함량은 2 wt.%만큼 계산하고, 계산된 양만큼의 활성금속 전구체를 계산된 TiO2와 함께 jar에 넣고 3 h 동안 분쇄하였다. Attrition mill된 powder 혼합물은 10℃/min의 속도로 400℃까지 승온한 후 air 분위기에서 4 h 동안 소성하였다.
위와 같이 제조한 촉매에서 ball mill 방법으로 제조한 촉매는 (V2O5) B.M 3 h으로 표기하였고, attrition mill 방법으로 제조한 촉매는 (V2O5) A.M 3 h으로 표기하였다. 또한 전구체를 달리하여 제조한 촉매의 명칭은 ( )에 vanadium 전구체를 각각 NH4VO3, V2O5로 표기하여 나타내었다.
2. 2 실험장치 및 방법
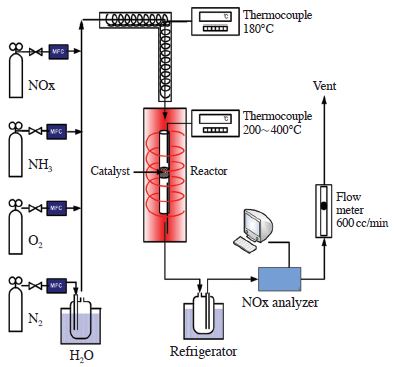
본 연구의 SCR 반응 실험에 사용한 고정층 반응기는 그림 1에 나타내었다. 반응기에 공급되는 가스는 N2, O2, NH3, NO의 가스로 MFC (Mass Flow Controller)를 사용하여 유량을 조절하였다. 또한 circulator를 이용하여 이중 jacket 형태의 bubbler에 40℃ 일정온도의 물을 순환시켰고, N2을 폭기시켜 일정량의 수분을 공급하였다. 또한 폭기된 수분이 응축되지 않고 NH3와 NO가 반응하여 NH4NO2 또는 NH4NO3와 같은 염의 생성을 방지하기 위하여 반응기로 유입되는 가스는 온도를 180℃로 일정하게 유지하였다. 실험 장치의 반응기의 내경은 8 mm이며, 높이 600 mm인 석영관을 사용하였고, 반응기 온도는 200~400℃의 온도를 유지하면서 실험을 수행하였다. 제조된 촉매의 균일성을 유지하기 위해 유압프레스를 사용하여 펠렛한 후 40~50 mesh로 체거름하여 석영 반응기에 0.6 cc를 충진시켰다. 반응물과 생성물의 농도를 측정하기 위하여 NO 농도는 cold trap을 거쳐 수분을 완전히 제거후 비분산 적외선 가스분석기 (Uras10E, Hartman & Braun Co.) 로 측정하고, N2O의 농도는 비분산 적외선 가스분석기 (ULTRAMAT 6, Siemens)로 측정하였다. NO2의 농도는 검지관 (9L, Gas Tec. Co.)을 사용하였으며, 배출되는 NH3는 검지관 (3M, 3La, 3L, Gas Tec. Co.)을 사용하여 측정하였다.
반응 조건은 표 1에 나타내었으며, N2 분위기하에 반응가스 중 NOx의 농도는 800 ppm으로 고정하였다. NH3는 NOx와 1 : 1 비율로 주입하였으며, 반응가스 내의 산소 농도는 전체 주입 가스량의 3 vol.%로 주입하였고, 수분은 전체 주입 가스량의 6 vol.%로 주입하여 총 가스량은 600 cc/min로 유지하였다.
실험방법은 준비한 촉매를 반응기에 충진한다. 그 후 촉매의 산화상태를 균일하게 유지하기 위한 목적으로 400℃에서 1시간 전처리를 수행한다. 실험 온도가 정상상태에 도달하면 일정량의 O2, N2, NO, NH3, 가스를 반응기내로 투입한 후 생성물의 농도가 일정해질 때까지 반응실험을 지속시켜 이때의 농도를 기록한다. 각 촉매의 반응활성은 NOx의 전환율로 나타내었으며 식 (1)과 같이 정의하였다.
| (1) |
*NOx=NO+NO
암모니아 산화 실험의 경우 위와 동일한 조건에서 NOx를 주입하지 않고 NH3를 850 ppm으로 주입하였다. 촉매의 반응활성은 NH3 전환율과 촉매 후단의 NOx 농도 (ppm)로 나타내었으며, NH3 전환율은 식 (2)과 같이 정의하였다.
| (2) |
2. 3 촉매 특성분석
촉매의 결정구조를 분석하기 위하여 실시하였으며, PAN analytical Co.의 X’Pert PRO MRD에 의하여 분석하였다. Radiation source로는 Cu Ka (λ=1.5056 Å)사용했으며, X-ray generator는 30 kW이고, monochromator는 사용하지 않았다. 2 θ는 10~90°의 범위로 6°/min의 주사속도로 측정되었다.
Raman spectra 분석은 argon laser을 light source로 하는 multichannel CCD detector가 장착된 France Jobin사의 Yvon T64000에 의하여 분석하였다. Laser multiline power는 5 W (457.8~514.5 nm)이고 resolution은 0.72 cm-1로 측정되었다.
H2-TPR 분석으로 Micromeritics사의 2920 Autochem을 사용하였으며, 농도 측정을 위하여 TCD (Thermal Conductivity Detector)를 사용하였다. 100 μm 이하로 분쇄된 30 mg의 촉매를 충진한 후 50 cc min-1의 Ar을 흘리며 10℃/min으로 400℃까지 승온 후 30 min 동안 전처리를 수행한다. 그 후 상온 (약 30℃)으로 온도를 하강한 후 5 vol.% H2/Ar 가스를 50 cc/min을 흘리며 촉매 표면의 흡탈착을 안정화시켰다. 이후에 10℃/min의 속도로 800℃까지 승온하며 H2 농도를 TCD를 이용하여 monitoring 하였다.
3. 결과 및 고찰
3. 1 V/TiO2 촉매의 전구체 및 제조방법에 따른 반응활성
선택적 촉매 환원반응에 사용되는 vanadium계 촉매는 일반적으로 함침법과 같은 습식 합성법으로 제조된다 (Cho and Ihm, 2002). 하지만 이러한 방법은 촉매의 결정, 표면 구조를 제어하는 것이 어렵다. 촉매의 반응성은 표면특성에 따라서 활성이 크게 좌우되며, 이는 담체와 활성물질의 종류, 제조방법에 의해 큰 영향을 받는 것으로 알려져 있다. 따라서 서론에서 언급한 바와 같이 본 연구에서는 구조적 특성변화를 제어할 수 있는 기계·화학적 방법을 이용하여 촉매를 제조하였다. Guimaraes 등은 V2O5, TiO2 (Rutile)를 각각 ball mill 함으로써 particle size가 nano size 정도로 줄어든다고 언급하였고, Ti ion은 milling으로 인하여 일부가 환원되어 Ti-O covalence는 감소한다고 언급했다 (Guimaraes et al., 1995). 이러한 연구결과에 따르면 ball mill 방법은 vanadium을 TiO2에 고르게 분산시키고, 이로 인해 비화학양론적인 vanadium 산화물의 변화가 SCR 활성에 영향을 미치는 것으로 사료된다. 따라서 본 절에서는 활성금속을 vanadium으로 하고 담체를 TiO2로 하는 촉매를 ball mill 방법과 함침법으로 제조하여 촉매의 SCR 반응활성을 비교하였다. 또한 ball mill 방법으로 제조 시 전구체의 종류가 촉매활성에 미치는 영향을 확인하기 위하여 NH4VO3와 V2O5로 제조한 촉매의 활성을 그림 2에 나타내었다. 반응실험 조건은 공간속도 60,000 hr-1, NO 750 ppm, NO2 48 ppm, NH3/NOx 1.0, O2 3 vol.%, H2O 6 vol.%, N2 balance, 반응온도 범위는 200~400℃에서 수행하였다.
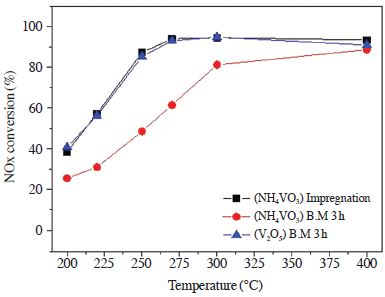
The effect of temperature on NOx conversion over V/TiO2 catalysts (NO: 750 ppm, NO2: 48 ppm, NH3/ NOx: 1.0, O2: 3 vol%, H2O: 6 vol%, S.V: 60,000 h-1).
그림 2의 결과를 살펴보면, (NH4VO3) Impregnation 촉매는 275℃ 이상에서 약 94%의 활성을 나타내었으며, 250℃ 이하의 온도에서 활성이 감소하는 것을 확인할 수 있었다. Ball mill 방법을 이용하여 제조한 촉매 중 (V2O5) B.M 3 h 촉매의 활성이 (NH4VO3) Impregnation 촉매와 비슷한 활성을 나타내는 것을 확인할 수 있었으며, (NH4VO3) B.M 3 h 촉매는 (V2O5) B.M 3 h 촉매에 비하여 활성이 감소하는 것을 확인할 수 있었다. 이처럼 동일한 양의 vanadium을 TiO2에 담지하여 제조된 촉매는 제조방법 및 활성금속의 전구체 종류에 따라 활성의 차이가 나타났음을 확인할 수 있었다. 따라서 위와 같은 활성 차이의 원인을 알아보기 위하여 다음 절에서는 XRD, Raman, H2-TPR 분석을 수행하였다.
3. 2 전구체 및 제조방법에 따른 V/TiO2 촉매특성이 활성에 미치는 영향
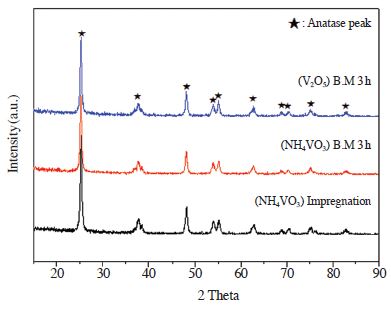
앞 절에서 전구체 및 제조방법에 따른 반응활성의 차이를 확인하기 위하여 분석 중 구조적 특성이 반응활성에 미치는 영향을 확인할 수 있는 XRD, Raman 분석을 수행하였다. 먼저 앞 절에서 비교한 V/TiO2 촉매의 구조를 알아보기 위하여 XRD 분석을 수행하였으며, 그 결과를 그림 3에 나타내었다.
Gajovie 등은 ball mill 시간에 따른 anatase TiO2의 상변화를 확인한 결과 180 min 이후에 rutile peak만 존재한다고 언급하였다 (Gajovie et al., 2001). 그러나 본 연구에서의 XRD 분석결과에 따르면 (NH4VO3) B.M 3 h, (V2O5) B.M 3 h 촉매는 anatase peak의 상전이 현상을 발견할 수 없었으며, (NH4VO3) Impregnation 촉매도 마찬가지로 anatase 상태로 존재하는 것을 확인할 수 있었다. 또한 세 촉매 모두 V2O5 peak를 확인할 수 없었고, 이에 따라 anatase 형태의 TiO2에 vanadium이 고분산 되었음을 판단할 수 있었다.
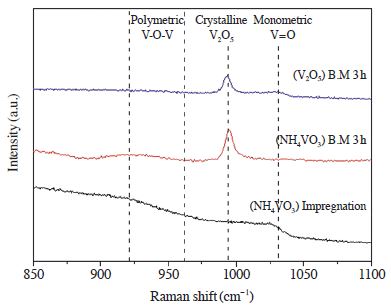
TiO2 담체에 존재하는 vanadium 산화물은 결정질의 crystalline V2O5 그리고 비정질의 polymeric, monomeric의 3가지 형태로 존재한다. 이러한 형태는 Raman 분석을 통해서 구분할 수 있다 (Bulushev et al., 2002). 따라서 앞서 제조한 vanadium 촉매의 형태를 구분하기 위하여 Raman 분석을 수행하였고, 결과를 그림 4에 나타내었다.
Rodellia 등은 vanadium 화합물의 Raman band 중 1033 cm-1에서 나타나는 종은 TiO2 지지체에 직접 결합되어 있는 monomeric vanadate (V4+)종을 나타낸다고 하였다. 또한 연구자에 따라서 약간의 차이는 있으나 850~770 cm-1, 930~920 cm-1, 960~900 cm-1의 broad 한 band에서는 polymeric 종의 V=O vibration으로 언급하였다. 마지막으로 995, 705 cm-1 band는 crystalline V2O5 종이라고 언급하였으며, 특히 995 cm-1은 V=O group이라고 하였다 (Rodellia et al., 2001). Raman 분석 결과 (NH4VO3) Impregnation 촉매의 경우 crystalline V2O5 종이 관찰되지 않았으며, polymeric vanadate와 monomeric vanadate의 생성을 확인할 수 있었다. 반면에 ball mill 방법으로 제조한 촉매는 crystalline V2O5 peak이 관찰되었으며, (V2O5) B.M 3 h 촉매의 경우 polymeric vanadate의 생성은 볼 수 없었으나 monomeric vanadate의 생성은 관찰할 수 있었다. 반대로 (NH4VO3) B.M 3 h 촉매는 polymeric vanadate의 생성은 관찰되었으나 monomeric vanadate의 생성은 볼 수 없었다. 따라서 (NH4VO3) B.M 3 h 촉매는 다른 두 촉매에 비하여 활성이 떨어지는 것을 나타냈기 때문에 polymeric vanadate 종의 생성보다 monomeric vanadate 종이 생성될 때 반응활성이 더 우수한 것으로 판단된다.
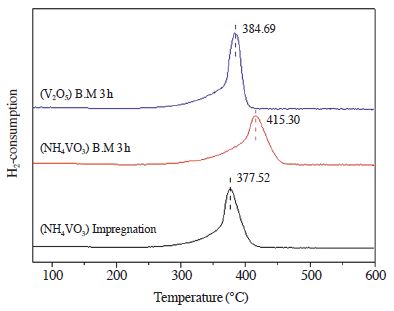
NH3를 환원제로 사용하는 SCR 반응에서 촉매에 NH3가 흡착되면 촉매 내에 산소가 반응에 사용된다. 산소를 사용함으로써 촉매 내에 산소 결함이 생기고 기상의 산소를 이용하여 공석을 채워 반응을 유지하는데, 이러한 redox 특성은 반응에서 매우 중요하다. 따라서 다음은 촉매의 환원 특성을 통해 앞에서 언급한 촉매가 반응에 필요한 산소를 얼마나 쉽게 이용할 수 있는지 확인하고 이를 구조적 특성과 비교하기 위하여 H2-TPR 분석을 수행하였으며, 그림 5에 나타내었다.
H2-TPR 분석 결과 (NH4VO3) Impregnation의 환원 peak가 377.52℃로 가장 먼저 생성된 것을 확인할 수 있었으며, 다음으로 (V2O5) B.M 3 h 촉매가 384.69℃에서 생성되었고, 415.30℃에서 (NH4VO3) B.M 3 h 촉매의 환원 peak를 확인할 수 있었다. 이를 통하여 redox 특성의 증진에 의해 산소를 낮은 온도에서 더 쉽게 사용할 수 있는 촉매가 그림 2에서 확인한 것과 같이 우수한 반응활성을 나타내는 것을 확인할 수 있었다. 또한 monomeric vanadate 종을 형성한 촉매가 polymeric vanadate 종을 형성한 촉매에 비해 낮은 온도에서 환원 peak가 위치하는 것을 보아 monomeric vanadate 종을 형성한 촉매가 산소와 결합이 약하기 때문에 NH3-SCR 반응에서 사용되는 산소를 보다 쉽게 이용함으로써 반응활성이 더 우수한 것으로 판단된다 (Kwon et al., 2013).
3. 3 기계·화학적 방법에 따른 V/TiO2 촉매의 반응활성 및 특성
3.1 절에서 전구체 및 촉매 제조방법의 차이에 따른 SCR 반응활성 차이를 비교해 본 결과 V2O5 전구체를 이용하여 ball mill 방법으로 제조한 촉매가 (NH4VO3) Impregnation 촉매와 함께 우수한 활성을 나타내는 것을 확인할 수 있었다. 기계·화학적 방법은 ball mill 말고도 여러 가지 방법이 존재한다. Jar의 회전을 통한 원심력에 의해 energy를 얻는 ball mill과는 달리 attrition mill의 경우 impeller의 회전으로 더 높은 energy를 전달하여 vanadium을 더 분산시킴으로써 우수한 활성을 얻을 수 있을 것으로 판단된다 (Kwon et al., 2015). 따라서 이번 절에서는 기계·화학적 방법 중 하나인 attrition mill을 이용하여 ball mill로 제조한 촉매와 반응 활성을 비교하여 그림 6에 나타내었다. 촉매의 활성금속은 3.1 절에서 가장 우수한 활성을 나타냈던 V2O5를 사용하였으며, 함량은 담체 대비 2 wt.%만큼 계산하였다. 활성실험은 위와 동일한 공간속도 60,000 hr-1, NO 750 ppm, NO2 48 ppm, NH3/NOx 1.0, O2 3 vol.%, H2O 6 vol.%, N2 balance, 반응온도 범위 200~ 400℃에서 수행하였다.
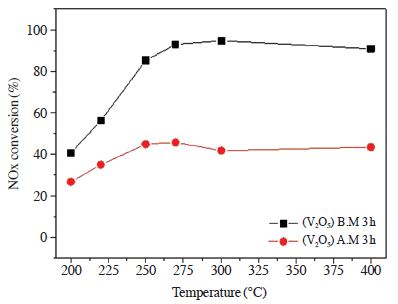
The effect of temperature on NOx conversion over V/TiO2 catalysts prepared by various milling methods (NO: 750 ppm, NO2: 48 ppm, NH3/NOx: 1.0, O2: 3 vol%, H2O: 6 vol%, S.V: 60,000 h-1).
실험 결과 (V2O5) A.M 3 h 촉매는 (V2O5) B.M 3 h 촉매의 반응활성에 비해 전 온도 구간에서 현저하게 감소하는 것을 확인할 수 있었다. 활성이 저하된 원인은 다양한 인자가 존재한다. 그중 유입되는 NH3는 기상의 산소 또는 촉매에 흡착되어 있는 격자산소와 반응하여 산화반응이 일어남으로써 SCR 반응활성을 저하시킬 수 있다. 따라서 그림 7에서는 암모니아 산화 실험을 통하여 NH3 전환율과 반응기 후단에서 배출되는 N2O 가스의 농도를 측정하여 그래프로 나타내었다. 암모니아 산화 실험 조건은 공간속도 60,000 hr-1, NH3 850 ppm, O2 3 vol.%, H2O 6 vol.%, N2 balance, 반응온도 범위 200~400℃에서 수행하였다.
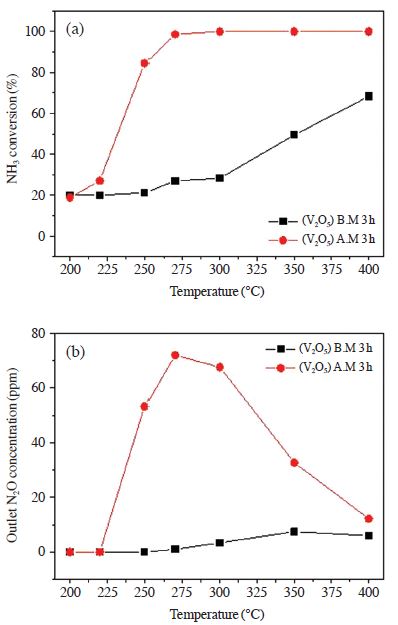
The effect of temperature on NH3 oxidation over V/TiO2 catalysts prepared by various milling methods. (a) NH3 conversion (b) Outlet N2O concentration (NH3: 850 ppm, O2: 3 vol%, H2O: 6 vol%, S.V: 60,000 h-1).
실험 결과 NH3 전환율의 경우 (V2O5) B.M 3 h 촉매는 350℃에서 68%의 NH3 산화를 보였으며 온도가 낮아질수록 점차 감소하여 300℃에서 약 25%의 NH3 산화를 보였다. 반면에 (V2O5) A.M 3 h 촉매의 경우 275℃까지 100%의 NH3 산화를 보였다. 또한 후단에서 생성된 N2O 가스의 경우 225℃ 이상에서 (V2O5) A.M 3 h 촉매가 (V2O5) B.M 3 h 촉매에 비하여 상당히 많은 양을 생성하는 것을 확인할 수 있었다. SCR 반응에서 NH3는 SCR 반응에 사용되는 환원제로서 NO와 반응이 우선되어야 하며, NH3 단독 산화반응은 억제되어야 한다. 그러나 위의 결과와 같이 (V2O5) A.M 3 h 촉매의 경우 NH3의 단독 산화반응이 먼저 일어남으로써 환원제 부족으로 인한 SCR 반응 활성이 저하됨을 판단할 수 있었다. 따라서 기계·화학적 방법을 이용한 촉매 제조에서 가장 우수한 방법은 Ball mill을 이용한 방법임을 확인할 수 있었으며, 촉매 제조 시 V2O5 전구체를 사용하였을 때 활성이 우수한 것을 확인할 수 있었다.
4. 결 론
본 연구에서는 V/TiO2 촉매의 구조적 특성을 제어가 가능한 기계·화학적 방법을 이용하여 촉매를 제조하고 전구체에 따른 반응활성 및 구조적 차이를 확인하였다. 촉매 제조방법은 ball mill과 attrition mill 방법을 이용하여 제조하였으며, 전구체는 NH4VO3와 V2O5를 이용하였다. 반응활성은 V/TiO2 제조 시 일반적으로 사용되고 있는 습윤 함침법과 비교하여 평가하였으며, 반응활성의 원인을 찾기 위하여 XRD, Raman, H2-TPR 분석을 수행하였다. 위의 결과는 다음과 같다.
- 1. NH4VO3와 V2O5 전구체를 사용하여 ball mill 방법으로 V/TiO2 촉매를 제조한 결과 (V2O5) B.M 3 h 촉매가 (NH4VO3) Impregnation 촉매와 우수한 활성을 나타내었다.
- 2. XRD의 결과로부터 TiO2는 anatase 형태로 존재함을 확인할 수 있었으며, V2O5 peak는 확인할 수 없었다. TiO2에 분산되어 있는 vanadium의 화합물을 확인하기 위하여 Raman 분석을 수행한 결과 활성이 우수한 촉매는 monomeric 종이 존재하는 것을 확인할 수 있었으며, H2-TPR을 통하여 monomeric 종을 갖는 촉매가 더 낮은 온도에서 H2 소모 peak가 생성됨을 확인하였다.
- 3. 기계·화학적 방법에서 활성이 우수했던 (V2O5) B.M 3 h 촉매와 attrition mill을 이용하여 제조한 (V2O5) A.M 3 h 촉매를 비교한 결과 (V2O5) B.M 3 h 촉매의 활성이 더 우수한 것을 확인할 수 있었다. (V2O5) A.M 3 h 촉매의 활성 저하의 원인은 NH3 산화에 의한 환원제 부족으로 인해 SCR 반응이 저해되는 것으로 판단하였다.
따라서 V/TiO2 촉매 제조 시 기계·화학적 방법 중 ball mill을 이용한 방법이 가장 우수한 활성을 나타내었으며, 전구체는 V2O5를 이용하였을 때 가장 우수하였다. 또한 SCR 반응에서 V/TiO2 촉매는 vanadium 화합물이 crystalline V2O5 종에서 monomeric 종으로 이동할 때 반응활성이 더 우수하였다. 이는 H2-TPR 결과를 통해 판단할 때 생성된 monomeric 종은 산소와의 결합이 약하게 형성됨으로써 redox 특성의 증진되었고, 이로 인해 더 낮은 온도에서 SCR 반응에 필요한 산소를 사용할 수 있기 때문인 것으로 판단된다.
Acknowledgments
본 연구는 환경부 Global-Top Project “고효율 복합 SCR/AOC 촉매개발” (과제번호: 2016 0020 80004) 과제의 지원에 의해 수행되었으며 이게 감사드립니다.
References
-
Armor, J.N., (1995), Catalytic Removal of Nitrogen Oxide: Where Are the Opportunities?, Catalysis Today, 26, p99-105.
[https://doi.org/10.1016/0920-5861(95)00132-y]

- Artz, E., and L. Schult, (1991), New materials by mechanical alloying techniques, Material and Manufacturing Process, 6, p733-736.
- Bulushev, D.A., L. Kiwi-Minsker, F. Rainone, and A. Renken, (2002), Characterization of surface vanadia forms on V/TiO2 oxide catalyst via Temperature-Programmed reduction in hydrogen and spectroscopic method, Journal of Catalysis, 205, p115-122.
-
Cho, C.H., and S.K. Ihm, (2002), Development of new vanadiumbased oxide catalysts for decomposition of chlorinated aromatic pollutants, Environmental Science & Technology, 36, p1600-1606.
[https://doi.org/10.1021/es015687h]

- Cooper, C.D., and F.C. Alley, (2002), Air pollution control: A Design approach, Waveland Press.
-
Dutta, H., and S.K. Pradhan, (2003), Microstructure characterization of high energy ball-milled nanocrystalline V2O5 by rietveld analysis, Materials Chemistry and Physics, 77, p868-877.
[https://doi.org/10.1016/s0254-0584(02)00169-4]

- Gaffet, E., M. Abdellaoui, and N. Malhouroux-Gaffet, (1995), Formation of nanostructural materials induced by mechanical processings, Materials Transactions JIM, 36, p198-209.
- Gajovie, A., M. Stubicar, M. Ivanda, and K. Furic, (2001), Raman spectroscopy of ball-milled TiO2, Journal of Molecular Structure, 563, p315-320.
-
Koebel, M., M. Elsener, and G. Madia, (2001), Reaction pathway in the selective catalytic reduction process with NO and NO2 at low temperatures, Industrial & Engineering Chemistry Researtch, 40, p52-59.
[https://doi.org/10.1021/ie000551y]

-
Kwon, D.W., K.H. Park, and S.C. Hong, (2013), The influence on SCR activity of the atomic structure of V2O5/TiO2 catalysts prepared by a mechanochemical method, Applied Catalysis A: General, 451, p227-235.
[https://doi.org/10.1016/j.apcata.2012.09.050]

-
Kwon, D.W., S.M. Lee, and S.C. Hong, (2015), Influence of attrition milling on V/Ti catalysts for the selective oxidation of ammonia, Applied Catalysis A: General, 505, p557-565.
[https://doi.org/10.1016/j.apcata.2015.02.007]

- Odenbrand, C.U.I., L.A.H. Anderson, J.G.M. Brandin, and S.T. Lundin, (1986), Catalytic reduction of nitrogen oxide: 2. the reduction of NO2, Applied Catalysis, 27, p363-377.
-
Radlinski, A.P., A. Calka, B.W. Ninham, and W.A. Kaczmarek, (1991), Application of surface active substances in mechanical alloying, Materials Science and Engineering: A, 134, p1346-1349.
[https://doi.org/10.1016/0921-5093(91)90988-y]

-
Rodella, C.B., P.A.P. Nascente, R.W.A. Franco, C.J. Magon, V.R. Mastelaro, and A.O. Florentino, (2001), Surface characterization of V2O5/TiO2 catalytic system, Physica Status Solidi A, 187, p161-169.
[https://doi.org/10.1002/1521-396x(200109)187:1<161::aid-pssa161>3.0.co;2-x]

- Suryanarayana, C., (2001), Mechanical alloying and milling, Progress in Materials Science, 46, p1-184.