염소계 VOCs의 UV 광분해 연구:
제거율 및 부산물
Removal Efficiency and Products
Copyright © 2017 Korean Society for Atmospheric Environment
Abstract
In this study, 4 gases containing typical chlorinated volatile organic compounds (VOCs) were treated by ultraviolet (UV) irradiation. The typical chlorinated VOCs are dichloromethane (DCM), trichloromethane (TCM), carbon tetrachloride (CTC) and trichloroethylene (TCE). The removal efficiency (RE) and the products of chlorinated VOCs by UV irradiation are investigated. At this time, 2 types of background gas (air and nitrogen) were used to figure out the RE by photooxidation and photolysis. The specification of UV-lamp used in this study was low-pressure mercury lamp emitting wavelength of 185~254 nm. The experimental conditions were set as initial VOC concentration of 180±10 ppm, empty bed retention time (EBRT) of 53 s, temperature of 23±2℃ and relative humidity of 65±5%. In the photolysis condition with nitrogen (N2) as background gas, the averaged RE of the 4 types of chlorinated VOCs was about 24% higher than that with photooxidation; and the REs of VOCs except CTC were confirmed as >99%. The composition of off-gases after UV photooxidation in air was investigated and several intermediates from DCM, TCM and TCE were detected by GC/MS. Among them, phosgene which is a toxics was detected as an intermediate of TCM. In addition, the concentration of carbon dioxide (CO2) in the offgases was measured to calculate the mineralization rate (MR). With the photooxidation, TCE showed the highest RE (>99%) while MR was the lowest (17%); and the MR of DCM was the highest (86%). In addition, particulate matters (PM) in the off-gases was also detected and high concentrated PM10 (21,580 μg·m-3) and PM2.5 (6,346 μg·m-3) were detected in TCE off-gas. More than 99% of the chlorinated VOCs could be removed using UV254-185 nm lamp, while it is necessary to conduct further studies on the production and treatment of secondary pollutants.
Keywords:
Photodegradation, Ultraviolet, Chlorinated VOCs, Particulate matter, Intermediate1. 서 론
한국은 급속한 산업화와 1960년대 후반부터 발달하기 시작한 중공업에 의해 심각한 대기오염 문제에 직면해 왔다 (Lee et al., 2015). 대기오염은 자연환경 및 인간에게 많은 피해를 주어 한번의 노출로 급성으로 피해가 나타날 수도 있고, 반대로 수개월 수년간의 노출이 지속되면서 만성으로 피해가 나타날 수 있다. 만성인 경우 노출시점이 불분명하고 이로 인한 질병의 시작시점을 결정하기 어려우며, 질병의 시작부터 발현까지의 기간이 길어 노출과 질병 발생과의 원인적 연관성을 파악하는 것이 쉽지 않다. 그래서 우리정부는 사업장에 굴뚝자동측정장치 (TMS)를 부착하여 모니터링을 함과 더불어 주기적 (5년)으로 배출허용기준을 강화하고, 또 수도권에 한정되어 있기는 하지만 사업장 총량제를 도입하여 배출농도 삭감에 노력하고 있다 (Gong et al., 2014). Gong et al. (2014)은 이런 규제로 사업장의 오염물질이 감소된 것을 확인 하였다고 한다. 하지만 인간의 기본권을 유지하기 위한 엄격한 규제는 역효과를 불러 올 수 있다. 그래서 많은 연구자들의 노력으로 대기오염 저감기술의 개발과 발전이 이루어지고 있으며, 현재 대기오염 저감기술에는 크게 활성탄흡착, 연소, 바이오필터 등이 있다. 활성탄흡착은 분해 기술이 아닌 기공에 오염물질을 흡착시켜 배출되지 않도록 하는 기술인데 오염물질의 농도에 따라 활성탄의 수명은 반비례하며, 폐활성탄의 처리가 문제시 되는 단점이 있다. 연소기술은 높은 운전비용과 설치비용이 가장 큰 단점이며, 바이오필터 기술은 고온, 고압, pH 등에 따라 미생물의 생장 환경에 영향을 주어 오염물질 처리에 어려움이 있으며 난분해성 물질이 존재한다. 이처럼 현재 많은 대기오염 방지시설이 개발되어 운행 중이지만, 한 종의 방지시설로 오염물질을 완벽히 처리하는 기술은 극히 드물며, 많은 단점을 갖고 있다. 그래서 여러 대기오염 방지기술의 단점을 보완하기 위해 1990년 이후부터 현재까지 새로운 VOCs 처리기술로 UV를 이용한 광분해 연구가 활발히 진행되어 있으며 (Lee et al., 2010; Wei et al., 2010; Wang et al., 2009; Moussavi and Mohseni, 2007) 등은 바이오필터의 전처리 장치로 UV 광분해 기술을 적용한 결과 제거율이 상승하였다고 보고하였다.
이처럼 UV광분해 기술은 빛을 쬐어주는 것만으로 오염물질의 분해가 가능한 기술로 운전비가 저렴한 환경 친화적인 기술로 알려져 있다 (Kam et al., 2014). UV를 이용한 VOCs 제거 시 배경가스에 따라 다른 메커니즘으로 VOCs 분해가 이루어진다. 배경가스가 질소일 경우 배경가스에 산소가 없어 185 nm 파장이 비활성화 되어 254 nm 파장의 광분해만 이루어지지만, 배경가스가 공기일 때는 185 nm의 광자가 산소를 분해하여 오존, OH라디칼 등 다른 활성 화학물질을 생성하여 185~254 nm의 광자가 모두 활성화 되어 광산화 및 광분해 반응이 동시에 이루어진다. 아래 식은 공기 중 산소가 185 nm 광자를 흡수하여 오존을 생성하고 다시 오존이 254 nm 광자를 흡수하여 O2로 환원되는 반응식이다 (Chen et al., 2002).
| (1) |
| (2) |
| (3) |
| (4) |
또한 아래 식은 공기중의 수분이 185 nm 광자를 흡수하면 물 분자가 분해되어 OH 라디칼이 생성된다는 반응식이다 (Chen et al., 2002).
| (5) |
| (6) |
또한 광분해 처리는 크게 두 가지 방법으로 나눌 수 있는데 하나는 스테인리스로 제조된 반응기에 UV램프 만을 삽입하여 분해하는 광분해와 다른 하나는 광분해와 같은 조건에 반응기 내에 촉매제를 도포하여 광화학 반응을 촉진시켜 분해한다는 이점을 가진 광촉매 장치가 있다. 하지만 Cao et al. (2000)과 Rafael and Nelson (1998)은 톨루엔의 광촉매 반응 시 생성되는 중간생성물 benzoic acid가 촉매에 침적되어 촉매의 비활성화가 발생했다고 보고하였으며, 또 Larson and Fal-coner (1994)는 TCE의 중간생성물인 dichloroacetyl chloride (DCAC)가 TiO2에 강하게 흡착되어 TCE의 흡착을 감소시킨다고 보고하였다. 이처럼 광촉매 장치가 광분해 장치보다 같은 조건에서 VOCs 제거에 효율이 더 좋을 수 있지만, Rafael and Nelson (1998)이 보고했듯이 VOCs 분해나, 중간생성물 생성, 부산물의 생성기작 분석에는 어려움이 따른다. 또 광촉매 장치는 반응 후 배출되는 중간생성물의 물질수지를 파악하기에도 어려움이 있다. 물질수지의 분석이 이루어지면 배출되는 오염물질의 2차 처리장치 선택에 많은 도움이 될 것이라 사료된다. 또한 Wang et al. (2008)은 난분해성 물질인 클로로벤젠을 바이오필터 단독처리보다 UV를 이용한 복합처리 시 제거율이 30% 상승하였다고 보고하였고, Mohseni (2005)는 TCE를 광분해 시 짧은 체류시간 1.5 s면 99% 제거된다고 보고하였다. 따라서 본 연구에서는 난분해성 물질의 UV 254~185 nm 에 의한 제거율을 알아보고, 또한 같은 족 VOCs의 UV램프에 대한 반응 차이를 알아보기 위해 4종의 염소계 VOCs (CTC, TCE, TCM, DCM)를 선택하였다. 또 두 가지 다른 배경가스 (공기, 질소)에서 VOCs 제거에 대한 광산화 및 광분해의 반응 기여도를 확인하였으며, UV 반응기에서 배출되는 가스를 채취하여 부산물에 대한 연구를 하였다. UV램프를 이용한 VOCs 제거실험 시 중간생성물로 여러 종류의 VOCs물질이 분해 배출되기 때문에, GC/MS를 이용하여 중간생성물을 분석하였고, 중간생성물 외에도 UV 광분해 하에서 생성 배출되는 CO2와 PM에 대해서도 연구하였다.
2. 재료 및 방법
2. 1 휘발성 유기화합물의 선택
표 1에 본 연구에서 사용한 4종의 염소계 VOCs와 기본 특성인 분자식, 분자량 및 끓는점을 수록하였다. 사용된 VOCs는 산업용의 순도 99% 이상의 제품 (Beijing Modern oriental Fine Chemistry Corporation, China)을 사용하였다.
2. 2 실험 장치 및 절차
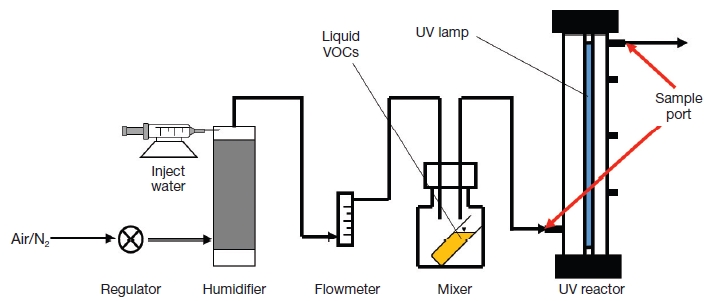
그림 1은 본 연구에 사용된 실험장치의 장치도이다. UV 반응기는 스테인리스로 만들었으며, 제원은 내경 50 mm, 높이 450 mm로 유효부피 0.883 L인 장치를 사용하였다.
UV램프는 오존을 생성하는 254~185 nm 파장을 방출하는 저압수은 램프 (Cnlight, ZW23D15Y-Z436, China)를 사용하였다. 램프의 직경은 15 mm, 길이 436 mm, 전류 420 mA, 1 m 거리에서 254 nm 자외선 조도가 62 μW·cm-2이며, 단위 길이의 복사 전력은 52.3 W·m-1인 것을 사용하였다. 또한 광산화와 광분해의 제거효율을 알아보기 위해 배경가스는 공기와 질소 (순도 99.999%)를 선택하였고, 가스의 습도를 조절하기 위해 실리지 펌프 (LongerPump, TJ-3A Single Channel Syringe Pump, China)를 사용하여 증류수를 주입하였다.
VOCs농도의 제조는 유리관 (I.D. 15×Length 100 mm)에 액상의 VOCs를 10 mL 주입 후, VOCs용액의 온도 조절을 위해 마개가 있는 부피 500 mL 유리병에 유리관 높이의 1/5 정도 높이로 증류수를 넣고 그 다음 준비해 놓은 VOCs 용액이 담긴 유리관을 유리병 안에 넣고, 온도 조절이 가능한 교반기 (Talboys, EPFO-985546, USA) 위에 유리병을 올려 온도 조절기능만 사용하여 온도를 20℃로 설정하여 VOCs의 농도를 조절하였다. 또한 4종 VOCs는 물성이 달라 VOCs 용액이 담긴 유리관을 유리병에 개수를 다르게 하여 담았는데 적게는 1개에서 많게는 10개까지 넣어 VOCs 용액의 휘발되는 표면적을 다르게 하여 설정된 농도를 맞추었다.
실험 절차는 유속 0.06 m3·h-1, 실내온도 온도 23±2℃, 상대습도 65±5%, 각각의 VOCs DCM, TCM, CTC, TCE의 농도는 180±10 ppm으로 유지하여 UV 반응기에 연속적으로 공급하였다. 각 실험은, 먼저 UV램프가 꺼진 상태에서 VOCs 가스의 유속 및 유입 농도가 미리 결정된 수준에서 일정하게 유지되게 만든 다음 UV램프의 안정화를 위해 UV램프 켜고 30분간 VOCs를 흘려 보낸 후, 가스시료를 UV 반응기의 입구와 출구에서 채취하여 분석하였다.
2. 3 분석 방법
VOCs농도 측정은 모세 컬럼 (ULBON, HR-1 0.25 mm×30 m, Japan)이 장착된 불꽃 이온화 검출기 (FID)인 가스크로마토그래프 (Shimadzu, GC-14B, Japan)를 이용하여 측정하였다. GC-14B의 캐리어가스는 질소의 유량을 60 mL·min-1로 하였으며, 불꽃 이온화 검출기에는 수소가스 (purity>99.999%, 35 mL·min-1)와 산소 (350 mL·min-1)를 공급하였다. 컬럼, 입구 및 검출기의 온도는 각각 100, 150, 150℃로 하였다. 정량분석을 위해 각각의 표준가스는 최소 3회 반복 측정하여 검량선을 준비하였다.
반응기에서 배출된 중간생성물은 가스타이트 실린지를 이용하여 0.2 mL를 채취하여 모세 컬럼 (5 m×0.1 mm×0.4 μm, DB-5 ms)이 장착되어 있는 휴대용 GC/MS (Focused Photonics Incorporated, Mars-400, China)를 사용하여 분석하였다. 이때 GC/MS의 컬럼 오븐, 주입구 및 검출기의 온도는 각각 150, 150, 70℃로 설정하여 분석하였다.
출구로 배출되는 오존의 농도는 UV흡광도 검출에 기초하여 오존 모니터 (2B Technologies, 106-M, USA)를 사용하여 측정하였고, 온도 및 습도 측정은 디지털 습도계 (Testo, 605-H1, Germany)로 측정하였다. UV 반응기의 입·출구의 CO2농도 측정은 적외선 센서를 장착한 CO2 검출기 (Testo, Testo 535, Germany)를 사용하여 측정하였다. PM2.5와 PM10의 측정은 입자계수기 (Shenzhen Everbest Machinery Industry, DT-9880, China)를 사용하였다.
3. 결과 및 고찰
3. 1 VOCs의 제거율
본 실험에 사용된 UV254-185 램프는 배경가스에 따라 두 종류의 반응이 이루어진다. 그래서 두 종류의 반응, 광산화와 광분해에 대한 각각의 제거성능을 알아보기 위해 공기와 질소를 배경가스로 선택하여 VOCs의 제거율을 알아보았다. 표 3에 염소계 물질 4종의 광산화, 광분해에 대한 제거율 및 제거 기여도를 계산하였다.
광산화, 광분해에 반응에 대한 입·출구농도를 측정한 결과 4종 염소계 VOCs의 전체 평균제거율이 광산화일 때는 66%이었고, 광분해일 때는 80%로 측정되어 광산화보다 광분해일 때 제거율이 높은 것으로 확인되었다. 광산화일 때 TCE가 가장 높은 제거율 (>99%)을 보였으며, 반대로 사염화탄소 (CTC)가 가장 낮은 제거율 (40%)을 보였다. 광분해일 때는 4종 VOCs 중 3종의 VOCs가 >99%의 제거율을 보였으며, 가장 낮은 제거율 (19%)을 보인 VOCs는 광산화일 때와 마찬가지로 CTC였다. 또한, 표 3의 REN2/REair의 의미는 광분해 제거율에 광산화 제거율을 나눈 값이다. 이 계산은 계산 값이 1을 초과하는 것은 반응기 안에서 광산화와 광분해가 동시에 이루어지는 것보다 광분해 시 대상 VOCs의 제거가 잘 이루어진다는 것이며, 1일 때는 광분해, 광산화 모두에서 같은 제거율을 보인다는 것이며, 1 미만은 광분해만 이루어질 때보다 광산화가 동시에 이루질 때 VOCs의 제거가 잘 된다는 의미이다. 따라서 광분해의 제거율에서 광산화의 제거율을 나누면 DCM과 TCM은 1을 초과하는 계산 값이 나와 광분해 시 높은 제거율을 얻을 수 있는 것으로 확인되었으며, TCE는 계산 값이 1이 나와 두 반응 모두 같은 제거율을 보였으며, 나머지 1종 CTC는 1 미만의 값으로 광분해보다는 광산화가 동시에 이루어질 때보다 높은 제거율이 나타나는 것으로 확인되었다.
결과를 종합해 보면 CTC는 광산화 시 40%, 광분해 시 19%로 광산화 시 제거율이 더 높았지만 높은 제거율은 아니라 판단되어 현재 실험조건으로의 CTC 제거는 광산화, 광분해 반응 모두에서 적합하지 않은 방법이라 생각된다. 또한 Mohseni (2005)는 분자구조의 C=C 이중결합은 오존과 강하게 반응한다고 보고하였는데, 본 연구에서도 C=C 이중결합 구조를 가진 TCE만이 광산화 반응에서 >99%의 제거율을 보인 것으로 사료된다. 반면, DCM과 TCM은 광산화 반응보다 광분해 반응에서 제거율이 높았는데, 이유는 태양빛 중 310 nm 이하의 단파장이 성층권의 오존층에서 흡수되어 소멸되듯이, 광산화 반응에서 185 nm 파장에 의해 생성된 오존이 254 nm의 복사량을 저해하여 254 nm 광자와의 충분한 반응이 이루지지 못해 광산화 반응에서 제거율이 더 낮은 것으로 사료된다. 또 광분해 반응에서 CTC를 제외한 나머지 물질에서 >99%의 제거율을 확인할 수 있었는데, 사용된 4종 VOCs 특성을 비교해 본 결과 다른 물질과 다르게 CTC는 수소원자를 보유하지 않는 것으로 확인되어 광분해 시 수소원자의 유무는 제거율에 많은 영향을 주는 것으로 사료된다.
3. 2 중간생성물
VOCs가 UV 반응기에 의해 분해될 때, VOCs 물질은 CO2로 변환될 수 있다. 하지만 VOCs의 일부를 CO2로 배출시키고, 나머지 부분은 새로운 중간생성물로 전환된다.
VOCs 광분해 과정에서 많은 새로운 중간생성물이 생성되는데 반응 후 배출가스의 중간생성물 및 부산물은 백색 연기 형태로 육안으로 확인할 수 있었으며, 또한 염소계 VOCs의 UV 광분해 시에는 갈색의 중간생성물이 관벽에 흡착되어 있는 것을 확인하였다. 갈색의 중간생성물은 반응기 안의 램프에도 부착되어 램프의 수명을 단축시켰으며, 또 반응기의 출구에도 많은 량이 흡착되어 반응기 내의 압력을 상승시켰다. 또한 염소계 물질의 배출가스는 부산물 측정을 위해 사용된 분석장치들의 수명도 단축시켰다. 이는 염소계 물질의 배출가스에서만 볼 수 있는 갈색 부산물이 원인으로 판단된다. 그래서 GC/MS를 이용하여 중간생성물을 확인하였다.
4종의 VOCs중 제거율이 가장 낮은 CTC를 제외한 3종 (DCM, TCM, TCE)의 VOCs에서 중간생성물이 GC/MS에 의해 검출되었다. 기존 문헌에 보고된 중간생성물 외에도 많은 새로운 중간생성물이 검출되었다.
그림 2는 3종 VOCs의 GC/MS chromatogram이다.
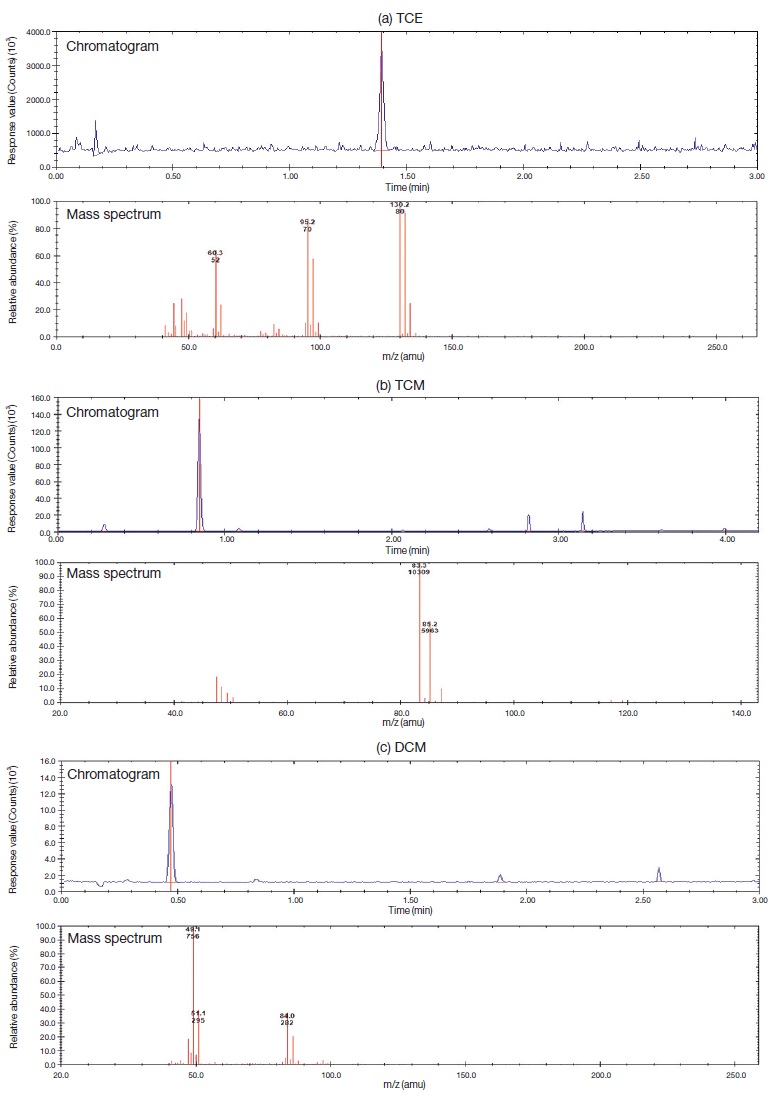
GC-MS chromatogram and mass spectrum of intermediates produced by photodegradation of 3 chlorinated VOCs.
검출된 3종 VOCs의 중간생성물 및 그 특성은 표 4에 열거하였다.

Detected intermediates produced by photodegradation of 3 chlorinated VOCs in this study and from the literature.
표 4에서 보듯이 많은 중간생성물이 다양한 화학물질로 분해 결합하여 검출되었다. 검출된 3종의 VOCs 중 DCM과 TCE는 각각 1종의 물질만이 검출되었는데 DCM의 중간생성물로 검출된 1,1,2,2-Tetrachloroeth-ane는 TCM의 중간생성물에도 포함되어 있었다. 또한 TCM의 중간생성물은 8개의 다양한 화학물질이 생성 배출되었으며, 그중 본 연구에서는 1차 세계대전에서 독가스로 사용되었던 포스겐이 TCM의 광분해 중간생성물로 검출되었지만, Mohseni (2005)는 TCE의 중간생성물로 보고한 바 있다. 또한 Mohseni (2005)는 실험조건을 체류시간 3.5 s, 초기농도 85 ppm으로 광분해 실험 시 TCE의 중간생성물로 포스겐을 발견하였지만, 본 연구의 실험조건인 체류시간 53 s, 초기농도 180 ppm에서는 TCE의 중간생성물로는 포스겐이 발견되지 않았다. 이는 체류시간에 따라 중간생성물의 생성 및 분해에 대한 변화가 이루어진다는 Mohseni (2005)의 내용을 뒷받침 하는 결과로 기존의 보고된 연구와 본 연구에서의 실험조건이 달라 중간생성물의 배출도 다르게 나타났음을 알 수 있다. 또한 아래 식은 포스겐이 빛에 의해 분해되어 CO2로 변환하는 반응식이다 (Chen et al., 2002).
| (7) |
| (8) |
| (9) |
본 연구결과와 보고된 결과를 종합해보면 광분해 시 실험조건에 따라 배출되는 중간생성물이 다를 수는 있지만, 대부분의 염소계 물질은 중간생성물로 유독가스인 포스겐이 배출될 가능성은 매우 높을 것으로 판단된다. 하지만 위의 반응식 (7, 8, 9)과 Mohseni (2005)의 결과 및 본 연구 결과를 종합해 보면 중간생성물로 포스겐이 배출될 시 포스겐의 배출을 방지하기 위한 하나의 방법으로 체류시간을 늘리면 포스겐이 CO2로 변환되어 배출량이 적어질 것으로 사료된다. 하지만 포스겐 이외에 아직까지 밝혀지지 않은 유독가스들이 많을 것이라 판단되어 배출가스에 대한 GC/MS를 이용한 성분 분석과 동시에 생물독성시험도 이루어지면 더 좋은 연구결과를 가져올 수 있을 것이라 판단된다.
3. 3 이산화탄소
제거율은 대상 VOCs의 주입농도와 배출농도의 차를 계산한 것으로 제거된 VOCs에는 완전분해되지 않고 배출되는 중간생성물과 완전분해 되어 배출되는 CO2가 존재한다. 따라서 VOCs의 무기화율을 알아보기 위해 CO2의 농도를 측정하였으며, 무기화율의 계산은 아래와 같다.
| (10) |
MR: Mineralization rates (%)
CO2: Carbon dioxide (ppm)
VOCsi: Inlet VOCs concentration (ppm)
RE: Removal efficiency (%)
NoC: Number of Carbon in VOCs
표 5는 4종 VOCs에 대한 CO2 배출량 및 무기화율 (Mineralization rates, MR)을 보여준다.
CO2의 배출량은 49~90 ppm으로 매우 낮은 농도로 배출되었으며, 평균 제거율이 가장 낮았던 CTC가 가장 적은 양의 CO2를 배출하였으나, 가장 높은 CO2를 배출한 물질은 제거율이 가장 높았던 TCE가 아닌 DCM, TCM이 각각 87, 90 ppm으로 다른 물질들보다 높은 양의 CO2를 배출하였다. 따라서 가장 높은 무기화율을 가진 물질은 DCM으로 86%이었으며, 반면 TCE의 무기화율은 17%로 매우 낮은 무기화율을 보였다. 결과를 종합해보면 분자량이 클수록 CO2의 배출량은 낮은 것으로 확인되었다.
3. 4 미세먼지
대기 중 미세먼지에 장기간 노출되는 것이 폐 기능저하에 영향을 줄 수 있다는 연구 (Rosenlund, 2009; Rundell et al., 2008)가 있다. 그래서 4종 염소계 VOCs 배출가스의 PM2.5와 PM10의 농도를 측정한 결과값을 표 6에 나열하였다.
4종의 VOCs 중 본 연구의 실험조건에서는 TCE의 배출가스에서만 PM2.5와 PM10이 각각 6,346 μg·m-3과 21,580 μg·m-3로 검출되었다. 또한 표 6에는 수록하지 않았지만 본 연구의 실험조건인 초기농도 180 ppm이 아닌 초기농도를 300 ppm 이상으로 농도를 올려 실험하였을 때는 검출되지 않았던 나머지 물질에서도 PM이 검출되었다. 그래서 TCE에서만 검출된 원인을 알아보면 다른 3종 물질과 다르게 탄소수가 2배 많았으며 3. 3항에서도 말했듯이 낮은 무기화율을 나타낸 물질이기도 하다. 이처럼 화학물질이 탄소원자를 많이 갖고 있거나 무기화율이 낮으면 UV램프와 반응 시 PM의 배출량도 많을 것으로 사료된다. 이로써 이번 실험에 사용된 물질들은 UV램프와 반응 후 PM이 생성되는데 탄소의 함량이 많을수록 많은 PM을 배출한다는 것을 확인하였다. 따라서 UV광분해 연구 시 배출되는 PM의 처리에 대한 연구도 필요하다고 생각된다.
3. 5 탄소 물질수지
3. 3항은 4종 염소계 VOCs의 무기화율을 알아보았고, 본 항에서는 각각 VOCs의 UV조사에 의해 변환된 물질의 비율을 알아보기 위해 배출가스의 탄소 물질수지를 계산하였다. 탄소의 비율 계산은 다음과 같다.
| (11) |
| (12) |
| (13) |
RE: Removal efficiency (%)
CO2o: Outlet CO2 concentration (ppm)
CO2i: Inlet CO2 concentration (ppm)
VOCi: Inlet VOCs concentration (ppm)
NoC: Number of Carbon in VOCs
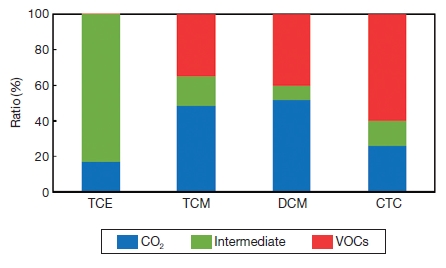
그림 3은 본 연구의 실험결과들을 종합하여 4종 염소계 VOCs의 탄소물질수지를 계산한 그래프이다. 그래프는 3개의 항목 (VOCs, 중간생성물, 무기물)으로 나눠 그려보았다.
표 3에서 보는 바와 같이 TCE는 >99%의 제거율을 보였지만, 제거된 >99% 중 CO2의 배출량은 17%로 4종 물질 중 가장 적었으며, 나머지 82%가 중간생성물로 배출되어 중간생성물의 배출이 가장 많은 것으로 확인되었다. 그와 반대로 DCM은 60%의 제거율을 보였지만 가장 많은 양 (52%)의 CO2를 배출하였으며, 중간생성물 또한 가장 적은 8%를 배출하였다. TCM은 제거율이 65%이었는데 그중 48%가 무기화되었고, 17 %만이 중간생성물로 배출되었다. 마지막으로 제거율이 40%로 가장 낮은 CTC는 26%의 CO2를 배출하였으며, 14%의 중간생성물을 배출하였다. 따라서 TCE의 경우 UV반응기에서 >99% 제거는 되었지만 중간생성물에서 무기물 (CO2)로 변화하여 배출하기에는 본 실험조건인 체류시간 53 s로는 부족한 것으로 판단된다. 또한 3. 2항에서 CTC만 중간생성물을 찾지 못하였는데, 그 이유로 초기농도 180 ppm에서 약 25 ppm (14%)이 중간생성물들로 전환되어 배출되었는데 이는 여러 종류로 배출되는 중간생성물들이 분석기기의 MDL 값 이하로 배출되어 분석에 어려움이 있었던 것으로 사료된다. 결론적으로 UV광분해 시 제거율도 중요하지만 2차 오염물질로 생성 배출되는 중간생성물과 CO2를 측정하여, 완전분해를 위한 광분해장치의 실험조건 설정에 많은 도움이 될 것이라 판단된다.
4. 결 론
본 연구에서는 염소계 VOCs에 배경가스를 다르게 하여 UV 반응기에서의 제거율을 알아봄과 동시에 배출가스의 중간생성물, 이산화탄소 그리고 미세먼지에 대해 연구하였다.
4종 염소계 VOCs의 제거율은 광산화 반응보다 광분해 반응에서 더 높은 제거율이 나타났으며 광분해 반응 시 수소원자를 갖고 있는 물질들에서는 >99% 제거되었음을 확인할 수 있었다. 또한 염소계 VOCs는 광산화 시 생성되는 오존이 UV254 nm 광자의 복사를 방해하여 염소계 VOCs 제거에 영향을 주는 것으로 판단되지만, TCE 같은 C=C이중결합 구조를 가진 VOCs는 오존과 강하게 반응하여 광자의 손실이 있더라도 오존에 의한 제거가 이루어지는 것으로 확인되었다. 중간생성물의 검출은 4종의 VOCs 중 3종의 VOCs에서 발견되었으며, 검출된 중간생성물 중 유독가스로 알려진 포스겐도 검출되었다. 검출된 포스겐은 본 연구에서는 TCM의 중간생성물로, 기존연구 (Mohseni, 2005)에서는 TCE의 중간생성물로 검출되었는데, 이는 실험조건인 VOCs의 농도 및 체류시간이 가장 큰 원인으로 판단되며 적절한 체류시간은 제거율뿐만 아니라 중간생성물의 성분 함유율의 제어도 가능할 것으로 판단된다. 또한 분자식에서 탄소수가 많고 무기화율이 가장 낮은 TCE에서만 PM이 검출되었다. PM이 TCE에서만 배출된 원인은 다른 물질들은 중간생성물의 비율이 9~17%로 낮았지만 TCE는 중간생성물의 비율이 83%를 차지하고 있어 PM의 배출량도 많은 것으로 사료된다. 또한 탄소 물질수지를 계산해 봄으로써 배출가스의 성분 비율을 확인하여 4종 VOCs의 중간생성물의 비율을 확인할 수 있었다.
따라서 본 연구를 바탕으로 염소계 VOCs 제거를 위해 UV램프를 사용하는 것은 좋은 방법이라고 생각되며, 염소계 물질 분해는 광산화 반응보다는 광분해 반응이 적절한 처리방법으로 확인되었다. 하지만 반응 후 배출되는 중간생성물 및 PM에 대한 각별한 주의와 2차 처리방안이 필요하며, 우리가 알고 있는 유해물질 외에 아직 보고되지 않은 유해물질이 있을 것이라 판단되기에 배출가스에서 검출되는 중간생성물의 성분분석과 동시에 생물독성 시험법을 통한 독성연구도 필요하다고 생각된다.
Acknowledgments
This research is supported by National Natural Science Foundation of China (Grant No. 51378286).
References
-
Cao, L.X., Z. Gao, S.L. Suib, T.N. Obee, S.O. Hay, and J.D. Freihaut, (2000), Photocatalytic oxidation of toluene on nanoscale TiO2 catalysts: Studies of deactivation and regeneration, Journal of Catalysis, 196(2), p253-261.
[https://doi.org/10.1006/jcat.2000.3050]

- Chen, F.Y., S.O. Pehkonen, and M.B. Ray, (2002), Kinetics and mechanisms of UV-photodegradation of chlorinated organics in the gas phase, Water Research, 36(17), p4203-4214.
-
Cheng, Z.W., P.F. Sun, Y.F. Jiang, J.M. Yu, and J.M. Chen, (2013), Ozone-assisted UV254nm photodegradation of gaseous ethylbenzene and chlorobenzene: Effects of process parameters, degradation pathways, and kinetic analysis, Chemical Engineering Journal, 228,, p1003-1010.
[https://doi.org/10.1016/j.cej.2013.05.076]

- Cho, I.C., J.H. Byun, E.S. Byun, D.G. Lee, and S.W. Kim, (2001), Gas phase photocatalytic oxidation of PCE with TiO2, Journal of Korean Society for Atmospheric Environment, 17(1), p57-66, (in Korean with English abstract).
- Gong, S.Y., S.P. Hong, and G.S. An, (2014), Impacts of facilities with strengthened emission limit value on environmental technology development and emission reduction, Research Report 2014-09, Korea Environment Institute, Korea, p51-57.
-
Kam, S.K., J.W. Jeon, and M.G. Lee, (2014), Effect of methyl ethyl ketone and ethyl acetate vapor on photocatalytic decomposition of n-pentane vapor, Journal of Environmental Science International, 23(6), p1151-1156, (in Korean with English abstract).
[https://doi.org/10.5322/jesi.2014.23.6.1151]

-
Keshmiri, M., T. Troczynski, and M. Mohseni, (2006), Oxidation of gas phase trichloroethylene and toluene using composite sol-gel TiO2 photocatalytic coatings, Journal of Hazardous Materials, 128(2), p130-137.
[https://doi.org/10.1016/j.jhazmat.2005.07.060]

-
Kim, K.J., and O.H. Park, (2008), A comparative study on degradation of BTEX vapor by O3/UV, TiO2/UV, and O3/TiO2/UV system with operating conditions, Journal of Korean Society for Atmospheric Environment, 24(1), p91-99, (in Korean with English abstract).
[https://doi.org/10.5572/kosae.2008.24.1.091]

-
Larson, S.A., and J.L. Falconer, (1994), Characterization of TiO2 photocatalysts used in trichloroethene oxidation, Applied Catalysis B: Environmental, 4(4), p325-342.
[https://doi.org/10.1016/0926-3373(94)00030-1]

- Lee, E.J., and K.H. Lim, (2010), Treatment of malodorous waste air using hybrid system, Korean Chemical Engineering Research, 48(3), p382-390, (in Korean with English abstract).
- Lee, S.Y., S.M. Lee, Y.J. Kim, I.K. Kim, and D.H. Choi, (2015), Transboundary air pollution management strategies among China, Japan, and Korea, Research Report 2015-02, Korea Environment Institute, Korea, p1.
-
Mohseni, M., (2005), Gas phase trichloroethylene (TCE) photooxidation and byproduct formation: photolysis vs. titania/silica based photocatalysis, Chemosphere, 59(3), p335-342.
[https://doi.org/10.1016/j.chemosphere.2004.10.054]

-
Moussavi, G., and M. Mohseni, (2007), Using UV pretreatment to enhance biofiltration of mixtures of aromatic VOCs, Journal of Hazardous Materials, 144(1), p59-66.
[https://doi.org/10.1016/j.jhazmat.2006.09.086]

- Rafael, M.R., and C.M. Nelson, (1998), Relationship between the formation of surface species and catalyst deactivation during the gas-phase photocatalytic oxidation of toluene, Catalysis Today, 40(4), p353-365.
-
Rosenlund, M., F. Forastiere, D. Porta, M.D. Sario, C. Badaloni, and C.A. Perucci, (2009), Traffic-related air pollution in relation to respiratory symptoms, allergic sensitisation and lung function in schoolchildren, Thorax, 64(7), p573-580.
[https://doi.org/10.1136/thx.2007.094953]

-
Rundell, K.W., J.B. Slee, R. Caviston, and A.M. Hollenbach, (2008), Decreased lung function after inhalation of ultrafine and fine particulate matter during exercise is related to decreased total nitrate in exhaled breath condensate, Inhalation Toxicology, 20(1), p1-9.
[https://doi.org/10.1080/08958370701758593]

-
Wang, C., J.Y. Xi, and H.Y. Hu, (2008), A novel integrated UVbiofilter system to treat high concentration of gaseous chlorobenzene, Chinese Science Bulletin, 53(17), p2712-2716.
[https://doi.org/10.1007/s11434-008-0367-5]

- Wang, C., J.Y. Xi, and H.Y. Hu, (2009), Reduction of toxic products and bioaerosol emission of a combined ultraviolet-biofilter process for chlorobenzene treatment, Journal of the Air & Waste Management Association, 59(4), p405-410.
-
Wei, Z.S., J.L. Sun, Z.R. Xie, M.Y. Liang, and S.Z. Chen, (2010), Removal of gaseous toluene by the combination of photocatalytic oxidation under complex light irradiation of UV and visible light and biological process, Journal of Hazardous Materials, 177(1), p814-821.
[https://doi.org/10.1016/j.jhazmat.2009.12.106]

-
Yu, J.M., W.J. Cai, J.M. Chen, L. Feng, Y.F. Jiang, and Z.W. Cheng, (2012), Conversion characteristics and mechanism analysis of gaseous dichloromethane degraded by a VUV light in different reaction media, Journal of Environmental Sciences, 24(10), p1777-1784.
[https://doi.org/10.1016/s1001-0742(11)61021-8]