아스펜플러스와 엑서지기법을 사용한 배기가스 내 이산화탄소의 액상 광물화공정 개발
Abstract
The aqueous process for the mineralization of CO2 exhausted from industrial sites has been optimized through exergy analysis using the commercial code, Aspen Plus. It has been verified that CO2 could be converted to calcium carbonate (CaCO3) via the formation of calcium hydroxide (Ca(OH)2) using starting materials including calcium oxide (CaO) and water. Modelling was performed by changing the amount of CaO for water from 1 to 50 w/w%. The highest yield of CaCO3 was achieved by mixing 15 w/w% CaO in water under the ambient condition. The current simulation using exergy analysis contributed to finding an optimum reaction condition for CO2 mineralization without high cost experimental works.
Keywords:
Carbon sequestration, Carbon capture and storage, Mineralization, Carbon dioxide, Exergy analysis, Process optimization1. 서 론
지구온난화 (global warming)의 주된 온실가스 (greenhouse gases, GHG) 중 하나인 이산화탄소 (carbon dioxide, CO2)를 감축시키는 효율적 방법이 지속적으로 연구되고 있다 (Kenarsari et al., 2013). 이를 위해서 다양한 연구방법이 제안되고 있는데, 그중 이산화탄소의 포집 및 이용에 대한 (CO2 capture and utilization, CCU) (Rafiee et al., 2018) 기술에 초점이 맞춰지고 있다. 특히 광물화기술 (mineralization technology)에 대한 연구가 전 세계적으로 다양하게 이루어지고 있는데 (Romanov et al., 2015; Sanna et al., 2012; Kirchofer et al., 2012), 광물화를 통해서 얻어지는 물질을 고부가가치의 원료로 재활용할 수 있기 때문이다 (Xie et al., 2016). 기본 반응은 다음과 같은 화학반응식을 통해 CaCO3가 생성된다 (CaSiO3+CO2 → CaCO3+ SiO2, Ca(OH)2+CO2 → CaCO3+H2O). 대용량 규모로 응용 시, 아민계 (monoethanolamine, MEA) (Jeong et al., 2018; Woo et al., 2012) 혹은 알칼리 무기물이 함유된 칼슘이나 마그네슘 계통의 물질을 흡수제 (absorbent) 용도로서 사용하여 CO2를 탄산염 (carbonates)의 형태로 고정화하는데, 이 경우 산업시설에서 발생되는 석탄재 (coal ash) 혹은 석유재 (petroleum ash)에 적용하거나, 건설현장에서 발생되는 폐기물인 레미콘 회수수 (ready-mixed concrete recovery water)나 순환골재 (recycled aggregates)에 적용이 가능한 것으로 알려져 있다 (Li et al., 2016; Chae et al., 2009). 발전소에서 발생하는 배가스 내의 CO2 활용을 위한 광물탄산화공정은 크게 직접광물탄산화와 간접광물탄산화로 나눌 수 있다. 직접광물탄산화 기술은 가스상인 CO2와 액상의 알칼리 무기물이 함유된 물질과 반응 (aqueous method)할 경우 효율이 매우 높은 장점이 있는데, 가스상인 CO2와 고체상인 알칼리 무기물이 함유된 물질과 반응 (gas-solid method)할 경우에는 효율이 다소 낮아서, 일반적으로는 수용액하에서 알칼리 무기물의 추출과정을 거친 후 CO2와의 반응성을 높여 진행되는 간접광물탄산화 방법 (aqueous method) 이 주로 활용되고 있다. 따라서 고체상인 알칼리 무기물이 함유된 물질을 탄산화반응 원료로 이용할 경우에는 CO2 전환율로 표현되는 탄산화 수율과 생성되는 탄산염의 순도 등을 고려하여 간접광물탄산화 방법을 통해 산업적 활용 정도를 높여야 하는 특징이 있다 (Azdarpour et al., 2015).
본 연구에서 엑서지 분석 (exergy analysis) (Querol et al., 2013; Kotas, 1985)을 위해 사용되어진 아스펜플러스 (Aspen Plus, AspenTech, USA)는 화학공정모사 분야에서 가장 많이 사용되는 상용화 모사기 중의 하나로, 화학공정에서 필수적인 반응기와 화학공장이나 발전소에서 사용되는 단위조작 (unit operations) 모쥴을 포함하고 있어서 대용량 장치를 설치하지 않고서도 실제 생산규모의 결과를 예측할 수가 있으므로 시간과 비용을 상당히 절감할 수 있다. 특히 화학공정 모사에 사용되는 성분의 데이터베이스가 아스펜플러스에 내장되어 있어서 손쉽게 화학물질의 물성과 열역학 변수들을 계산할 수가 있다. 특히 본 연구에서는 이미 전처리 과정을 통해 추출된 순도 100% 수준의 CaO를 물에 용해하여 수용액하에서 CO2와의 반응으로 CaCO3를 제조하는 실증 결과를 1차적으로 검증하고, 이에 소모되는 에너지를 산정한 후 엑서지 분석을 응용하여 최적화된 값을 찾아보고자 한다. 이를 위해 아스펜플러스를 응용해서 CaCO3를 석출하는 공정을 모사하고자 하였다. 이때 사용되는 CO2는 연소배가스 (exhaust gas)에 포함된 것으로서 CaO를 사용해서 탄산화공정 (carbonation process)을 설계하였고, 실제 실험에 사용된 압력과 온도 조건, 그리고 물의 투입량도 현장에서 실제 사용된 데이터를 사용해서 CaCO3의 생성량을 극대화시킬 수 있는 조건을 찾고자 하였다.
2. 연구 방법 및 분석
2. 1 아스펜플러스를 사용한 공정 모델링
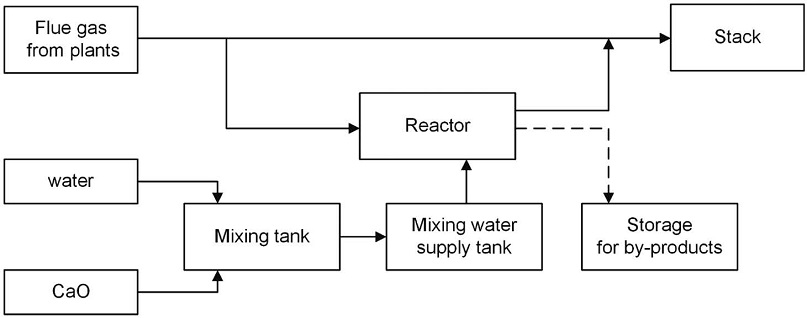
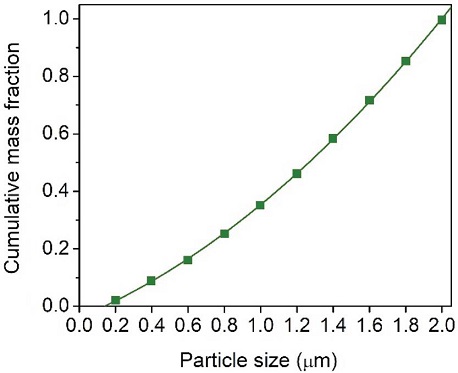
본 연구의 기본 공정은 그림 1과 같으며 (Yi et al., 2018), 광물탄산화에 대한 기초 공정 모사 결과를 수집하기 위하여 아스펜플러스 (Aspen Plus, AspenTech, USA)를 사용하였다. 공정모델을 위해 SOLIDS 물성식을 사용하였고, 연구의 중점 물질인 CO2 외에 실제 현장에서 배출되는 배기가스의 조성에 따라 산소와 질소도 함께 사용하였다. CO2 공급량은 실제 현장에서 사용되는 멤브레인필터 (membrane filter)를 통해 질량 기준으로 80%의 CO2를 반응기에 주입하기 위해서 설정하여 83 kg/hr의 CO2를 기준으로 재환산하여 약 100 kg/hr가 공급되는 것으로 가정하였다. 공정모사에 사용된 화학종은 표 1에 정리하였으며, CaO, Ca(OH)2 그리고 CaCO3는 고체 상태로 사용하였다. 이를 위한 전제조건으로 공정모델링에 사용된 고체입자 입도분포 (PSD; particle size distribution)를 도출하기 위해서 아스펜플러스에 내장되어 있는 GGS 분포함수 (Gates-Gaudin-Schuhmann distribution function)를 적용하였다. 실제 실험에서 측정된 값과 유사한 2 μm 직경의 입자를 사용하기 위하여, 0~2 μm를 조건으로 하고 이로부터 계산된 열 개의 값을 연속선으로 회귀 (regression)한 함수를 적용하였다 (그림 2).
2. 2 엑서지 분석 (Exergy analysis) 기법
본 연구에서는 탄산화반응 (carbonation process)과 함께 엑서지 분석 (exergy analysis) 기법을 병행하여 반응공정에서 발생할 수 있는 반응모델들에 대한 연구를 통해 보다 효율적인 반응조건을 도출하고, 이를 기반으로 연소배가스에 포함된 이산화탄소를 광물탄산화 방법을 사용하여 활용하는 연구를 수행하였다. 이를 위해 아스펜플러스에서는 기본적으로 제공되지 않는 물성치 (property)를 추가로 입력하였다. 이때 필요한 물성치는 온도 (temperature), 압력 (pressure), 엔트로피 (entropy, S), 엔탈피 (enthalpy, H), 그리고 엑서지 (exergy)이다. 여기서, 엑서지는 물리적 엑서지 (physical exergy) 형태로 도출되는데, 반응물질들에 대한 물성의 기초자료를 입력하였고, 실제 실험을 수행할 때 적용하기 위하여 그림 1에 요약한 바와 같이 공정모델을 준비하였다. 위에 언급한 것처럼 배기가스 자체가 모델에 주는 영향은 적지만 좀더 현실적인 값으로 사용하기 위해서 참고문헌 (Yi et al., 2018)에서 사용된 동일한 값을 선택하여 표 2에 정리하였다. 배기가스의 공급 유량은 1306.9 kg/hr이며, 이때 포함된 이산화탄소는 100.6 kg/hr (1306.9 kg/hr×0.077)이다. 이는 이산화탄소 83 kg/hr을 대략적으로 실제 실험에서 사용된 이산화탄소 유입이 80% 정도인데, 재환산해서 총 유량을 계산한 값을 사용하였다. 다만 본 연구는 기초적인 실험을 실시함으로써 추후 진행할 보다 상세한 연구에 대한 조건을 도출하기 위한 것이므로 본 공정 모사에서 언급된 이산화탄소의 값은 임의의 값으로 인식해도 무방할 것으로 가정하였다. 본 연구에서 반응물질로 사용하는 CaO의 유량을 엑서지기법을 사용하여 다양한 변화를 확인하는 변수로 사용하였고, 다른 물질과 혼합되어 있지 않은 순수한 CaO인 것으로 가정하였다 (mass fraction of CaO=1).
실험 현장에서 파악된 중요한 요인 중의 하나는 CaO와 혼합하여 Ca(OH)2를 생성시키기 위해서 사용되는 공정수 (물)에 대한 조건이다. 따라서 본 연구에서는 공정수의 총유량 (917 kg/hr)은 변수로 사용하지 않았으며, CaO의 사용량을 변화시키면서 전체 공정에 영향을 주는 엑서지를 계산하면서 그 영향을 관찰하였다. 본 연구에서는 상온 (25℃)과 상압 (1 atm) 조건으로 고정해서 공정모사를 수행하였다.
아스펜플러스에서 제공하는 화학반응기모델 중에서 RGibbs 모델을 사용하였으며, 그 조건은 다양한 기초 시험을 통하여 선정하였고, 상평형 (phase equilibrium)과 화학평형 (chemical equilibrium)을 모두 고려하였다.
3. 결과 및 고찰
본 연구에서는 생산시설의 연소공정으로부터 발생하는 CO2의 광물탄산화반응과 처리공정에 대한 보다 상세한 연구개발을 위한 기초 단계로서 아스펜플러스를 사용하여 이론적인 공정의 구성조건을 해석하였다. 이를 통해서 실제 실험을 현장에서 수행하거나 필요한 물질이나 에너지수지상에서 필요한 변수 값들을 자유롭게 변경하면서 다양한 공정의 조건을 가상하여 설계인자를 도출할 수 있는 기반 정보를 얻고자 하였다.
3. 1 아스펜플러스를 사용한 공정 모델링
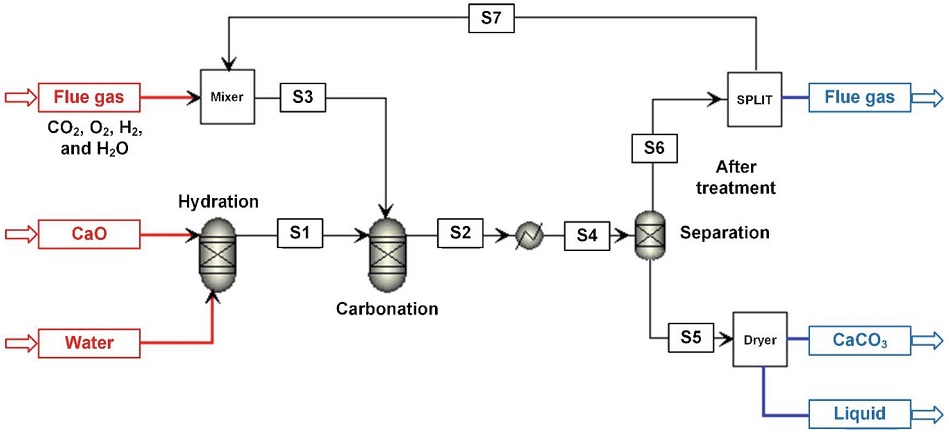
본 연구에서 대상으로 삼은 전형적인 현장의 실제 공정도 (flow chart)를 그림 3에 도시하였다. 모델링을 위한 계산 조건은 다음과 같다.
- • 모델링에서의 반응은 정상상태 (steady state)를 유지하는 것으로 가정하였다.
- • 배기가스의 경우, 순수한 CO2가 아니라 질량분율 (mass fraction) 기준으로 O2 (0.053), CO2 (0.077), N2 (0.747) 그리고 H2O (0.123)를 사용하였다.
- • CaO와 물이 반응해서 생성되는 Ca(OH)2와 유입되는 가스는 양론비적으로 균일하게 반응한다.
그리고 수화공정 (hydration process)과 탄산화공정 (carbonation process)을 주된 반응으로 설정하는 화학반응기모델을 사용하였다.
| (1) |
| (2) |
실제 현장에서 사용되는 반응기를 모사하기 위해 아스펜플러스에서 제공하는 반응기모델을 다양한 조건에 대하여 비교하였다. 먼저, 온도에 대한 영향을 고찰하기 위해서는 반응속도상수를 사용할 수 있는 RCSTR과 RPlug의 모델이 있으나, 참고문헌의 결과로부터 신뢰성이 높은 반응속도상수를 구할 수 없으므로 본 연구에서는 RGibbs 반응기모델을 사용하였다. 표 3에 공정모델링을 위한 스트림 (stream; S1~S7)을 상세히 정리하였다. 이에 따라 일차 반응인 수화반응을 통해서 CaO와 물을 반응시켜 Ca(OH)2를 생성시켰고, 물은 상온, 상압 조건으로 고정해서 사용하였다. 그리고 이때 CaO의 양을 물과의 질량분율 기준으로 1~50%까지 변화시켜 공정모델링의 주변수로 사용하였고, Ca(OH)2의 생성량을 조절할 수 있도록 하였다. 본 연구에서 언급된 것처럼 물의 주입량은 917 kg/hr 로 고정하였고, 이를 기준으로 CaO의 상대적인 투입량을 조절하면서 반응변화를 관찰하였다.
생성된 Ca(OH)2는 배기가스로부터 분리된 CO2 가스와 수용액상에서 반응하여 CaCO3를 생성한다. 실제 연구에서는 배가스 후단에서 분리된 CO2의 80% 수준이 선택적으로 반응에 기여하지만, 본 공정모사에서는 분리없이 배기가스 성분을 유지하고, 1306.9 kg/hr의 배기가스를 사용하였다. 이때 포함된 CO2의 양은 100.6 kg/hr이다. 실제 실험의 경우는 미반응한 가스상은 별도의 분리공정이 필요없으나, 본 연구에서 엑세지분석을 하기 위해서는 반응생성물과 미반응물에 대한 당량비 (mole ratio)가 필수 데이터이기에 분리공정을 추가하였다. 본 분리 공정기를 통과한 CaCO3 (CaCO3+H2O)는 미반응 물질인 CO2, N2 그리고 O2로부터 분리를 시켰다. 분리공정을 위해서 필요한 열을 공급하기 위하여 전단에 히터 (heater)를 설치하였다. 예를 들어, 히터가 없이 구성한 공정의 경우에는 분리단계 후의 S5와 S6의 온도가 분리공정 전후의 에너지수지 탓에 음의 값이 되고 이때의 온도는 CaO의 농도에 따라 미소한 차이가 생김을 발견하였다. 히터는 25℃와 1 atm 상태를 유지한 상태에서 가동하였을 때, 전력 소모량은 최대 CaO와 물의 질량분률이 50%인 경우 8,966 kW인 것으로 확인되었다. 특히 그림 3의 공정도에서 분리공정 후에 Water의 경우는 물과 수화반응에서 생성되어진 미반응된 Ca(OH)2의 합이다. 본 분리공정을 통과한 후, 침전되는 CaCO3는 건조 (dryer) 공정을 통해서 최대 70%까지 물을 분리하였다. 본 연구에서는 재활용하지 않았지만 추후 공정 모사에서는 Ca(OH)2 수용액을 생성하는 연속공정에서 사용되는 물의 양을 절약하기 위해서 재활용을 할 예정이다.
3. 2 엑서지 분석 (Exergy analysis)을 사용한 액상 광물화 공정 분석
아스펜플러스를 사용하여 액상 광물화 실험 공정에 사용된 조건을 적용하여, 본 공정의 엑서지를 계산하고 이를 토대로 최적의 CaO 사용량과 물을 적용하였을 때, 생성되는 Ca(OH)2를 식 (1)을 사용하여 계산하고, 배기가스에 포함된 CO2와의 반응을 식 (2)를 통해서 계산한 결과는 표 4에 요약한 바와 같다. 위에서 언급한 기초공정을 사용하여 두 반응기모델이 안정적으로 작동하는 조건을 찾기 위해서 엑서지 분석 (exergy analysis)을 수행하였다 (Choi et al., 2017; Querol et al., 2013; Kotas, 1985). 열역학 제1법칙 (the first law of thermodynamics)을 기반으로 하는 에너지분석법 (energy analysis)은 오직 에너지보존 (energy conservation)에 대해서만 분석이 가능하기 때문에, 실제 공정 내에서 발생되는 에너지손실 (energy loss)이 일어나는 위치 (location) 그리고 수반되는 양 (quantity)을 파악할 수는 없다. 따라서 반응공정상에서의 에너지의 질 (quality)을 정확하게 정량적으로 평가할 수 없다. 이에 반하여 열역학 제2법칙 (the second law of thermodynamics)을 기반으로 하는 엑서지기법은 에너지원들에 대한 정량적인 분석이 가능하므로 공정에서 일어나는 에너지 변화량을 보다 원활하게 분석할 수 있다. 즉, 대상시스템, 혹은 단위조작 (unit operation)의 투입값과 배출값을 비교함으로써 손실이 일어나는 원인과 위치를 파악하는 것이 가능하므로, 화학공정분석에 널리 사용된다 (Noroozian et al., 2017; Mukherjee et al., 2015).
엑서지 분석을 위해서는 1차적으로 물리적 엑서지 (physical exergy, Ex_phys)와 화학적엑서지 (chemical exergy, Ex_chem)를 분리해서 계산해야 한다. 이때, 물리적엑서지 (Ex-phys=(H-H0)-T0(S-S0))는 일반적으로 아스펜플러스를 사용하여 계산할 수 있다. 물리적엑서지를 계산하는 식에서 H와 S는 사용되는 온도와 압력 (T, P)에 의존하는 엔탈피 (kJ/mol)와 엔트로피 (kJ/mol.K)를 나타내며, H0와 S0는 기준조건인 T0=25℃, P0=1 atm에서 계산이 된 엔탈피와 엔트로피 수치이다. 화학적엑서지의 경우는 이론적으로 계산이 가능하지만, 본 연구에서는 표 3에 나열한 참고문헌 값을 사용하였다. 반응 공정 전체의 엑서지 값 (Total exergy=Ex_phys+Ex_chem)은 물리적엑서지와 화학적엑서지를 합하여 계산하였다 (Querol et al., 2013).
표 5는 1% CaO (CaO/H2O=9.17 kg/hr / 917 kg/hr) 공급조건에서의 엑서지 결과이다. 본 계산을 위해 대부분의 에너지가 분리공정 (separation process)에서 히터 가동에 사용되기 때문에 반응기에서 일어나는 엑서지 변화를 관찰하기 위해서 반응모델을 중점적으로 고찰하였다. 표 5의 결과를 보면, CaO의 양에 따라서 생성열 (heat of formation)이 변하므로 이에 따라 탄산화공정에 영향을 미치는 것을 발견하였다. 그리고 표 3에 정리되어 있는 본 공정모델링에서 사용한 S1~S7의 경우, 표 5와 6에 정리되어 있는 것처럼 S1과 S2를 제외한 다른 스트림 (stream; S3~S7)은 물리적엑서지의 영향이 없고, 화학적엑서지만 변화됨을 알 수 있다. 이는 그 전후 단계의 단위공정과 물리적엑서지를 주요 변화 요인인 압력과 온도에 변화가 없음을 나타낸다.
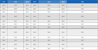
Compilation of physical exergy, chemical exergy, and total energy in kW for each stream under 1% CaO in water.

Compilation of physical exergy, chemical exergy, and total energy in kW for each stream under 10% CaO in water.
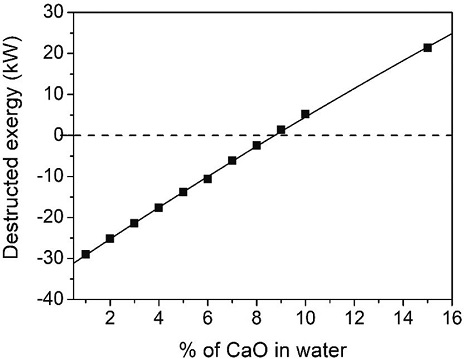
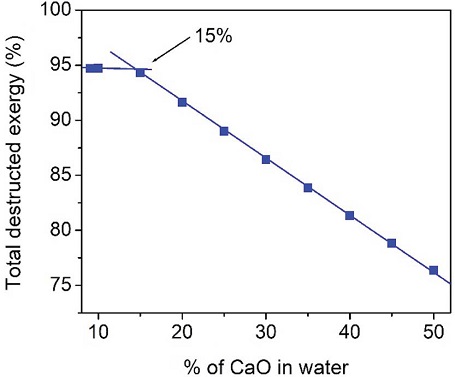
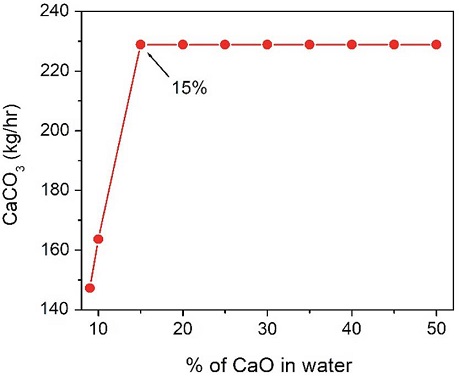
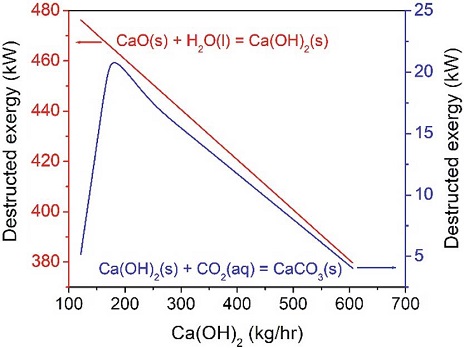
CaO를 1% 첨가한 경우에는 탄산화반응기의 엑서지가 음수값 (negative value)으로 계산됨으로써 시스템 전체 엑서지 균형 (exergy blance)이 맞지 않게 된다. 따라서 CaO 양을 변화시켜 가면서 양수값 (posi-tive value)으로 변하는 지점을 찾아 엑서지 분석을 의미있게 진행하였다. 그림 4에서 보여주는 것처럼 9%-CaO (CaO/H2O=82.5 kg/hr / 917 kg/hr)를 가했을 때부터 탄산화공정의 엑서지가 양수값으로 나타나기 시작하였고, CaO (CaO/H2O=91.7 kg/hr / 917 kg/hr)가 10% 되는 공급 조건에서 계산된 엑서지를 표 6에 정리하였다. 본 연구에서 전체 시스템의 파괴된 엑서지 (total destructed exergy, %)는 전체 시스템에서 사용된 엑서지와 파괴된 엑서지의 비로 정의되어진다. 사용된 엑서지는 그림 3의 공정도에 나타난 Flue gas, CaO 그리고 Water 외에도 수화반응에 사용된 에너지 (heat duty)도 포함된다. 표 7에 CaO를 10% 사용한 경우에 대해서 엑서지 결과를 정리해 놓았다. 그림 5에서 볼 수 있듯이 CaO의 농도가 9%에서부터 15%까지는 전체 시스템의 파괴된 엑서지 (destructed exergy) 변화가 거의 없다가 15% 이후부터는 점점 감소되는 것이 관찰되어졌다. 본 경향을 분석하기 위해서 CaO 농도에 대한 전체엑서지 값의 변화를 표 8에 정리하였다. 아래 설명되어진 것처럼 수화반응을 거쳐서 생성되는 Ca(OH)2가 주입되는 CO2와 당량비로 반응하므로 CaCO3는 15% 이후에는 그 생성량이 일정하게 유지됨을 관찰하였다. 즉, CaCO3를 생성하는 데 사용되어지지 않고 미 반응물로 남는 Ca(OH)2가 증가함으로써 전체 파괴된 엑서지가 줄어드는 것으로 판단된다. 이때 생성되는 CaCO3의 변화를 그림 6에 도시하였고, 물에 15% CaO가 용해된 수용액 조건이 본 연구에서 사용된 조건을 기반으로 가장 최적 농도임을 본 엑서지기법으로 확인할 수 있었다. 그리고 중간생성물인 Ca(OH)2의 영향을 확인하기 위해서 그림 7에 Ca(OH)2의 생성량의 변화에 수화반응공정 (식 1)과 탄산화반응공정 (식 2)의 영향을 고찰하였다.
본 공정모델링에서는 CO2의 전체 사용량은 100.6 kg/hr로 확인되었고, 수화반응의 경우는 엑서지는 그림 5의 경우처럼 Ca(OH)2가 CaO의 사용량과 비례적으로 감소됨을 확인할 수 있었다. 하지만 탄산화반응의 경우는 Ca(OH)2의 생성량이 대략 182 kg/hr이 되는 양까지 증가하다가 감소하는 경향을 그림 7에서 보여주고 있다. 결과적으로 본 연구에서 엑서지기법을 통해서 에너지를 최적화하면서 최종 목표 생성물인 CaCO3의 이론량을 계산할 수 있었다. 하지만 현재 모델링은 실제 전체 액상 광물화 공정을 분석하는 초기단계로서, CO2의 광물탄산화에 대한 대용량 연구 관련에 대해서 본 공정모델링을 통해서 CaCO3의 생성을 증대시킬 수 있는 더 상세한 방안을 고려할 수 있을 것으로 사료된다. 이를 통해서 실제로 사용되는 대용량의 CaO와 기타 설비를 사용하지 않고, 본 연구 기법을 사용해서 공장규모의 설비를 하지 않고 다양한 예측을 할 수 있다. 그중의 한 가지가 고체물질을 사용하는 연구이기에 그림 1에서 보여진 것처럼 마이크론 크기 (micron size)의 CaO 물질을 나노크기 (nano size)로 사용하여 언급된 최적 농도에 어떤 변화를 줄지를 앞에서 사용된 엑서지기법과 적용해서 전체 결과에 영향을 주는지를 고찰하고 실제 공정에서 그 결과를 비교 분석할 수 있을 것으로 보인다.
4. 결 론
아스펜플러스를 사용하여 연소공정에서 발생하는 배가스 내의 CO2 활용을 위한 광물탄산화공정을 연구하였다. 본 연구에서는 고가의 흡수제 없이 CaO와 물만으로 CO2와의 탄산화반응을 응용하여 CaCO3를 제조하는 결과를 공정모사로 검증하고, 엑서지 분석을 수행하였다. 현장에서 사용하고 있는 압력, 온도 그리고 물의 투입량을 적용하여 CaCO3가 생산되는 양을 최적화된 값을 찾아보았다. 반응물인 CaO의 양을 물과의 질량분율 기준으로 1~50%까지 변화시켜 공정모델링의 주변수로 사용하여서 Ca(OH)2의 생성량을 용이하게 조절하여 최종 생성물을 변화를 통해서 최적화된 CaO의 농도를 예측할 수 있었다. 그리고 이때 생성되는 CaCO3의 변화를 확인하였으며, 15 w/w % CaO가 물에 용해된 수치가 본 연구에서 사용된 조건을 기반으로 가장 최적 농도임을 확인할 수 있었다. 본 연구에서 사용된 마이크론 크기의 CaO를 나노 크기의 형태로 변경을 한다면 물과 반응할 표면적을 증대하여 Ca(OH)2의 생성을 더 용이하게 할 것으로 예상되며, 이에 대한 변화를 엑서지기법으로 확인이 가능할 것으로 예상된다.
Acknowledgments
본 연구는 산업통상자원부의 재원으로 한국에너지기술평가원의 에너지기술개발사업 (20172010202050)의 지원을 받아 연구되었습니다. This work was supported by the Higher Education Sprout Project of the National Chiao Tung University and Ministry of Education (MOE), Taiwan.
References
-
Azdarpour, A., Asadullah, M., Mohammadian, E., Hamidi, H., Junin, R., Karaei, M.A. (2015) A review on carbon dioxide mineral carbonation through pH-swing process, Chemical Engineering Journal, 279, 615-630.
[https://doi.org/10.1016/j.cej.2015.05.064]

- Chae, S.-C., Jang, Y.-N., Ryu, K.-W. (2009) Mineral carbonation as a sequestration method of CO2, Journal of the Geological Society of Korea, 45(5), 527-555, (in Korean with English abstract).
-
Choi, Y., Choi, C.S., Hong, B., Cho, S.S., Kim, Y.J., Kim, H.J. (2017) Heat Recovery Modeling and Exergy Analysis of Dry Combustion Process for Explosive Gas Treatment Using Aspen Plus, Journal of Korean Society for Atmospheric Environment, 33(5), 521-528, (in Korean with English abstract).
[https://doi.org/10.5572/KOSAE.2017.33.5.521]

-
Jeong, C.J., Song, H.Y., Hong, B.E., Choi, C.S. (2018) A study of carbon dioxide reduction through the liquid accelerated carbonation using coal ash, Journal of the Korean Society for Environmental Technology, 19(1), 1-9, (in Korean with English abstract).
[https://doi.org/10.26511/JKSET.19.1.1]

-
Kenarsari, S.D., Yang, D., Jiang, G., Zhang, S., Wang, J., Russell, A.G., Wei, Q., Fan, M. (2013) Review of recent advances in carbon dioxide separation and capture, RSC Advances, 3(45), 22739-22773.
[https://doi.org/10.1039/c3ra43965h]

-
Kirchofer, A., Brandt, A., Krevor, S., Prigiobbe, V., Wilcox, J. (2012) Impact of alkalinity sources on the life-cycle energy efficiency of mineral carbonation technologies, Energy & Environmental Science, 5(9), 8631-8641.
[https://doi.org/10.1039/c2ee22180b]

-
Kotas, T.J. (1985) Chapter 2 - Basic exergy concepts. In The Exergy Method of Thermal Plant Analysis, Kotas, T.J., Ed. Butterworth-Heinemann. pp. 29-56.
[https://doi.org/10.1016/B978-0-408-01350-5.50009-X]

-
Li, K., Leigh, W., Feron, P., Yu, H., Tade, M. (2016) Systematic study of aqueous monoethanolamine (MEA)-based CO2 capture process: Techno-economic assessment of the MEA process and its improvements, Applied Energy, 165, 648-659.
[https://doi.org/10.1016/j.apenergy.2015.12.109]

-
Mukherjee, S., Kumar, P., Yang, A., Fennell, P. (2015) Energy and exergy analysis of chemical looping combustion technology and comparison with pre-combustion and oxy-fuel combustion technologies for CO2 capture, Journal of Environmental Chemical Engineering, 3(3), 2104-2114.
[https://doi.org/10.1016/j.jece.2015.07.018]

-
Noroozian, A., Mohammadi, A., Bidi, M., Ahmadi, M.H. (2017) Energy, exergy and economic analyses of a novel system to recover waste heat and water in steam power plants, Energy Conversion and Management, 144, 351-360.
[https://doi.org/10.1016/j.enconman.2017.04.067]

-
Querol, E., Gonzalez-Regueral, B., Perez-Benedito, J.L. (2013) Practical Approach to Exergy and Thermoeconomic Analyses of Industrial Processes. Springer.
[https://doi.org/10.1007/978-1-4471-4622-3]

-
Rafiee, A., Rajab Khalilpour, K., Milani, D., Panahi, M. (2018) Trends in CO2 conversion and utilization: A review from process systems perspective, Journal of Environmental Chemical Engineering, 6(5), 5771-5794.
[https://doi.org/10.1016/j.jece.2018.08.065]

-
Romanov, V., Soong, Y., Carney, C., Rush, G.E., Nielsen, B., O'Connor, W. (2015) Mineralization of Carbon Dioxide: A Literature Review, ChemBioEng Reviews, 2(4), 231-256.
[https://doi.org/10.1002/cben.201500002]

-
Sanna, A., Hall, M.R., Maroto-Valer, M. (2012) Post-processing pathways in carbon capture and storage by mineral carbonation (CCSM) towards the introduction of carbon neutral materials, Energy & Environmental Science, 5(7), 7781-7796.
[https://doi.org/10.1039/c2ee03455g]

- Szargut, J. (2005) Exergy Method: Technical and Ecological Applications. WIT Press: Southampton, UK.
-
Woo, D.S., Nam, S.C., Jeong, S.K., Yoon, Y.I. (2012) Simulation on CO2 capture process using an Aqueous MEA solution, Journal of the Korea Academia-Industrial cooperation Society, 13(1), 431-438, (in Korean with English abstract).
[https://doi.org/10.5762/KAIS.2012.13.1.431]

-
Xie, H., Tang, L., Wang, Y., Liu, T., Hou, Z., Wang, J., Wang, T., Jiang, W., Were, P. (2016) Feedstocks study on CO2 mineralization technology, Environmental Earth Science, 75(7), 615.
[https://doi.org/10.1007/s12665-016-5352-8]

-
Yi, S., Choi, C., Cho, S.-S., Seo, M.-h., Ji, G.-c., Kim, I.-b., Choi, S.-m., Chang, W.S., Lim, S.-M. (2018) LCA for Manufacturing of Construction Materials using CO2 Mineral Carbonation Technology, Journal of Korea Society of Waste Management, 35(5), 464-470, (in Korean with English abstract).
[https://doi.org/10.9786/kswm.2018.35.5.464]

최용만 (Professor, College of Photonics, National Chiao Tung University, Tainan, Taiwan)
최창식 (고등기술연구원 플랜트엔지니어링센터 수석연구원)
서민혜 (고등기술연구원 플랜트엔지니어링센터 책임연구원)
김수현 (고등기술연구원 플랜트엔지니어링센터 수석연구원)
장원석 (한국지역난방공사 미래개발원 수석연구원)
조영민 (경희대학교 환경응용과학과 교수)